植物乳杆菌HS-R9培养基的优化
2022-03-14张靖轩,丛丽娜,陈清平,何媛媛,赵金,关长城
张 靖 轩, 丛 丽 娜, 陈 清 平, 何 媛 媛, 赵 金, 关 长 城
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
植物乳杆菌为一类革兰氏阳性菌,在自然界广泛存在,尤其是分布在海洋生物体和各类发酵食品中,同时也是动物胃肠道的优势菌群,具有调节动物胃肠道菌群平衡、改善肠道内环境、增强免疫力和抵抗力等多种功能[1-3]。此外,许多植物乳杆菌在代谢过程中除了会产生乳酸、乙酸、过氧化氢外,还会产生一些具有抑菌活性的物质,称为的植物乳杆菌素。它是植物乳杆菌代谢过程中合成并分泌到环境中的一类具有抑菌活性的杀菌蛋白或多肽物质[4-5]。田雪娇等[6]从泡菜中分离出一株植物乳杆菌LY-78,研究表明它能明显抑制致病菌的生长,延长牛肉保存时间。Wang等[7]从西藏牦牛粪便中分离出两株植物乳杆菌,它们对金黄色葡萄球菌、大肠杆菌表现出很强的抑制作用。Agbankpe等[8]从动物体内分离出来一株植物乳杆菌,经实验发现其在体外能明显抑制沙门氏菌的生长。由于植物乳杆菌素无毒副作用、无残留、无抗药性,并且可以抑制或杀死多种食品中常见的致病菌,具有热稳定性且易被人体肠道消化降解,因而作为一种生物防腐剂受到食品工业青睐[9]。
科学的培养基组分和配比不仅促进菌体的快速生长繁殖,增强微生物代谢性能,也能提高资源利用率,降低生产成本[10-11]。在提高菌种生长方面,高玉荣等[12]利用正交试验优化植物乳杆菌G1-28培养基,活细胞数最多可达1.98×1010CFU/mL;在提高抑菌活性方面,王瑶等[13]利用响应面法优化植物乳杆菌LPL-1培养基成分,使细菌素相对抑菌效价提高了1.62倍。以往实验室利用培养乳酸菌的通用MRS培养基进行植物乳杆菌发酵培养,但使用该培养基所分泌活性物质的产量较低,无法满足实际生产要求。
本实验以MRS培养基为基础,使用单因素试验和响应面法对培养基组分进行系统优化,以期提高植物乳杆菌的发酵转化率和生产效率。
1 材料与方法
1.1 材 料
1.1.1 菌 株
实验菌株:植物乳杆菌HS-R9,本实验室从大连海域的海参肠道中筛选得到。
指示菌株:副溶血性弧菌(Vibrioparahaemolyticus),中国普通微生物菌种保藏管理中心。
1.1.2 培养基
原始培养基(MRS培养基):牛肉膏10 g,蛋白胨10 g,酵母膏5 g,乙酸钠2 g,葡萄糖20 g,吐温-80 1 mL,磷酸二氢钾2 g,柠檬酸铵2 g,七水硫酸镁0.2 g,四水硫酸锰0.05 g;加蒸馏水至1 000 mL,pH调至6.3,121 ℃灭菌20 min。
LB培养基:酵母浸粉5 g,胰蛋白胨10 g,氯化钠10 g,琼脂粉20 g;加蒸馏水至1 000 mL,pH调至7.2,121 ℃灭菌20 min。
1.2 方 法
1.2.1 菌株活化与发酵
一级活化:将植物乳杆菌HS-R9接入10 mL的MRS液体培养基之中,接种量1%,在37 ℃、180 r/min摇床培养12 h。
二级活化:将一级活化后的菌液接种于50 mL 的MRS培养基,接种量2%,在37 ℃、180 r/min 培养24 h。
发酵培养:将二级活化后的菌液接种于100 mL 的MRS培养基中,接种量5%,在37 ℃、180 r/min发酵培养48 h。
1.2.2 培养基优化
1.2.2.1 单因素试验
以MRS为基础培养基,分别选择不同组分作为培养基的碳源、氮源和缓冲溶剂。碳源包括乳糖、葡萄糖、麦芽糖、蔗糖、可溶性淀粉;氮源包括牛肉膏、蛋白胨、酵母浸粉、胰蛋白胨;缓冲溶剂包括柠檬酸铵、柠檬酸氢二铵、硫酸铵、碳酸铵。分别将各个培养基在37 ℃、180 r/min条件下摇瓶发酵培养植物乳杆菌48 h,取发酵液在4 ℃、12 000 r/min 下离心10 min得到上清液。以副溶血性弧菌为指示菌,利用牛津杯法进行抑菌圈测定。
1.2.2.2 响应面试验设计
在单因素试验结果的基础上,将碳源、氮源、缓冲溶剂3个关键因子设为考察变量。使用Design-Expert 8.0.6 Trial软件中Box-Benhnken模块进行响应面试验设计,优化由单因素试验选取的培养基成分的最佳添加量[14]。该3个关键因子按响应面设计不同添加量配制发酵培养基,共17组,每组做3个平行试验;在37 ℃、180 r/min摇瓶培养48 h后,收集发酵上清液进行抑菌活性检测。
1.2.3 培养基优化结果的测定
发酵液抑菌活性的测定:各组离心后取上清液,以副溶血性弧菌为指示菌进行抑菌试验,比较抑菌圈直径。
发酵产物的测定:取发酵上清液各100 mL,与乙酸乙酯按体积比1∶1.5混合,20 ℃搅拌萃取12 h,分离发酵液与萃取液。取萃取液100 mL在40 ℃下真空旋干,测定各组发酵产物并进行比较。
1.2.4 发酵液对食品中常见致病菌抑菌活性的测定
利用几种在食品工业和养殖行业中常见的致病菌作为指示菌,包括铜绿假单胞菌(Pseudomonasaeruginosa)、金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)、副溶血性弧菌(Vibrioparahaemolyticus)、单增李斯特菌(Listeriamonocytogenes)。将培养后的指示菌液体分别涂布于LB固体平皿上,再取发酵上清液200 μL加入牛津杯中,将培养皿平稳放置在37 ℃恒温箱内培养12 h,测定抑菌圈直径,确定发酵液对不同菌种的抑菌作用。
1.2.5 温度和pH对抑菌物质活性的影响
发酵液在4 ℃、12 000 r/min下离心10 min,取上清液进行试验。共设置8组试验,每组做3个平行。研究温度对抑菌活物质活性的影响,将每个试验组分别置于37(对照组)、40、50、60、70、80、90、100 ℃的环境中处理30 min,水平将上清液冷却至常温,测定其抑菌活性。研究pH对抑菌活物质活性的影响,将上清液pH分别调至1、2、3、4(对照组)、5、6、7、8,在37 ℃下处理1 h后,测定其抑菌活性。
2 结果与讨论
2.1 单因素试验结果
由表1可以看出,在碳源选择试验中,各碳源的抑菌圈直径从大到小依次是乳糖、葡萄糖、麦芽糖、蔗糖、可溶性淀粉,其中乳糖作为碳源时得到的抑菌圈直径最大,因此选择乳糖作为碳源。在氮源选择试验中,各氮源的抑菌圈直径从大到小依次是酵母浸粉、蛋白胨、牛肉膏、胰蛋白胨,其中酵母浸粉作为氮源时抑菌圈直径最大,因此选用酵母浸粉作为氮源。在缓冲溶剂的选择试验中,各缓冲溶剂的抑菌圈直径从大到小依次是柠檬酸铵、柠檬酸氢二铵、碳酸铵、硫酸铵,其中柠檬酸铵作为缓冲溶剂时抑菌圈直径达到19.1 mm;因此选择柠檬酸铵作为缓冲溶剂。

表1 单因素试验结果Tab.1 The results of single factor experiment
2.2 响应面设计方案和结果
以乳糖20 g/L、酵母浸粉20 g/L、柠檬酸铵3 g/L 为中心点,设计响应面试验,Box-Benhnken设计因素水平见表2。
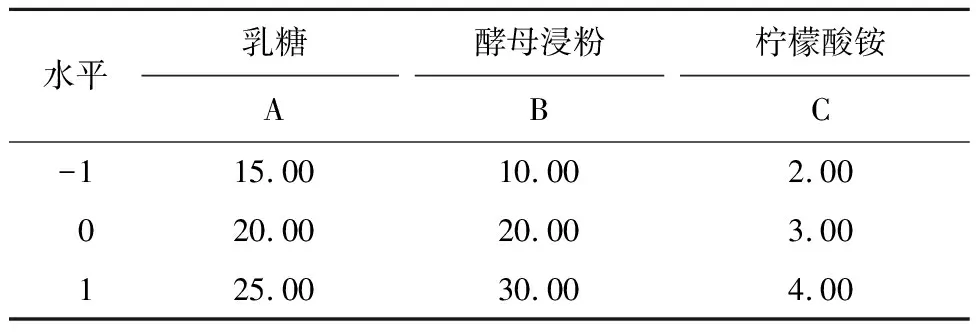
表2 Box-Benhnken设计试验因素水平Tab.2 Box-Benhnken experimental design g/L
各个因素在回归拟合后,计算得到植物乳杆菌发酵上清液的抑菌圈直径。乳糖(A)、酵母浸粉(B)、柠檬酸铵(C)质量浓度的二次多项回归方程:
Y=22.07-0.34A+0.34B-0.17C-0.28AB+0.12AC-0.21BC-1.85A2-1.71B2-1.36C2
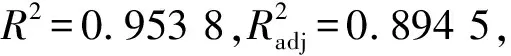
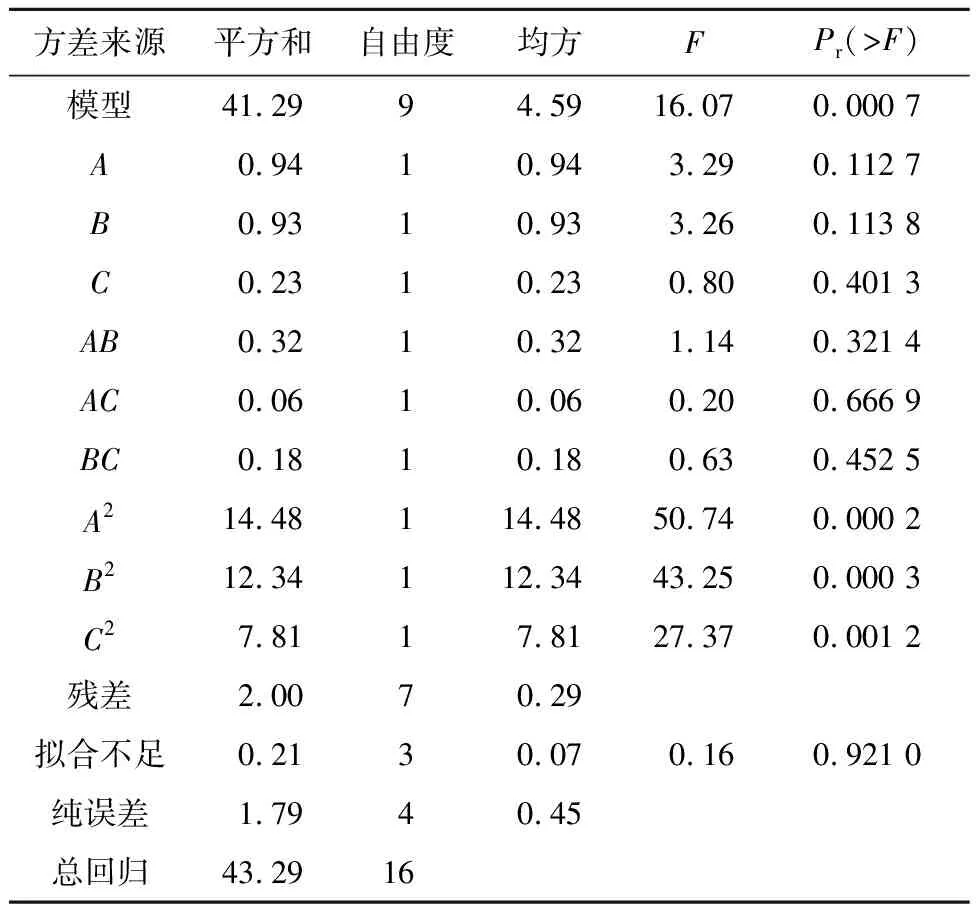
表3 响应面方差分析表Tab.3 Response surface analysis of variance
2.3 响应面分析及最佳培养基成分的确定
由图1可看出乳糖、酵母浸粉、柠檬酸铵三因素的交互作用明显,对抑菌圈直径影响极为显著。根据Box-Benhnken实验结果,参数的最佳水平分别为乳糖19.48 g/L、酵母浸粉21.12 g/L、柠檬酸铵2.92 g/L,在此条件下,经系统计算得到抑菌圈直径的最大理论值为22.0 935 mm。

(a) 乳糖与酵母浸粉

(b) 酵母浸粉与柠檬酸铵

(c) 乳糖与柠檬酸铵
2.4 培养基优化水平的判定
将优化后的培养基与MRS培养基进行发酵对比,结果如图2所示。MRS培养基的抑菌圈直径为17.84 mm,优化后培养基的抑菌圈直径为21.46 mm,比优化前提高了20.29%。
利用乙酸乙酯分别萃取对照组(MRS培养基)和实验组(优化培养基)的抑菌活性物质,各取100 mL萃取液在40 ℃真空旋干后测定产物质量。结果显示,对照组中提取得到的产物质量为

(a) MRS培养基
0.184 g,实验组为0.292 g,比对照组提高了58.42%。
2.5 发酵产物对常见致病菌抑菌活性的测定
由表4可见,植物乳杆菌HS-R9所产活性物质的抑菌范围较广,对食品中常见的革兰氏阳性菌和革兰氏阴性菌均具有较高的活性,其中对副溶血性弧菌和单增李斯特菌的抑制作用最明显。副溶血性弧菌是目前首要的食源性致病菌,而单增李斯特菌也是食物中常见的一种污染菌,能造成人严重的食物中毒。对常见致病菌抑菌活性的测定说明植物乳杆菌HS-R9所产的活性物质在食品工业中的具有潜在的应用价值。

表4 发酵产物对常见病菌抑菌活性的测定Tab.4 Determination of antibacterial activity offermentation products
2.6 温度和pH对抑菌物质活性的影响
如表5所示,植物乳杆菌HS-R9产的活性物质在40~70 ℃可以保持较高的抑菌活性,而在高于70 ℃时抑菌活性略有下降。经过高温处理后,发酵液内并未产生沉淀物质。因此可推断,植物乳杆菌HS-R9所产的活性物质具有较强的热稳定性。同时,该活性物质在pH为4时具有较高的抑菌活性,但当pH大于或者小于4时,抑菌活性有一定幅度下降,特别是当pH大于7,抑菌活性完全消失。

表5 温度和pH对抑菌活性物质的影响Tab.5 Effect of temperature and pH on the antibacterialactive substances
3 结 论
以发酵液抑菌圈直径为响应值,利用响应面法对培养基主要成分进行优化。结果表明,培养植物乳杆菌HS-R9的最佳培养基碳源、氮源和缓冲溶剂分别为乳糖19.48 g/L、酵母浸粉21.12 g/L和柠檬酸铵2.92 g/L,方差分析结果表明拟合程度较好。对比试验结果显示,优化后培养基发酵液抑菌活性提高了20.29%,其单位体积发酵液中产物质量增加了58.42%。测定发酵产物对食品中致病菌抑菌活性,表明植物乳杆菌HS-R9所产的活性物质对常见致病菌有较强的抑制作用。温度和pH对抑菌活性的影响结果表明,植物乳杆菌HS-R9所产活性物质具有耐酸耐高温能力,但对碱性环境的抵抗能力较弱。
