非磷系吸附剂对废水中铜离子的高选择性去除作用
2022-03-14林婉晴,赵志钢,杨帆,刘兆丽
林 婉 晴, 赵 志 钢, 杨 帆, 刘 兆 丽
( 1.大连工业大学 轻工与化学工程学院, 辽宁 大连 116034;2. 中国科学院海西研究院 厦门稀土材料研究所, 福建 厦门 361021 )
0 引 言
目前使用最广泛的Cu2+分离吸附材料有活性炭、改性纤维素和大孔树脂等[1-3],这些吸附材料在分离Cu2+时表现出很多缺点,如稳定性不足、吸附剂合成过于烦琐、选择吸附性过差以及环境影响恶劣等一系列问题[3-4]。相对于活性炭和纤维素这些同样需要改性的吸附剂,合成有机吸附剂的可操作性更大,有机官能团结构组合的可能性更多。研究学者可以通过对目标结构的设计,得到较高选择性和吸附效果,因此,合成有机吸附剂是人们一直探索的方向。基于以上原因,合成一种仅由C、H、O和N原子组成绿色吸附剂,在其完全可燃的基础上建立一种新的无残留废物吸附工艺已经引起人们的广泛关注[5]。本研究设计并合成了一种具有双羧基和双仲氨基存在的新型C、H、N、O型吸附剂2,2′-(1,4-亚苯双(氮杂二基))二乙酸,探究了该吸附剂对Cu2+的选择吸附效果,并对吸附剂的结构进行了表征。
1 实 验
1.1 材 料
对苯二胺、氯乙酸乙酯、乙酸钠、氢氧化钠、无水乙醇,分析纯。
1.2 实验方法
1.2.1 2,2′-(1,4-亚苯双(氮杂二基))二乙酸二乙酯的制备
称取5 g对苯二胺至50 mL无水乙醇中,氩气气氛搅拌,溶解后加入10.6 mL氯乙酸乙酯和13 g乙酸钠,80 ℃反应12 h,加入20 mL超纯水搅拌至澄清。冷却至室温后放入冰箱,析出结晶即2,2′-(1,4-亚苯双(氮杂二基))二乙酸二乙酯。
1.2.2 2,2′-(1,4-亚苯双(氮杂二基))二乙酸(PADA)的制备
将合成的2,2′-(1,4-亚苯双(氮杂二基))二乙酸二乙酯进行抽滤,用超纯水反复洗涤干净。取6 g产物溶解在9 mL无水乙醇中,加入66.6 mL 超纯水和2.5 g氢氧化钠,在100 ℃反应至溶液澄清,反应结束后在溶液中滴加浓盐酸至pH为1,过滤洗涤收集沉淀即为目标产物。
1.2.3 红外光谱分析
采用傅立叶变换红外光谱仪对吸附剂表面官能团进行分析,扫描范围4 000~600 cm-1,64次扫描,2 cm/min。进行红外测试前,样品在真空烘箱中80 ℃干燥8 h以上。
1.2.4 热重分析
采用热重及同步热分析仪对吸附剂进行测试,氩气气氛下以5 ℃/min从室温升到800 ℃。
1.2.5 扫描电镜分析
采用扫描电子显微镜对样品的表面形貌进行观察。取少量干燥后的产物分散在超纯水中滴在硅片上,干燥后贴在导电胶上,喷金后进行检测。
1.2.6 金属离子浓度测定
采用电感耦合等离子发射光谱仪对金属离子浓度进行测试,样品制备和稀释采用硝酸和超纯水。标准溶液(1 000 mg/L)购自中国北京有色金属科学研究院。在每组实验之前使用5种标准溶液(0~20 mg/L)进行校准。所选元素的校正曲线R2>0.999。所有样品在进行ICP分析前均用0.22 μm尼龙过滤器过滤。
1.2.7 吸附实验
为了探究pH对于Cu2+吸附的影响,采用硝酸溶液调节初始pH(pH 1~4),原溶液与吸附后溶液中金属离子的浓度采用ICP-OES法测定。
吸附率=[(ρ0-ρe)/ρ0]×100%
(1)
式中:ρ0、ρe分别为原溶液和吸附平衡后溶液中金属离子的质量浓度,mg/L。
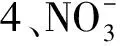
选择性实验以20 mg/L pH为4的Ca2+、Al3+、Mn2+、Zn2+、Cu2+等金属离子混合溶液为吸附溶液进行吸附。
2 结果与讨论
2.1 热重分析
如图1所示,PADA从235 ℃时开始失重,380 ℃ 时完全分解。该吸附剂的合成和使用温度远低于其开始分解时的温度,说明吸附剂的可燃性不会影响使用时的稳定性,温度升到380 ℃时大部分PADA分解成CO2和H2O等。

图1 PADA的热重图谱Fig.1 TGA spectrum of PADA
2.2 红外分析

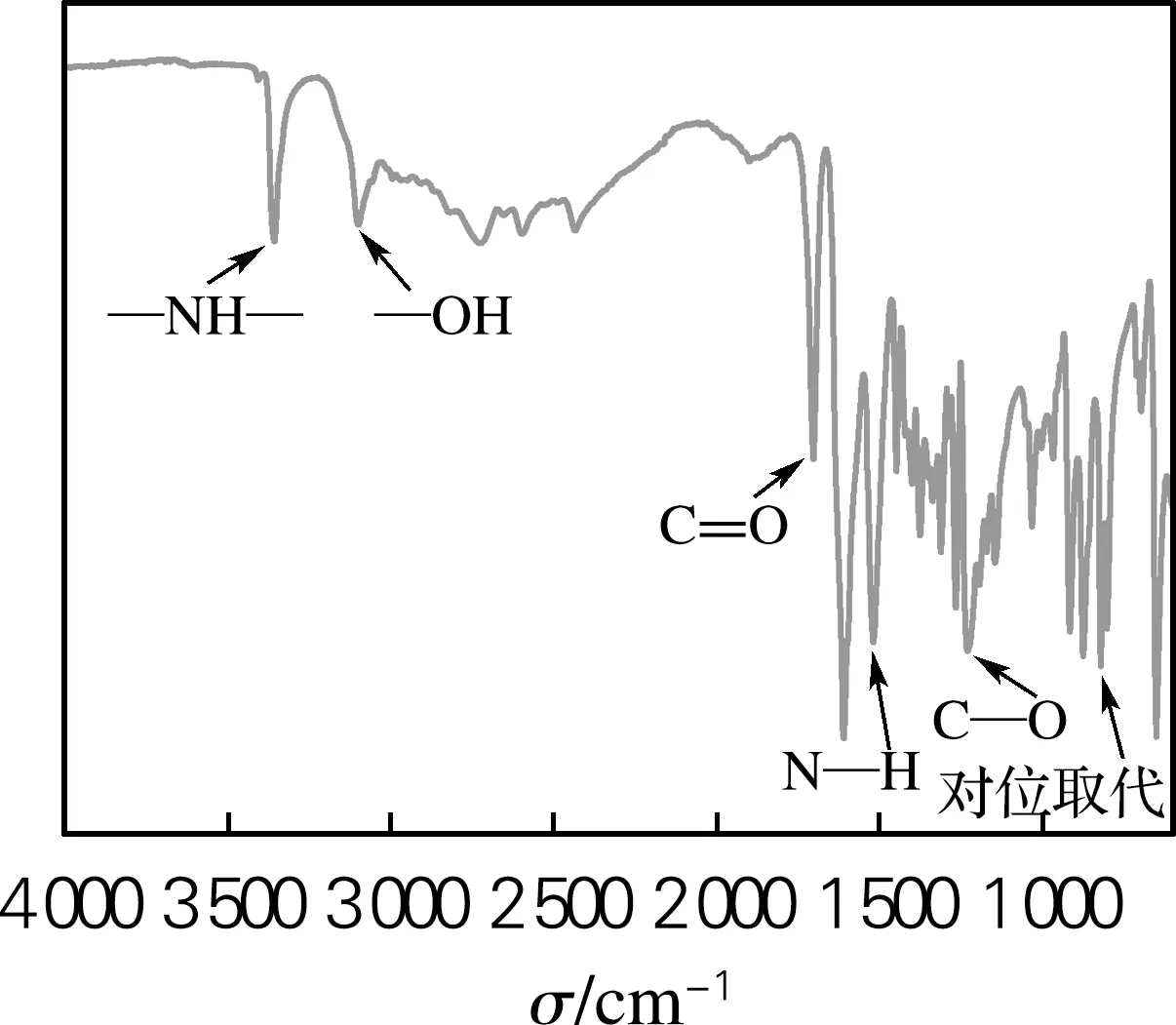
图2 PADA的红外光谱Fig.2 FT-IR spectrum of PADA
2.3 扫描电镜分析
从图3(a)中可以看出,PADA的尺寸约为20 μm,表面粗糙,整体呈块状。在进行EDS元素分析后发现整体以碳和氧元素为主,存在少量氮元素。因为在PADA整个结构中氮元素所占比例较小,符合结构比例。

(a) 电镜图(b) C(c) N(d) O图3 PADA的电镜和EDS元素图Fig.3 SEM observation and EDS mapping of PADA
2.4 PADA对Cu2+的吸附能力
2.4.1 pH的影响
如图4所示,在平衡pH为1.00~2.25时,pH对吸附几乎没有影响,吸附效率基本没有变化;吸附平衡pH为2.50~3.82时,吸附率逐渐上升,并达到最大吸附效率。由于H+和重金属Cu2+都属于阳离子,且H+的半径较小,在低pH时,更容易被吸附剂吸附。大量H+吸附在吸附剂表面会增加吸附剂表面的正电荷数量,带两个正电荷的Cu2+会被静电排斥,导致对Cu2+的吸附率降低[6]。得到吸附最佳平衡pH为3.82,在该pH下Cu2+去除率为97.59%。

图4 pH对PADA吸附Cu2+的影响Fig.4 Effect of pH on adsorption of PADA for Cu2+
2.4.2 吸附时间的影响
Cu2+初始质量浓度为20 mg/L,吸附前pH为4,溶液体积10 mL,PADA吸附剂质量为20 mg,在常温下振荡考察Cu2+去除率随吸附时间的变化。由表1可见,PADA对Cu2+的吸附在120 min内达到平衡,超过90%的Cu2+在此期间被吸附。PADA表面的仲氨基和羧酸官能团与Cu2+都发生了强烈的螯合作用[7-8],在有效官能团的作用下,吸附在2 h内达到了平衡。

表1 吸附时间对PADA吸附Cu2+的影响Tab.1 Effect of time on PADA adsorption for Cu2+
2.4.3 吸附动力学
为了进一步探究吸附机理,对PADA吸附Cu2+的行为进行了吸附动力学研究,采用拟一阶动力学模型、拟二阶动力学模型和颗粒内扩散动力学模型分析吸附机理。
ln(qe-qt)=lnqe-k1t
(2)
(3)
qt=kpt0.5+L
(4)
式中:qe为吸附平衡时的吸附容量,mg/g;qt为进行到吸附时间t时的吸附能力,mg/g;k1为拟一阶动力学模型常数,min-1;k2为拟二阶动力学模型常数,g/(g·min);kp为颗粒内扩散模型常数,mg/(g·min0.5);L为边界层扩散效应。
3种模型的线性拟合如图5所示。通过比较确定系数(R2)可以看出拟二阶模型拟合效果优于其他两种模型。这表明此吸附过程属于化学吸附,吸附速率受配位反应控制[9]。
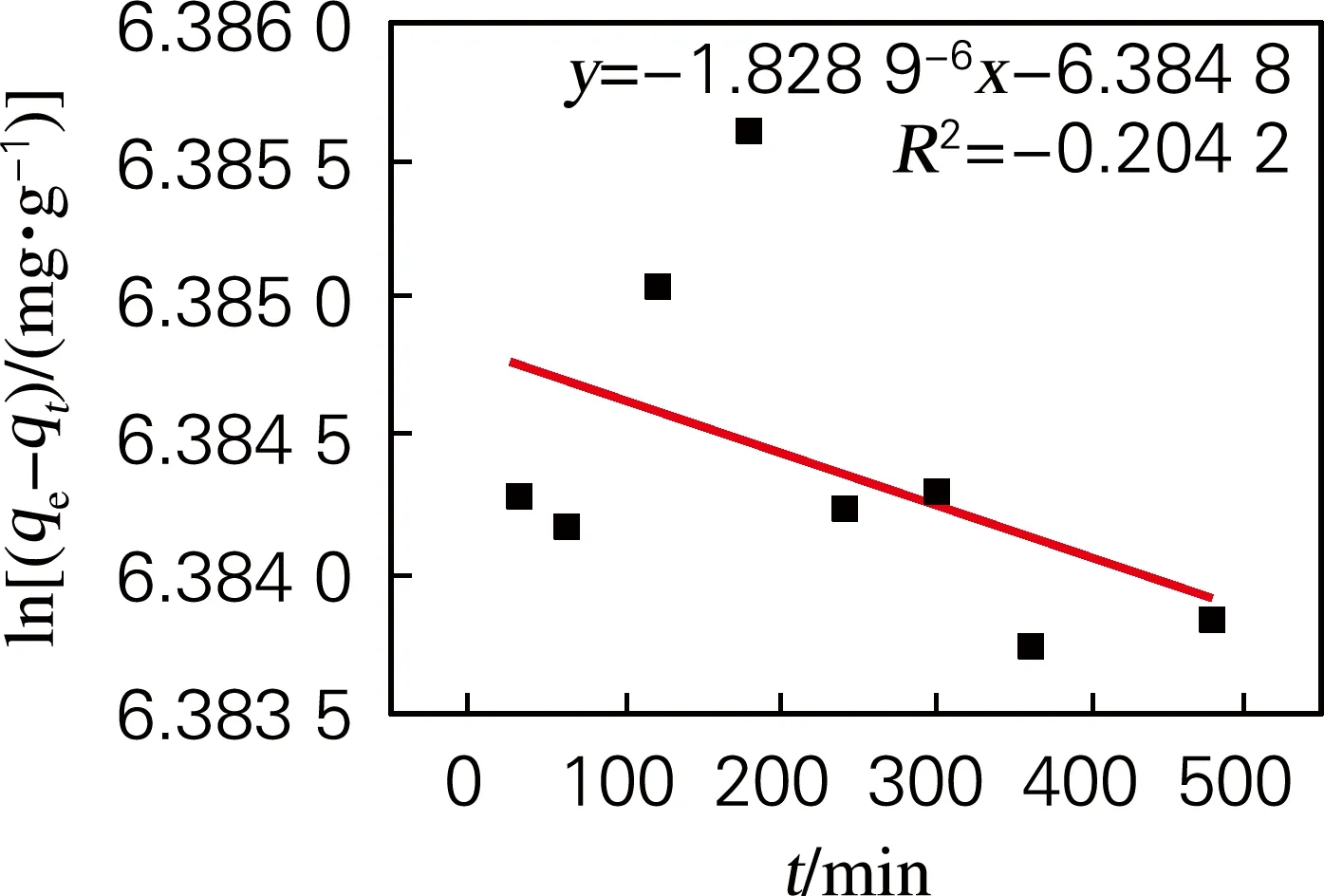
(a) 拟一阶动力学

(b) 拟二阶动力学
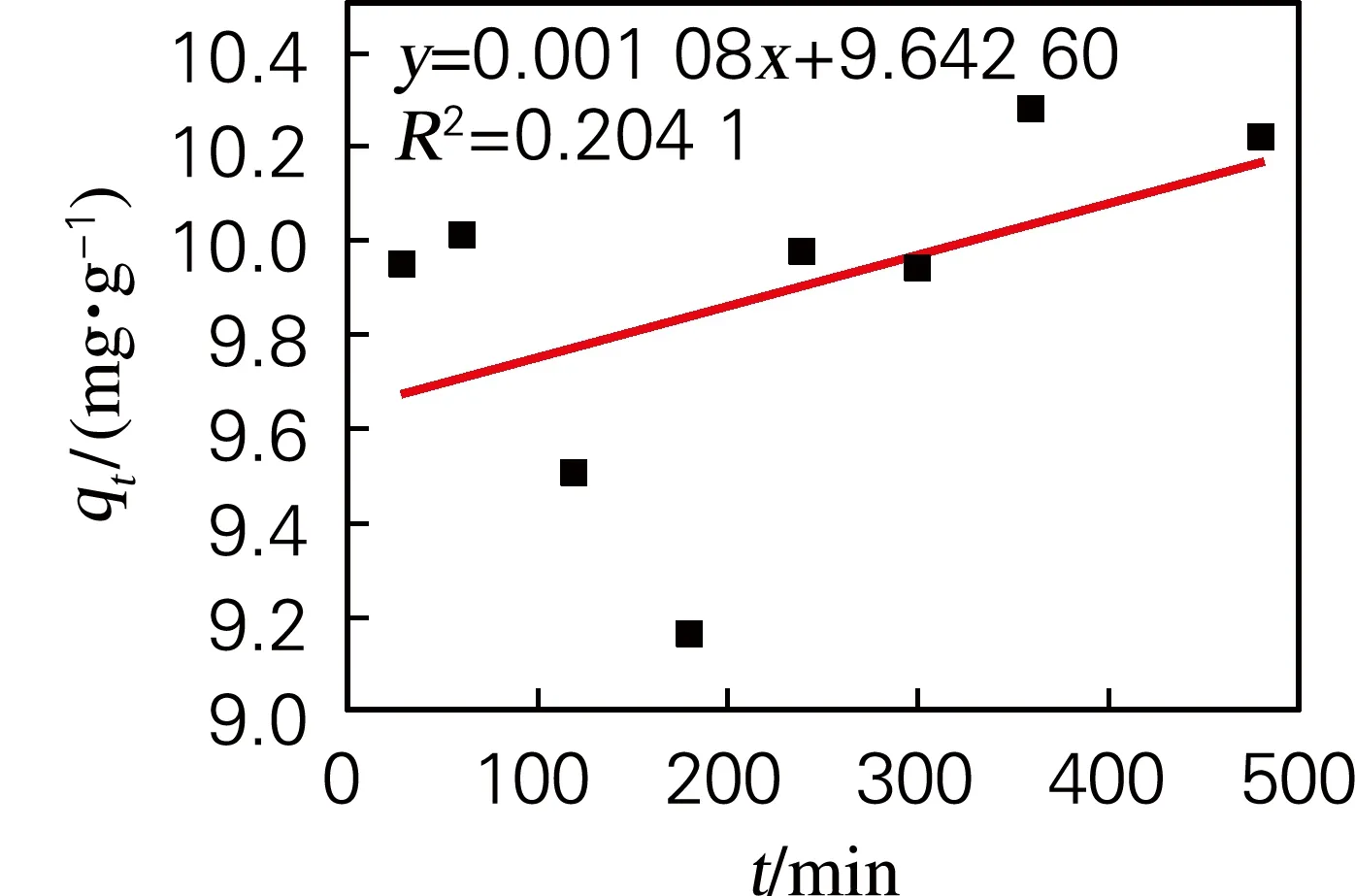
(c) 颗粒内扩散模型
2.4.4 选择性
在多种重金属离子存在条件下考察PADA对Cu2+的吸附效率,Cu2+、Ca2+、Al3+、Mn2+、Zn2+的吸附率分别为97.18%、0、1.16%、0.30%和0.06%,证明PADA对Cu2+具有独特的吸附选择效果。Cu2+的高效选择性去除可能归因于Cu2+和PADA螯合作用比其他干扰离子结合具有更高的稳定性,设计的结构中仲氨基和羧酸官能团的协同作用有助于Cu2+的去除[10]。
3 结 论
以对苯二胺为原料,合成了由C、H、O和N原子组成的PADA新型绿色吸附剂。该吸附剂材料具有选择吸附效果优异、易降解、酸性条件稳定、对环境友好等优点,实现了对重金属Cu2+的选择性吸附。该吸附剂在燃烧时,主要产生气态产物,不会残留磷等难以去除的元素,并且在酸性条件下性能维持稳定、结构保持完整、合成简单、原料价格低廉、安全性能好。PADA在多离子共存废水中Cu2+的去除方面具有一定的应用前景。
