剖析反应规律 构建有机反应模板
2022-03-12周维清
周维清
(云南省腾冲市第八中学 679100)
1 加成反应
有机物分子中双键(或三键)两端的原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应.反应时双键或叁键断裂一条键形成2个“半键”,半键与其他原子或原子团直接相接形成新的化合物即“断一加二、合而为一”.中学阶段出现的能发生加成反应的官能团为:
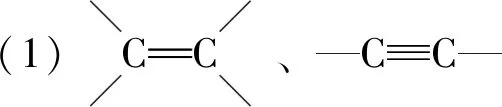
反应模板为:
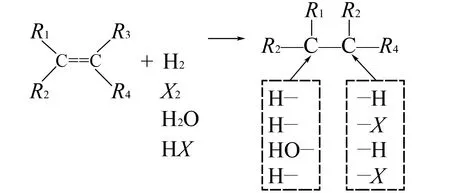
例如
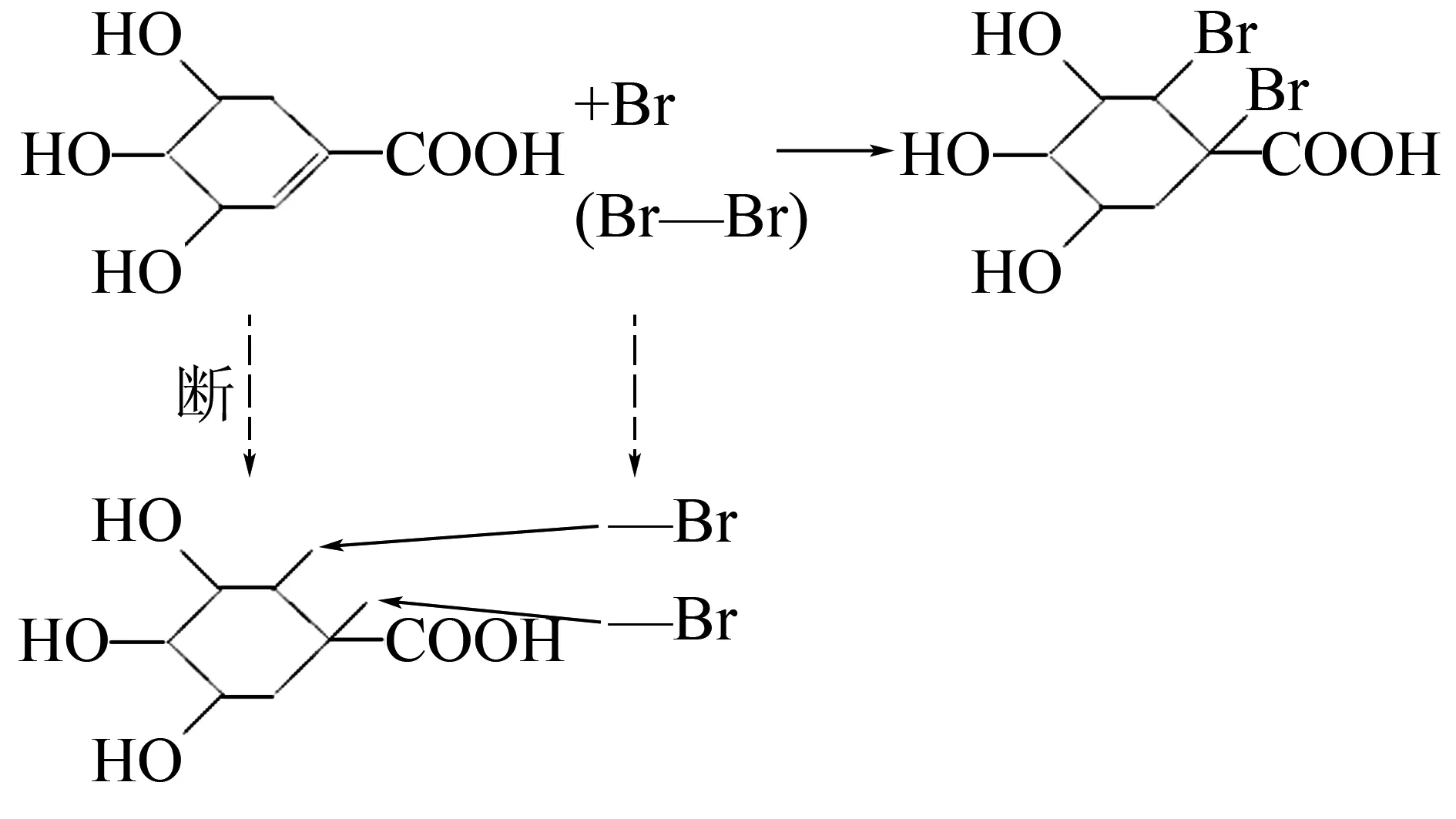
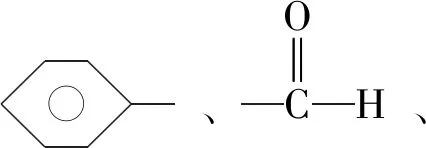
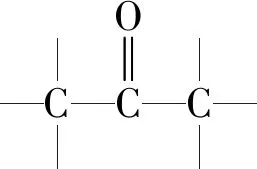
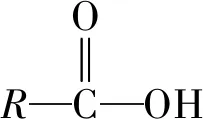
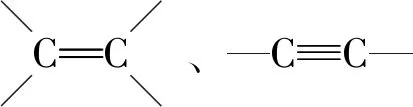
③除碳碳双键、碳碳三键与卤素单质(如溴水、Br2/CCl4等)直接反应外,与其他物质如H2O、H2、HX等反应一般条件为催化剂.
2 消去反应
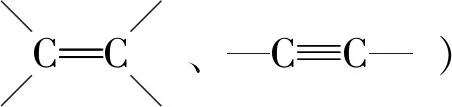
2.1 内部条件
2.2 外部条件
卤原子应在强碱(如NaOH)的醇溶液且加热的条件下发生消去,而醇羟基在热的浓H2SO4中发生消去.
反应模板为:
由此看出消去反应的规律:—X(或—OH)与连接—X(或—OH)的碳的邻位碳上的H结合成HX(或H2O)脱去而形成不饱和化合物即“邻碳去H”.
3 聚合反应
由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应叫聚合反应.参加聚合的小分子叫做单体,聚合后的大分子叫聚合物.根据聚合方式分为加聚反应和缩聚反应.
3.1 加聚反应
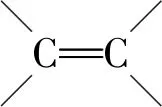
(3)不同单烯烃加聚:把两物质中双键写在一排,其余原子或原子团在上下两边,然后“两头伸出手,中间连接起来,加括号和n”,步骤如下:
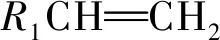
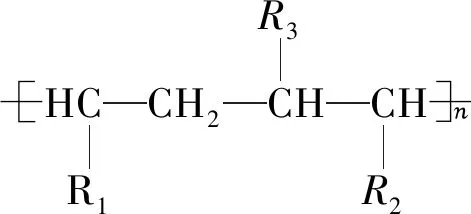
3.2 缩聚反应
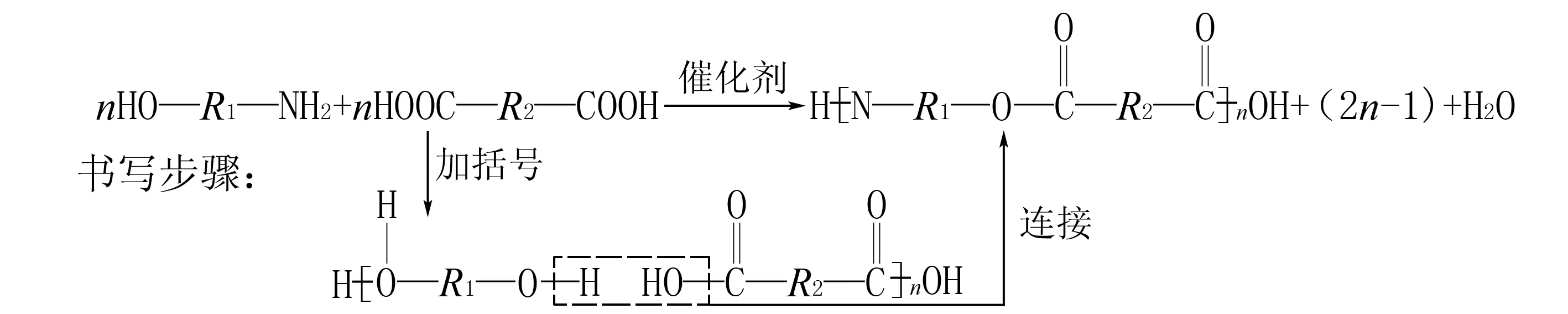
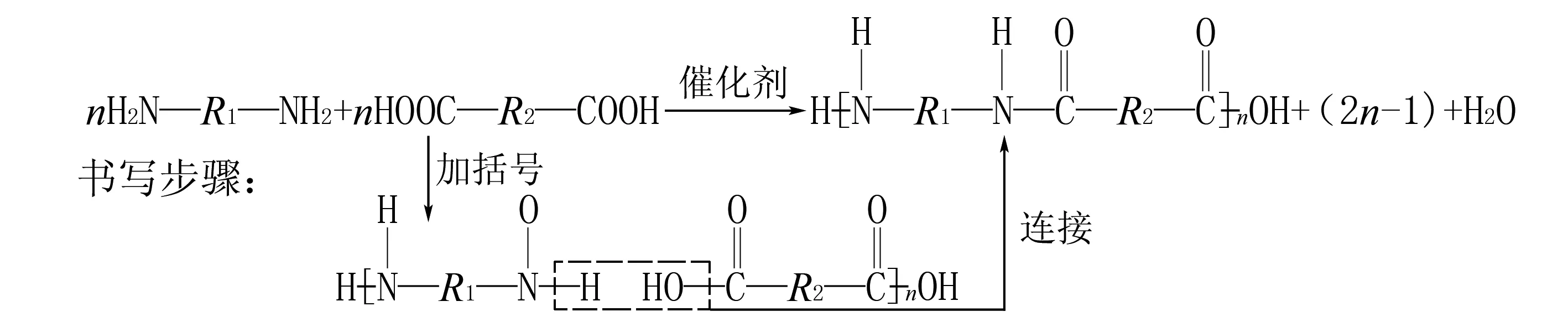
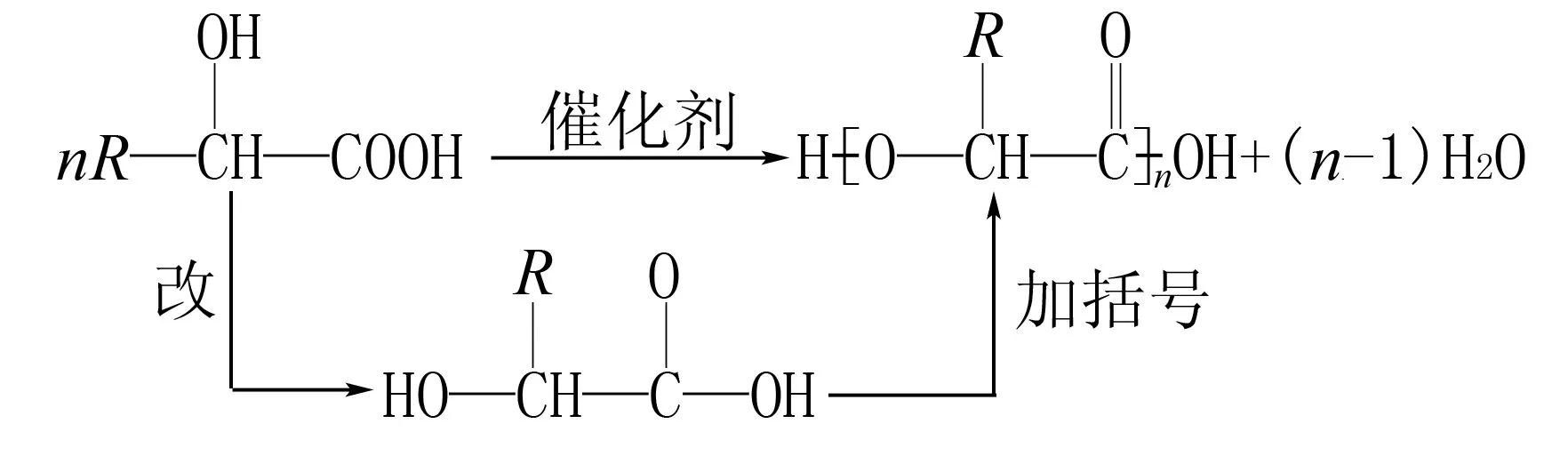
单体间相互反应生成高聚物,同时还生成小分子(如H2O)的反应.中学常见的缩聚反应主要是通过酯化或成肽聚合在一起的,因缩聚时两端的原子或原子团不能完全失去,故按以下模式书写缩聚产物:
(1)把分子中的-COOH和—OH(或—NH2)通过旋转写在一排上;
(2)打“[ ]”,“—COOH”中的“—OH”、“—OH”或“—NH2”中的一个“H”在括号外;
(3)若为两种物质反应,中间通过酯化或成肽的规律连接在一起.
反应模板为:
①二元醇(氨)与二元酸生成聚酯,如:
②羟基酸自身缩聚成聚酯,如:
③氨基酸缩聚
+nH2O
4 酯化反应
酸和醇起作用生成酯和水的反应称为酯化反应.反应条件:浓H2SO4,加热;反应特征:可逆反应;反应规律:一般是酸失羟基醇失氢.
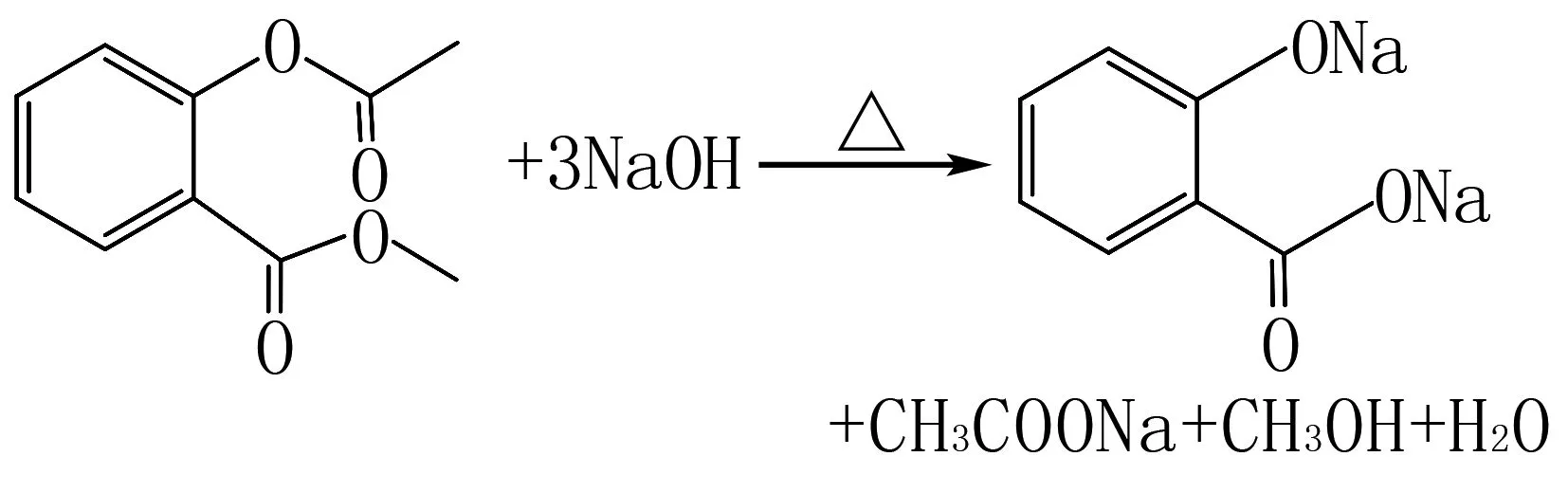
5 酯的水解反应
酯在酸性或碱性条件下均能发生水解反应,反应时酯基中碳氧单键断裂,然后碳氧双键接羟基,氧原子接氢;在碱性条件下形成的羧基与NaOH进一步反应生成羧酸盐和水,若酯基中氧原子直接与苯环相连,则水解生成的酚羟基又与NaOH反应.通式为:
如
6 醇的催化氧化

由此可以看出:
①与—OH相连的碳上有2个或3个H(即—OH在链端的碳原子上)氧化得醛;
②与—OH相连的碳上有1个H(即—OH在中间碳上)氧化得酮;
③与—OH相连的碳上无H不能发生催化氧化.
7 醛的氧化反应
7.1 银镜反应模板
H2O+2Ag↓+3NH3+RCOONH4
7.2 与新制的Cu(OH)2反应模板
Cu2O↓+RCOONa+3H2O
7.3 醛的催化氧化
—CHO与O2在催化剂的作用下加热时碳氢键断裂,然后在C、H之间接上O即形成—COOH,反应模板为:
8 卤代烃的水解反应
卤代烃在强碱(如NaOH、KOH等)的水溶液中,卤原子能被羟基所取代.所有的卤代烃都能发生水解反应,只是反应的难易程度不同.
反应通式:
9 酚与浓溴水的取代反应
由于受羟基的影响,苯环上羟基的邻对位上的氢变得非常活跃,反应时溴原子取代羟基的邻、对位上的H.如:
10 中和反应
含有—COOH、酚羟基的有机物与NaOH能发生中和反应.
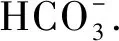
练习:写出下列有机反应的化学方程式.
(1)(2016全国卷1)HOOC(CH2)4COOH与HOCH2CH2CH2CH2OH生成高分子化合物
(4)(2016四川卷) CH3CH(COOH)2与足量的甲醇反应
