子宫内膜异位症相关巨噬细胞的提取和鉴别
2022-03-12陈赛玲王芳陈慧倩胡雪莉吴妹玲段萍
陈赛玲,王芳,陈慧倩,胡雪莉,吴妹玲,段萍
温州医科大学附属第二医院育英儿童医院 妇产科,浙江 温州 325027
子宫内膜异位症(endometriosis,EMs)是具有盆腹腔局部免疫功能异常的妇科常见病。其中,巨噬细胞是含量最多的免疫细胞。此外,EMs相关巨噬细胞(endometriosis-associated macrophages,EAMs)的M2表型被发现在EMs患者异位病灶中占主导地位,可分泌相关炎症因子,而炎症因子之间动态相互作用的失调可导致逆流子宫内膜碎片逃脱免疫清除并在异位种植生长,其中免疫起着关键性作用。那么如何从EMs病灶中分离、提纯巨噬细胞是深入进行EMs免疫相关体外研究的关键,目前国内外鲜见关于EAMs提取方法的报道。本研究拟利用酶消化法和密度梯度离心法分离EAMs,并进行贴壁培养和鉴定,探讨此法提取EAMs的可行性。
1 材料和方法
1.1 材料
1.1.1 标本:本研究免疫组织化学组织切片均取自温州医科大学附属第二医院育英儿童医院病理科,选取7个EMs患者的异位病灶(卵巢、膀胱壁、腹壁、腹直肌、盆腔等);7个正常内膜组织(宫颈上皮内瘤变II-III级)作为对照。原代细胞提取3例EMs病灶标本均取自于温州医科大学附属第二医院育英儿童医院妇科,经腹腔镜以及病理确诊为EMs的异位病灶组织。用于免疫组织化学的病理切片人体组织标本已通过医院伦理委员会审批且取得患者的知情同意。
1.1.2 试剂:免疫组织化学抗体CD68、CD163购自美国Abcam公司;免疫组织化学检测试剂兔二步法试剂盒、DAB显色液购自北京中衫金桥公司,山羊血清、枸橼酸钠缓冲液均购自北京索莱宝公司;流式细胞检测抗体Fc Receptor Blocking Solution LIVE/DEAD-APC/Cy7、CD11b-APC、CD163-PE、CD80-PE/Cy7抗体均购自美国Biolegend公司;用于原代细胞培养的胶原酶(Type IV)购自德国Worthington公司,透明质酸酶、DNA酶、组织淋巴细胞分离液试剂盒(主要包括各种组织淋巴细胞分离液、全血及组织稀释液、细胞洗涤液)购自北京索莱宝公司;RPMI1640培养基和胎牛血清均购自美国Gibco公司。
1.2 方法
1.2.1 免疫组织化学染色:将获得的标本制成厚度2 μm的切片,用酶标抗体法进行检测。首先在室温下进行二甲苯脱蜡、梯度乙醇依次脱水、枸橼酸钠修复、3%过氧化氢灭活内源酶,然后分别滴加CD68、CD163一抗(1:200)进行孵育,放入湿盒内 4 ℃孵育过夜。第2天,37 ℃复温30 min,用PBS洗掉一抗,滴加酶标羊抗兔IgG聚合物,37 ℃孵育40 min,PBS冲洗3次,滴加适量新鲜配制的二氨基联苯胺(DAB)染色1 min,苏木素复染5 s,盐酸乙醇分化,最后冲洗返蓝,脱水透明,封片。
1.2.2 原代EAMs的分离提取:EMs患者手术切除病灶,新鲜组织离体之后尽快(<2 h)分离培养。每例EMs异位病灶取长径为4~6 cm,采用筛网过滤分离EAMs。首先用含1%青链霉素的无菌PBS清洗异位病灶3遍,去除血污,剪碎至直径<1 mm3的乳糜状组织。在RPMI 1640培养基中加入0.1% IV型胶原酶、0.02%透明质酸酶、0.004% DNA酶混匀,最终配制成混合消化酶溶液。将组织与混合消化酶按1:3的体积比例放置37 ℃水浴锅消化40~60 min,每10 min混匀颠倒,直至组织呈胶冻状。再将细胞经过100目筛网过滤一次,滤去残余组织,得到单细胞悬液,然后加入含10%胎牛血清的RPMI 1640完全培养液终止消化。取一支适当的离心管,加入与单细胞悬液等量的分离液。吸取过滤过的单细胞悬液平铺于分离液液面上,过程始终保持两液面界面清晰。室温,以500~900×g离心20~30 min。离心后,可见离心管中由上至下细胞分四层。分别为:稀释液层、乳白色淋巴细胞层、透明分离液层、红细胞层,用吸管小心吸取第二层环状乳白色淋巴细胞至另一洁净的离心管中,向离心管中加入细胞洗涤液洗涤白膜层细胞,250×g,离心10 min。最终用RPMI 1640完全培养基重悬细胞,分离所得细胞置于37 ℃、5% CO2培养箱中培养。2~4 h后换液,此后每隔2 d换液,每日用倒置显微镜直接观察细胞形态和细胞生长情况。待细胞生长铺满80%细胞皿后,即可传代。
1.2.3 流式细胞仪鉴定EAMs:收集贴壁培养的原代巨噬细胞,吸去培养液,用0.25%胰酶消化后,细胞存于离心管中,每管细胞数量不少于1×106个/mL, 1 000 r/min离心3 min,弃去上清液,然后加入 100 μL的PBS制成单细胞悬液,加入FcX抗体封闭,冰上避光孵育30 min,预冷PBS洗涤后加入2.5 μL的CD163、CD11b抗体标记巨噬细胞特异标志蛋白,冰上避光孵育30 min,PBS洗涤2次后1 000 r/min离心3 min,去掉上清液,加入500 μL PBS,重悬,用BECKMAN COULTER流式细胞仪检测巨噬细胞表面抗原表达。具体分为以下几组:空白组,CD11b单染色组,CD163单染色组,CD80单染组以及CD11b、CD163、CD80三染组。
1.3 统计学处理方法 采用SPSS19.0统计软件进行Two-tailed Student’st检验。P<0.05 为差异有统计学意义。
2 结果
2.1 M2细胞表面标志物在EMs上高表达 本研究选取7个EMs患者的异位病灶,7个正常内膜组织作为对照。以CD68为巨噬细胞表面共同分子标志物,CD163为M2细胞表面标志物[1],通过免疫组织化学检测可见在单个视野下的阳性细胞,检测分为正常内膜组(En)、EMs病灶组(Ec)。在异位病灶间质组织中可见阳性表达(棕黄色),见图1A-F。其中,CD68分布在细胞膜表面,CD163分布在胞浆和胞膜,见图1C、图1F。EMs病灶组CD68和CD163的表达均高于正常内膜组,差异有统计学意义(P<0.05),见图1G、图1H。
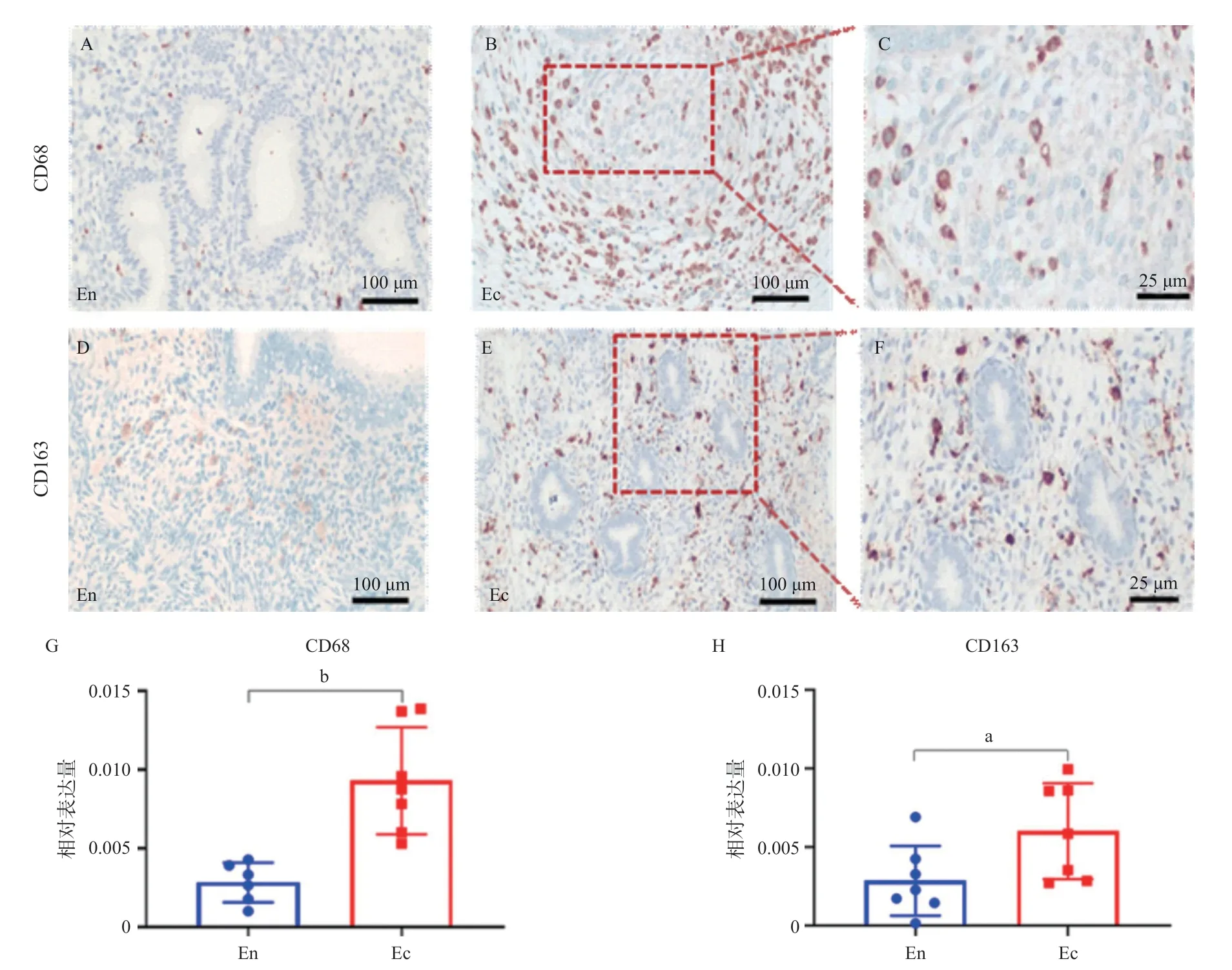
图1 IHC法检测正常子宫内膜(En)、EMs异位病灶(Ec)巨噬细胞表面抗体表达
2.2 EMs组织提取巨噬细胞 通过淋巴细胞分离液分离EAMs,密度梯度离心法后发现消化液明显分层,见图2。

图2 EAMs离心分层图
2.3 EAMs形态学观察 镜下观察到EAMs呈椭圆形,并有短小突起,还有伸出较长伪足而呈不规则形,表明功能活跃,见图3。

图3 倒置显微镜下原代EAMs的形态
2.4 流式细胞术检测EAMs的表达情况 收集贴壁生长的原代巨噬细胞,经流式细胞术检测CD11b、CD163以及CD80的表达,CD11b+、CD163+为M2标志特征,CD11b+、CD80+为M1标志特征。结果显示CD11b单阳性比例为73%,CD11b和CD163双阳性比例为6.46%,而CD11b、CD80双阳性比例为0,可得出EMs病灶中巨噬细胞以M2表型为主导。见图4。

图4 流式细胞术检测EAMs表面抗原CD11b、CD163和CD80的表达水平
3 讨论
近年研究表明,巨噬细胞是EMs腹腔液中数量最多的免疫细胞,在EMs的发生、发展过程中发挥关键作用,主要参与细胞凋亡、炎症消退、组织修复和伤口愈合等[2-4]。巨噬细胞被招募到EMs微环境中并浸润于异位病灶中,这些巨噬细胞分泌各种局部产物[5],如生长因子和细胞因子,导致其吞噬能力受损、凋亡增加,形成相对免疫耐受的微环境,有助于EMs细胞的存活[6]。可见,巨噬细胞功能的改变是EMs免疫耐受形成的基础性因素。人们已广泛研究EMs免疫微环境中巨噬细胞在不同内膜周期特征以及变化,但目前国内外鲜见EAMs概念及其提取方法的提出或报道。2017年WOO等[7]首次提出EAMs的概念,由人异位子宫内膜细胞(间质细胞和上皮细胞)条件介质培养基诱导培养原始巨噬细胞(M0)而得,但此法无法实现整个EMs免疫微环境(包括各种细胞和炎症因子)对M0的作用,因此亟需一种EMs异位病灶巨噬细胞分离提取的方法。
巨噬细胞在EMs中根据激活状态和表面标记的不同主要分为经典激活的M1和选择性激活的M2,这种表型的可塑性可由EMs微环境改变引起[8-9]。例如,EMs患者盆腔中存在促炎和抗炎因子混合表型以及平衡失调,由此导致局部免疫功能障碍,EMs病灶中巨噬细胞向M2极化,使得M1吞噬清除影响下降,表现出较差的吞噬能力,并且浸润EMs病灶,促进血管生成[10-11]。其中,M2被认为是抗炎细胞,参与组织修复、血管生成、神经发生和组织的上皮间质转化(epithelial to mesenchymal transition,EMT)[12],即子宫在位内膜受到巨噬细胞分泌的炎症因子影响发生EMT获得迁移侵袭能力,并进一步在M2极化相关炎症因子促进下种植到盆腹腔发生黏附、侵袭、血管新生及神经新生,形成异位病灶即子宫内膜样组织利用缺陷的盆腹腔微环境来实现自身的浸润生长[13]。有研究表明,腹腔和异位病变中M2的增加有助于病灶的形成和提供允许生长的抗炎环境[1,14]。CD68是巨噬细胞共同表面标志物,能同时识别M1和巨噬细胞,CD163是清道夫受体超家族重要成员,主要表达于单核细胞和巨噬细胞表面,被认为是一种高特异性的M2型巨噬细胞标志物[15]。本研究利用CD68和CD163作为M2巨噬细胞的标志 物[16],发现2型巨噬细胞在EMs病灶中高表达,符合上述文献报道。
目前已有多种组织和器官的巨噬细胞分离培养、鉴定方法,主要包括Percoll法、Ficoll-Hypaque 分离法、差速贴壁分离法等[17-19]。李莉等[17]利用机械法和酶消化法相结合制备小鼠子宫组织单细胞悬液,通过密度梯度离心初步分离巨噬细胞,WOO等[7]从异位子宫内膜细胞中获取条件培养液,将其加入佛波酯诱导THP-1细胞分化为M0后的原始巨噬细胞中,诱导分化得到EAMs。孟凡荣等[19]通过取小鼠胫骨和腓骨骨髓,提取小鼠骨髓细胞,通过巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)、脂多糖(lipopolysaccharides,LPS)、γ-干扰素(interferon-γ,INF-γ)和白细胞介素-4(interleukin-4,IL-4)刺激,体外诱导分化得到M1型和M2型巨噬细胞。但上述方法具有细胞纯度低、特异性差、无法增殖培养等缺点。综上,EAMs之所以难以分离培养,主要在于EMs病灶总体细胞所占比例相对较少,因此有效分离去除子宫上皮组织及其他细胞是分离EAMs的关键。本研究利用机械法结合消化酶法分离EAMs,然后使用组织巨噬细胞分离液,利用细胞之间的比重差异对不同细胞进行分层,再根据EAMs黏附能力强、2~4 h内贴壁的特性,将巨噬细胞与间质细胞、上皮细胞、成纤维细胞等贴壁细胞分开,进一步提高纯度。对于分离得到的细胞,我们通过流式细胞检测技术从形态学、特异性表面分子不同方面来进行鉴定。结果显示通过酶消化法和密度离心法分离得到的巨噬细胞以M2表型为主,并且可稳定传代,具有重要研究价值。本研究中的消化法与从其他器官组织中提取巨噬细胞方法对比有以下优点:①本胶原酶消化法结合机械法消化EMs病灶为首次提出,不同于传统的炎症因子诱导或者体外共培养,此法是真正存在于EMs病灶腹腔免疫微环境的,更贴合原始病灶巨噬细胞的特征。②病灶细胞复杂,含有上皮细胞、间质细胞和成纤维细胞等众多细胞,我们采用密度梯度离心除去比重差别大的细胞,最终成功从复杂的细胞成分中提取出巨噬细胞。
原代巨噬细胞目前广泛应用于众多实体肿瘤的分子、细胞生物学和生物医学基础研究,还应用于药物筛选、药物代谢和毒理研究、癌症药物的研究等。本研究利用CD80和CD163作为1型和2型巨噬细胞标志物[20],采用的消化法可有效提取原代EAMs和扩充培养。虽然提取的是人EMs病灶组织,但此方法仍然适用于EMs动物模型,因此对进一步研究巨噬细胞在人和动物的EMs免疫微环境中发挥的作用特性及其生物学行为的影响具有重要价值。
