基于网络药理学的健脾解毒方抗结直肠癌的作用机制研究
2022-03-12仇雅岚高静东刘敏张蕾宋卿
仇雅岚,高静东,刘敏,张蕾,宋卿
(南京中医药大学附属苏州医院,江苏 苏州 215000)
网络药理学是一种从系统水平分析药物多靶点治疗疾病机制的新兴研究方法,它能够对药物靶点进行有效定位,并建立“药物-靶点-疾病”生物网络,以高通量方式揭示小分子的调控原理[1-2]。由于肿瘤是具有复杂生物网络的系统疾病,运用网络药理学分析中药复方的抗肿瘤作用机制,有效地弥合了现代医学与传统中医药之间的鸿沟,使药物研究模式从“单一目标,一种药物”转变为“网络目标,多组分治疗”模式[3-4]。健脾解毒方是苏州市中医医院肿瘤科针对消化系统肿瘤的常用方剂,该方以健脾法为主,结合清热解毒等治法,组成包括黄芪、炒白术、山慈菇、白花蛇舌草,临床效果显著,但其抗肿瘤机制尚未明确。本研究借助网络药理学和分子对接的方法,筛选健脾解毒方有效成分,以期分析其抗肿瘤作用靶点以及相关信号通路,为进一步实验探究其作用机制奠定基础。
1 材料和方法
1.1 筛选健脾解毒方有效化学成分及作用靶点
利用中药成分数据库TCMSP(http://www.tcmspw.com/tcmsp.php)[5],TCMID(http://www.megabionet.org/tcmid/)[6],ETCM(http://www.tcmip.cn/ETCM/index.php/Home/Index/)[7]数据库,检索健脾解毒方组成药物(黄芪、白术、白花蛇舌草、山慈菇)的化学成分信息及药理学信息。口服生物利用度(Oral bioavailability, OB)是指药物经口服给药被吸收进入人体循环的速度与程度,类药性(Drug-likeness, DL)是指化合物与已知药物的相似性。OB、DL是筛选中药复方有效成分的关键参数,OB、DL值越高,则该化合物越具有成为药物的可能。
将以上3个中药成分数据库中获得的健脾解毒方组成药物的化学成分信息汇总后与DrugBank(https://go.drugbank.com/)[8]数据库里所有已知药物进行相似程度比较,筛选满足OB≥30%,且DL≥0.18的化学成分作为健脾解毒方的有效成分,并利用TCMSP数据库筛选健脾解毒方有效成分作用靶点。
1.2 收集肿瘤相关靶点并匹配药物-疾病靶点
利用GeneCards(http://www.genecards.org/)[9]数据库,以“Cancer”“Tumor”为关键词,检索与肿瘤相关的疾病靶点,以相关性分数为参考,删除重复靶点后取并集,得到肿瘤相关靶点。利用R 3.6.3软件[10]将药物与疾病的靶点进行匹配,得到健脾解毒方有效成分抗肿瘤的作用靶点。
1.3 构建蛋白互作(PPI)网络并筛选关键靶点
将匹配后得到的健脾解毒方有效成分靶点与肿瘤相关疾病靶点之间的重合靶点导入Cytoscape 3.7.2(http://www.cytoscape.org/)[11],构建健脾解毒方有效成分-肿瘤靶点网络,网络中节点以不同的形状或颜色分别代表有效成分和靶点,边表示有效成分与靶点的作用关系。节点度为某一节点所连边的条数,节点度越高,说明该节点在复方中所起的作用越关键。为了筛选出健脾解毒方抗肿瘤作用的关键靶点,对1.2中获得的健脾解毒方的药物-成分-疾病-靶点网络进行节点度分析,分别计算有效成分、靶点的节点度,以节点度为参数筛选,我们选择大于平均节点度位列前3位的靶点作为健脾解毒方的关键靶点。并利用Bisogenet插件[12]构建关键靶点的PPI网络图,并进行药物、成分、靶点、信号通路之间的网络拓扑分析。
1.4 基因功能注释和通路富集分析
利用R 3.6.3软件及相关软件包[13-16]对“1.2项”中获得的健脾解毒方有效成分抗肿瘤的作用靶点进行基因本体(GO)生物学过程富集分析和京都基因与基因组百科全书(KEGG)通路富集分析,将显著富集的前20个基因或通路绘制成GO分析图和KEGG气泡图。
1.5 有效成分与关键靶点基因分子对接
在RSCB PDB数据库[17]中下载关键靶点基因的分子结构,在TCMSP数据库中下载健脾解毒方有效成分的2D结构,利用AutoDock4.2软件[18]对基因分子结构进行移除水分子、加氢处理,对有效成分结构加氢处理,并进行半柔性结合分子对接验证,运用遗传算法(Genetic algorithm)进行分子对接计算,每次对接50次,最大运行300个,对接参数使用默认值。若结合能小于0,表明配体与受体之间存在结合活性,小于-5 kJ·mol-1则两者对接良好。最后使用Pymol 2.4及插件PyMod3[19]对对接分子结合能最低的位点进行图像可视化处理。
2 结果
2.1 健脾解毒方有效成分及作用靶点
在以上3个中药成分数据库中共获得黄芪87种、白术55种、白花蛇舌草化学成分37种、山慈菇18种,汇总去重后得到健脾解毒方化学成分共193种。以OB≥30%,且DL≥0.18为条件筛选收集到黄芪17种、白术4种、白花蛇舌草5种、山慈菇3种,去重后共25种有效成分,其中白花蛇舌草与山慈菇共有成分为豆甾醇(Stigmasterol)、β-谷甾醇(β-Sitosterol),与黄芪共有槲皮素(Quercetin),黄芪和白术共有成分为(3S,8S,9S,10R,13R,14S,17R)-10,13-Dimethyl-17-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopentaphenanthren-3-ol,见表1。利用TCMSP获得健脾解毒方共730个靶点,与有效成分匹配去重后得到197个健脾解毒方有效成分靶点。
2.2 肿瘤疾病靶点及共同靶点
利用GeneCards获得肿瘤相关靶点共26 170个基因靶点,以相关性分数为参数进行取中位数筛选后得到相关性分数>11.585 12的818个肿瘤相关基因靶点。将818个肿瘤相关靶点与健脾解毒方有效成分靶点匹配,取交集得到健脾解毒方共24个有效成分作用于86个肿瘤相关靶点。黄芪的有效成分Isomucronulatol-7,2'-di-O-glucosiole无相关作用靶点。见图1。
2.3 PPI网络构建及关键靶点筛选
将匹配后得到健脾解毒方有效成分及其抗肿瘤作用靶点导入Cytoscape(http://www.cytoscape.org/),构建健脾解毒方的药物-成分-疾病-靶点网络(图1)。图中不同颜色、形状的节点分别代表健脾解毒方有效成分和抗肿瘤作用靶点,有效成分节点的形状大小代表节点度的大小,边代表有效成分与作用靶点的作用关系。网络中共有110个节点,其中24个为有效成分,86个为抗肿瘤靶点,共有213条边。为了筛选出健脾解毒方抗肿瘤作用的关键靶点,对网络中有效成分及靶点分别进行节点度分析。健脾解毒方24个有效成分的节点度平均值为8.54,大于均值的有效成分节点为8个;86个抗肿瘤靶点的节点度平均值为2.48,大于均值的靶点有19个。其中健脾解毒方有效成分中槲皮素(Quercetin)、山柰酚(Kaempgerol)的节点度大于20,是发挥抗肿瘤作用的主要有效成分;前列腺素内过氧化物合酶2(Prostaglandin-endoperoxide synthase 2, PTGS2)、热休克蛋白90α家族A类成员1(Heat shock protein 90 alpha family class A member 1, HSP90AA1)、丝氨酸蛋白酶1(Serine protease 1, PRSS1)3个抗肿瘤靶点的节点度大于10,在网络中节点度位列前3位,我们预测PTGS2、HSP90AA1、PRSS1为健脾解毒方抗肿瘤作用的关键靶点。将PTGS2、HSP90AA1、PRSS1 3个关键靶点导入Cytoscape利用Bisogenet插件构建PPI网络。该网络包含852个节点,12 149条边,进一步以中心性(DC)>60为条件,筛选得到102个节点,2 093条边。见图2。

注:绿色菱形.白花蛇舌草有效成分;紫色菱形.白术有效成分;黄色菱形.黄芪有效成分;棕色菱形.山慈姑有效成分;红色菱形.共有有效成分;蓝色圆形.抗肿瘤靶点图1 健脾解毒方的有效成分-抗肿瘤靶点网络Fig. 1 Interaction network of effective ingredients of JPJDD-antitumor targets
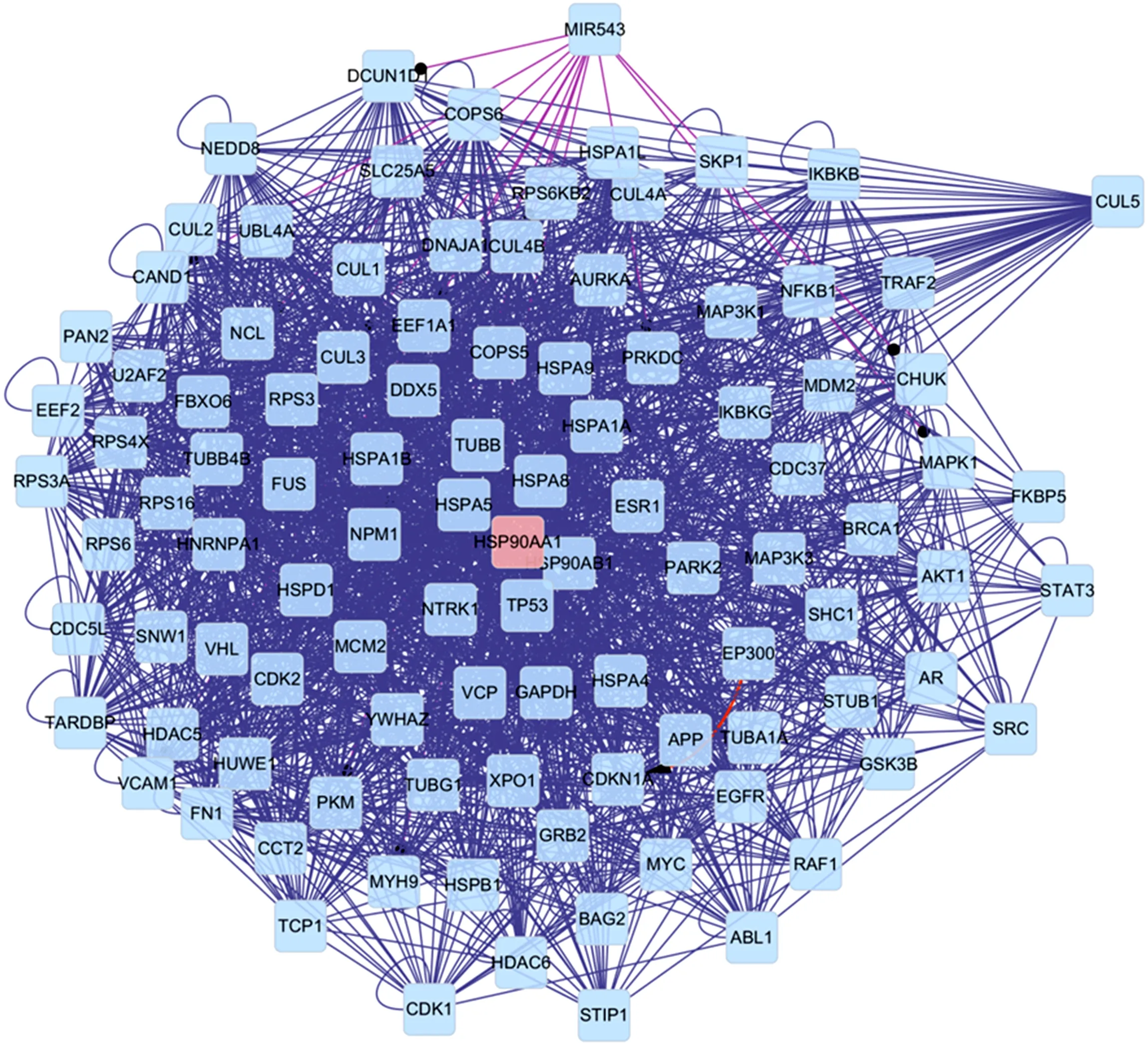
图2 关键靶点PPI网络Fig. 2 PPI network of the key targets
2.4 GO富集分析和KEGG通路富集分析
将“2.2项”中得到的健脾解毒方抗肿瘤的86个作用靶点导入R软件中,进行GO富集分析和KEGG通路富集分析。GO富集分析包括细胞成分(图3)、分子功能(图4)、生物过程(图5),分别选取其中富集程度最高的前20条。GO富集结果显示健脾解毒方有效成分主要作用于核染色质,转录因子复合物,高尔基体、内质网等颗粒性分泌囊腔,细胞膜区、微膜区、膜筏,外膜、细胞器外膜,蛋白激酶复合物等;分子功能包括调控泛素蛋白结合、RNA结合酶Ⅱ转录因子结合、细胞因子受体结合、磷酸酶结合、细胞黏附分子结合、生长因子受体结合,调节泛素样蛋白连接酶、DNA结合转录激酶、激酶调控因子、细胞因子等活性;共参与了1 770个生物学过程,包括氧化应激、细胞凋亡、肽基丝氨酸磷酸化、上皮细胞增殖、DNA结合转录因子以及功能调节等。

图3 GO富集分析细胞成分柱状图Fig. 3 CC barplot of GO enrichment

图4 GO富集分析分子功能柱状图Fig. 4 MF barplot of GO enrichment

图5 GO富集分析生物过程柱状图Fig. 5 BP barplot of GO enrichment
KEGG通路富集分析共得到153条富集信息,显示共同靶点主要富集于前列腺癌、胰腺癌、肝癌,也可作用于结直肠癌、乳腺癌、胃癌、肺癌,主要信号通路涉及PI3K-Akt信号通路、MAPK信号通路、肿瘤蛋白多糖、肿瘤微小核糖核酸、IL-17、细胞衰老等,选取富集程度最高的前20条见图6。

图6 KEGG通路富集分析气泡图Fig. 6 KEGG bubble
2.5 分子对接验证
健脾解毒方有效成分中槲皮素、山柰酚的节点度大于20,是发挥抗肿瘤作用的主要有效成分。将槲皮素、山柰酚与“2.3”项下获得的关键靶点基因进行分子对接,结果显示PTGS2、HSP90AA1、PRSS1与槲皮素、山柰酚的结合能均小于-5 kJ·mol-1,关键靶点与槲皮素、山柰酚均具有良好对接活性。见表2。分子对接选择结合能最低的位点进行图像可视化处理,见图7。

表2 健脾解毒方活性成分与关键靶点的分子对接结果Table 2 The dock results of the active ingredients of JPJDD and the key targets

图7 健脾解毒方主要有效成分与关键靶基因分子对接图Fig. 7 Molecular docking diagram of the active ingredients of JPJDD and the key targets
3 实验验证
3.1 材料
3.1.1 细胞 人结肠癌细胞株HCT-116购自中国科学院上海细胞研究所。细胞株用含10%胎牛血清的RPMI-1640培养液,置于37 ℃、5%CO2,饱和湿度的培养箱中培养。
3.1.2 药物 健脾解毒方由黄芪、炒白术、白花蛇舌草、山慈菇组成,醇提物由苏州市中医医院制备及质量控制。Matrigel基质胶(货号:356234)购自美国BD公司;Transwell小室(货号:3422)购自美国Corning公司;RIPA裂解液(货号:P0013C)、蛋白磷酸酶抑制剂(货号:P1046)、SDS-PAGE凝胶配制试剂盒(货号:P0012A)、BCA蛋白浓度测定试剂盒(货号:P0012)、超敏ECL化学发光试剂盒(货号:P0018S)均购自碧云天科技有限公司;兔源PTGS2抗体(货号:12282)、兔源p38MAPK抗体(货号:8690)、GAPDH抗体(货号:5174)、HRP标记的羊抗兔IgG(货号:7074)均购自美国CST公司。TRIzol试剂(货号:R401-01)、逆转录试剂盒(货号:R323-01)、qPCR定量试剂盒(货号:P213-01)购自南京诺唯赞生物科技有限公司。
3.1.3 主要仪器 SVE-6A1垂直流超净工作台,新加坡ESCO公司;TS-1000脱色摇床,江苏其林贝尔仪器制造有限公司;HERAcell 240i型CO2恒温培养箱,美国Thermo公司;CKX41-F32FL荧光倒置显微镜,日本Olympus公司;CPA225D电子天平,德国Sartorious Stedim Biotech公司;7500型全自动荧光定量PCR仪,美国ABI公司;680型酶标仪、Mini Protean 3 Cell小型垂直电泳仪、Trans-Blot®Turbo全能型蛋白转印系统、Chemidox化学发光成像仪,美国Bio-Rad公司。
3.2 实验方法
3.2.1 CCK-8法检测HCT-116细胞增殖与活性 取对数生长期的HCT-116细胞以每孔5 000个的浓度接种于96孔板中,待细胞完全贴壁,换无血清培养基培养。之后加入健脾解毒方醇提物,设置终浓度分别为12.5、25、50、100、200、300、400 μg·mL-1共7个剂量,并设不加药对照组。
48 h后,每孔按10%比例加入CCK-8溶液,待其完全混匀,放入37 ℃,继续培养2~4 h。酶标仪于490 nm/630 nm(双波长)处测定其吸光值。
根据健脾解毒方醇提物对HCT-116细胞作用48 h的细胞增殖与活性结果,确定半数抑制浓度(IC50),后续实验分别采用健脾解毒方的低、中、高剂量进行体外细胞研究。
3.2.2 Western blot检测HCT-116细胞中PTGS2和p38MAPK蛋白表达 取处于对数生长期的HCT-116细胞分为4组:对照组,健脾解毒方低、中、高剂量组。药物干预48 h后抽提细胞总蛋白:预冷的PBS清洗细胞2次,加入含蛋白酶抑制剂的裂解液,转移细胞悬液至离心管中,冰上裂解30 min,4 ℃离心12 000 r·min-1,5 min,取上清,可置于-80 ℃冰箱保存。BCA法测定蛋白的浓度后,取等量蛋白用10%SDS-PAGE分离,并转移至PVDF膜,将其置于5%BSA溶液中封闭1 h后加入PTGS2、p38 MAPK、GAPDH抗体4 ℃过夜。次日用TBST洗膜3次,每次10 min,再加入二抗,室温孵育1 h后用同样方法洗膜。最后按1∶1加入AB荧光底物,显影,定影,分析结果。
3.2.3 qPCR法检测HCT-116细胞中PTGS2和p38MAPK mRNA表达 上述细胞药物干预48 h后,收集细胞,加入1 000 μL TRIzol试剂及200 μL氯仿提取总RNA,应用Prime ScriptTMRT试剂盒进行逆转录制备cDNA。以GAPDH为内参进行荧光定量PCR扩增,检测各组细胞中PTGS2和p38MAPK mRNA的表达水平。扩增引物由上海生工生物工程有限公司合成。反应条件:95 ℃持续10 s,95 ℃持续5 s,60 ℃持续31 s,运行40个循环。PTGS2、p38MAPK和GAPDH的正向和反向引物在最终浓度为200 nmol·L-1时使用。序列如下:p38MAPK:上游5'-GAGGTGCCCGAGCGATACCA-3',下游5'-CCGCAGCTCCCTGTAGGTCCT-3';PTGS2,上游5'-AATGAGTACCGCAAACGCTTCT-3',下游5'-ttctgcagccattccttctc-3';GAPDH,上游5'-CCATCCTCCACTTGAC-3',下游5'-ACCCTGTAGCCA-3'。
3.2.4 构建PTGS2基因沉默的HCT-116细胞 慢病毒RNAi系统的质粒购自上海基因化学有限公司。使用GenScript(Piscataway,NJ,USA)的siRNA靶标探测器设计了4种针对人类PTGS2 mRNA的小干扰RNA(siRNA)[国家生物技术信息中心(NCBI)GenBank,NM 000963.2]。使用的靶序列如下:克隆1,5'-GCT GAATTTAACACCCCTAT-3'(1 230~1 250 bp);克隆2,5'-CCATTCTCCTTGAAGGACTT-3'(1 677~1 697 bp);克隆3,5'-GCAGATGAAATACCAGTCTTT-3'(1 463~1 483 bp);克隆4,5'-CATTCCCTTCCAAAT-3'(407 425 bp)。然后按照制造商的说明将克隆插入表达绿色荧光蛋白(GFP)的pFU-GW-RNAi载体。使用Lipofectamine®3000转染试剂(Invitrogen life technologies)将pFU-GW-RNAi载体与pHelper 1.0和pHelper 2.0载体共转染到293T细胞中。随后在293T细胞中对病毒进行了分析和扩增。用适量的病毒感染HCT-116细胞72 h,抑制内源性PTGS2的表达。
3.2.5 Transwell实验检测细胞迁移 取处于对数生长期的HCT-116细胞分为4组:对照组、健脾解毒方中剂量组、PTGS2基因沉默组、健脾解毒方中剂量组联合PTGS2基因沉默组,干预48 h后,离心收集细胞,制成4×105mL-1细胞悬液,按照每室150 μL加入Transwell小室的上室,血清浓度为0.5%,将含10 μg·mL-1Fibronectin试剂和15%血清的RPMI-1640培养液600 μL加入Transwell细胞培养小室的下室。置于37 ℃、5% CO2培养箱内,孵育48 h后取出,以95%乙醇固定滤膜10 min,结晶紫染色15 min,用湿润的棉签轻轻拭去滤膜上室面的细胞。光学显微镜下观察细胞迁移情况,测定迁移细胞数。每组平行设置3张滤膜。
3.2.6 PTGS2基因沉默的HCT-116细胞中的p38MAPK蛋白及mRNA表达 检测对照组、健脾解毒方中剂量组、PTGS2基因沉默组、健脾解毒方中剂量组联合PTGS2基因沉默组,干预48 h后p38MAPK蛋白及mRNA表达。
3.3 实验结果
3.3.1 健脾解毒方对结肠癌HCT-116细胞增殖的影响 CCK-8实验表明,健脾解毒方醇提物对结肠癌HCT-116细胞有明显的增殖抑制作用,并且呈剂量依赖性。健脾解毒方醇提物对HCT-116细胞作用48 h的IC50为200 μg·mL-1,故本研究后续实验分别采用50、100、200 μg·mL-1作为健脾解毒方的低、中、高剂量进行体外细胞研究。见图8。

图8 不同浓度健脾解毒方对HCT-116细胞增殖的影响Fig. 8 The cell proliferation of HCT-116 with different doses of JPJDD
3.3.2 HCT-116细胞中PTGS2和p38MAPK蛋白表达 Western blot结果显示,健脾解毒方低、中、高剂量各组均能够抑制HCT-116细胞中PTGS2蛋白表达,并呈剂量依赖性(P<0.01,P<0.001)。健脾解毒方中、高剂量组能显著降低p38MAPK蛋白表达(P<0.01)。PTGS2和p38MAPK二者表达呈同向变化。见图9。

注:与对照组比较,**P<0.01,***P<0.001。图9 不同浓度健脾解毒方对HCT-116细胞中PTGS2和p38MAPK蛋白表达的影响Fig. 9 The protein expressions of PTGS2 and p38MAPK in HCT-116 with different doses of JPJDD
3.3.3 HCT-116细胞中PTGS2和p38MAPK mRNA表达 qPCR结果显示,健脾解毒方低、中、高剂量组均能够抑制HCT-116细胞中PTGS2 mRNA表达,并呈剂量依赖性(P<0.01,P<0.001)。健脾解毒方中、高剂量组能显著降低p38MAPK mRNA表达(P<0.01)。PTGS2和p38MAPK二者表达呈同向变化。见图10。
3.3.4 健脾解毒方对沉默PTGS2基因的HCT-116细胞迁移能力的影响 Transwell实验结果显示,健脾解毒方能够显著抑制HCT-116细胞的迁移能力,其迁移细胞数较对照组明显减少(P<0.001),且沉默PTGS2基因也可显著抑制HCT-116细胞迁移(P<0.001);但PTGS2基因沉默联合中药组的细胞迁移较单纯中药组,或单纯PTGS2基因沉默组无明显差异。这表明PTGS2基因沉默后,健脾解毒方对HCT-116细胞的迁移能力无明显影响,其抑制结直肠癌细胞转移可能与下调PTGS2表达相关。见图11。
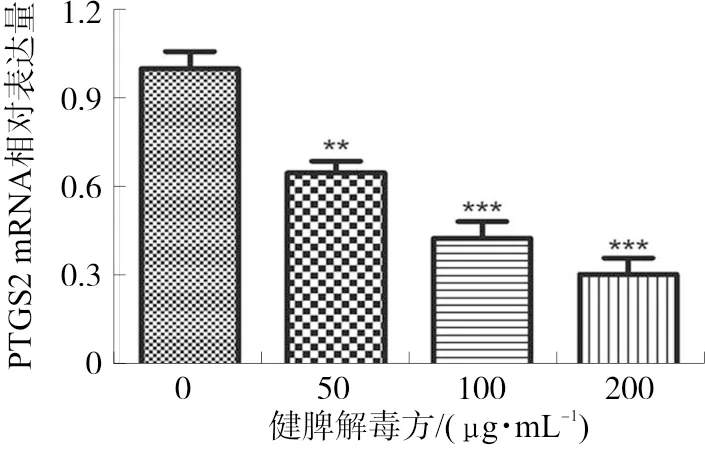

注:与对照组相比,**P<0.01,***P<0.001。图10 不同浓度健脾解毒方对HCT-116细胞中PTGS2和p38MAPK mRNA表达的影响Fig. 10 The mRNA expressions of PTGS2 and p38MAPK in HCT-116 with different doses of JPJDD

注:A.结晶紫染色观察各组细胞迁移情况;B.各组迁移细胞数比较。与对照组比较,***P<0.001。图11 各组细胞迁移情况比较Fig. 11 Cell migration in each group
3.3.5 健脾解毒方对PTGS2基因沉默的HCT-116细胞p38MAPK表达的影响 qPCR和Western blot检测结果显示,健脾解毒方能够明显抑制HCT-116细胞p38MAPK蛋白和mRNA的表达(P<0.001),且PTGS2基因沉默也可显著抑制p38MAPK表达(P<0.001);PTGS2基因沉默联合健脾解毒方对p38MAPK的表达均较对照组显著降低(P<0.001),且低于单纯中药组,但与PTGS2基因沉默组比较无明显差异。上述结果提示沉默PTGS2基因,健脾解毒方对HCT-116细胞p38MAPK表达无明显影响,健脾解毒方可能是通过调节PTGS2介导的p38MAPK表达发挥抗结直肠癌转移的作用。见图12。

注:与对照组比较,**P<0.01,***P<0.001。图12 各组细胞p38MAPK mRNA和蛋白表达Fig. 12 The mRNA and protein expressions of p38MAPK in each group
4 讨论
本研究借助网络药理学方法在多个中药成分数据库中筛选整合健脾解毒方25个有效成分,197个作用靶点,并通过GeneCards收集到肿瘤相关基因818条。将有效成分作用靶点与肿瘤相关基因靶点进行匹配后,得到健脾解毒方作用于86个肿瘤相关靶点的24个有效成分,其中槲皮素、山柰酚的节点度大于20,表明其可能为健脾解毒方主要抗肿瘤成分。
槲皮素、山柰酚都是天然的黄酮类化合物。槲皮素能够调节肿瘤相关的氧化应激反应、细胞周期停滞以及肿瘤增殖、凋亡、转移,它的抗癌特性主要通过调节血管内皮生长因子(VEGF),P13K/Akt/mTOR,MAPK/ERK1/2和Wnt/β-Catenin信号通路实现的[20]。山柰酚对乳腺癌、前列腺癌、结肠癌、肝癌、肺癌等均有抗肿瘤活性,在结直肠癌中山柰酚可以通过P13K/Akt信号通路抑制肿瘤细胞的增殖、促进凋亡[21-22]。
分析其86个作用靶点,发现PTGS2、HSP90AA1、PRSS1靶点的节点度大于10,说明在药物-疾病作用网络中均受到10个以上有效成分调控,PTGS2、HSP90AA1、PRSS1可能为健脾解毒方抗肿瘤的关键靶点。PTGS2,即环氧合酶2(COX-2)是前列腺素生物合成途径中的一种关键酶,其在早期和晚期结直肠癌组织中过度表达,预示着预后不良[23]。抑制PTGS2过表达有利于减少结直肠癌风险[24],这提示PTGS2可能在结直肠癌发生、发展、转移中发挥重要作用。MAPK家族蛋白参与细胞分化、迁移、凋亡和自噬[25]。我们在健脾解毒方的药物-成分-疾病-靶点网络中发现其也作用于MAPK14,即p38MAPKα,p38 MAPK是MAPK家族的关键成员,也是调节细胞对细胞因子和应激反应信号级联的一部分。但PTGS2、p38MAPK在结直肠癌中的作用机制还有待阐明,于是我们设计并进行了实验验证。
利用AutoDock对槲皮素、山柰酚与关键靶点基因进行分子对接,验证其结合能力,结果显示均对接良好,进一步说明槲皮素、山柰酚可能是通过PTGS2、HSP90AA1、PRSS1发挥抗肿瘤作用。
GO富集分析发现健脾解毒方有效成分可以调控转录、氧化应激反应、细胞凋亡、蛋白磷酸化、上皮细胞增殖等。KEGG通路富集分析显示健脾解毒方有效成分作用显著富集于前列腺癌、胰腺癌、肝癌,也可作用于结直肠癌、乳腺癌、胃癌、肺癌等肿瘤中,主要涉及PI3K/Akt信号通路、MAPK信号通路、细胞衰老等。这与以上槲皮素、山柰酚、PTGS2、HSP90AA1、PRSS1的现代药理学、生物学研究结果均一致。
在进一步实验验证中发现,健脾解毒方能够明显下调HCT-116细胞PTGS2和p38MAPK的mRNA和蛋白表达水平,且呈一定的剂量依赖性。而在沉默PTGS2基因后,健脾解毒方对HCT-116细胞p38MAPK的mRNA和蛋白表达无明显影响,提示PTGS2是健脾解毒方调节p38MAPK表达的关键靶点。研究结果初步表明,健脾解毒方通过调节PTGS2介导的p38MAPK表达,发挥抗结直肠癌转移的作用。
本研究通过网络药理学分析和分子对接技术,从理论上初步验证了健脾解毒方是通过“多药物、多成分、多靶点、多途径”协同发挥抗肿瘤作用的,并进一步从实验研究验证了其抑制结肠癌转移的机制与PTGS2介导的p38MAPK信号通路相关,这为研究中药复方抗肿瘤作用机制提供了参考。
