黄芪-莪术-重楼配伍降低血管内皮通透性抑制结肠癌转移作用的研究
2022-03-12刘甜甜卞勇关汉卿梁研郭文晖余倩慧唐德才
刘甜甜,卞勇,2,关汉卿,梁研,郭文晖,余倩慧,唐德才
(1.南京中医药大学中医学院·中西医结合学院,江苏 南京 210023;2.南京中医药大学实验动物中心,江苏 南京 210023)
转移是恶性肿瘤最显著的生物学特征,也是导致患者死亡的主要原因。血管内皮屏障的通透性与肿瘤转移密切相关[1],肿瘤细胞血行转移过程中需要两次跨越血管屏障(内渗、外渗)进出血液循环系统才能实现远端转移[2],血管内皮通透性的增加为肿瘤跨越血管内皮转移提供了有利条件。紧密连接是由跨膜蛋白[闭合蛋白(Claudin)、咬合蛋白(Occludin)、连接黏附分子(JAM)]、胞质附着蛋白(Zonula occluden,ZO)以及细胞骨架(微丝)等共同组成的复合体[3],是维持血管通透性和机械屏障的重要结构,也是阻碍肿瘤细胞跨血管内皮的重要屏障[4]。研究表明,转移性肿瘤细胞能通过分泌外泌体[5]、生长因子[6]、基质金属蛋白酶[7]等多种因子抑制血管内皮ZO-1、Occludin等紧密连接蛋白的表达,破坏血管内皮间紧密连接,增加血管通透性,进而实现远端转移。
黄芪、莪术、重楼分别是补气药、活血药、解毒药的代表,常用于肿瘤的治疗。含“黄芪-莪术-重楼”配伍的复方如芪术蚤复方[8]、益气化瘀解毒方[9]、健脾消癌方[10]等均在临床被用于抗肿瘤转移,且能显著抑制肿瘤术后患者的复发转移率,提高生存率。课题组前期研究也表明,黄芪-莪术-重楼配伍可以抑制结肠癌原位移植瘤的生长与转移[11];黄芪-莪术药对配伍不仅可以抑制结肠癌细胞的黏附与迁移[12],还可抑制肿瘤血管新生[13],改善肿瘤血管结构,促进肿瘤血管正常化新生[14]。因此,本研究拟观察黄芪-莪术-重楼配伍在人结肠癌细胞系HCT116跨血管内皮迁移过程中对血管间紧密连接以及血管通透性的影响,探究黄芪-莪术-重楼配伍抑制HCT116细胞血行转移的作用机制,为黄芪-莪术-重楼配伍抗肿瘤转移的临床应用提供依据。
1 材料
1.1 实验细胞
人脐静脉内皮细胞株(HUVEC)、HCT116均购于中国科学院细胞库。
1.2 实验动物
32只4~5周SD雄性大鼠,体质量(200±20)g,购自杭州医学院,合格证号:SCXK(浙)2019-0002。饲养于南京中医药大学实验动物中心SPF级屏障环境,室温(22±1) ℃,湿度为40%~70%,12 h明/暗光照周期,实验期间自由进食和饮水。实验动物环境使用许可证号:SYXK(苏)2018-0049。所有实验操作符合科技部颁发的《关于善待实验动物的指导性意见》,并获得南京中医药大学动物伦理委员会批准(伦理批号:202110A048)。
1.3 主要药物与试剂
黄芪为蒙古黄芪Astragalusmembranaceus(Fisch.) Bge. var. mongholicus (Bge.) Hsiao的干燥根;莪术为温郁金CurcumawenyujinY.H. Chen et C. Ling的干燥根茎;重楼为云南重楼ParispolyphyllaSmith var. yunanensis (Franch.) Hand.-Mazz.的干燥根茎。上述药材饮片均购自江苏省中医院中药房,由南京中医药大学药学院陆兔林教授鉴定。胎牛血清(美国Gibco,批号:2115802RP),CCK-8法细胞增殖检测试剂盒(凯基生物,批号:KGA317-1),异硫氰酸荧光素-葡聚糖(FITC-dextran,美国Sigma,批号:FD40-100MG),细胞膜荧光探针DiI标记溶液(广州碧云天,批号:C1036),细胞膜荧光探针DiO标记溶液(广州碧云天,批号:C1038),戊巴比妥钠(美国Sigma,批号:F20160721),GAPDH抗体(美国Affinity,批号:AF7021),RhoA抗体(美国Affinity,批号:AF6352),ROCK抗体(美国Affinity,批号:AF7016),ZO-1抗体(武汉三鹰,批号:21773-1-AP),FITC标记山羊抗兔IgG(武汉三鹰,批号:SA0003-2)。
1.4 主要仪器
超净工作台(中国苏州净化,SW-CJ-1FD),CO2培养箱(美国Thermo,BB150),Count star细胞计数仪(上海睿钰生物科技,IC1000),荧光酶标仪(瑞士Tecan,Infinite M1000 Pro),荧光倒置显微镜摄像系统(德国Leica,ebq 100-04),超高分辨率激光共聚焦显微镜(德国Leica,SP8 STED 3X),垂直电泳槽(上海天能科技,VE-180),凝胶成像系统(上海天能科技,5300)。
2 方法
2.1 中药水提液制备
根据课题组前期研究[11]和临床使用经验,选用黄芪、莪术、重楼药物用量比例为4∶2∶3。药物浸泡0.5 h后,加10倍量的纯水微沸回流提取2次,每次1 h,并用挥发油测定器收集莪术油。趁热过滤后合并2次滤液。旋转蒸发浓缩药液后,加入莪术油合并药液,定容至药液浓度为1 g·mL-1即为黄芪-莪术-重楼配伍高剂量组药液,中、低剂量组按照1∶1、1∶3的比例用纯水进行稀释,置于4 ℃保存。
2.2 含药血清制备
SPF级雄性SD大鼠32只,分为黄芪-莪术-重楼配伍低剂量组(2.1 g·kg-1)、中剂量组(4.2 g·kg-1)、高剂量组(8.4 g·kg-1)以及空白对照组(生理盐水)。灌胃给药,每日1次,连续7 d,末次给药1 h后腹主动脉采血。血液静置2 h后于离心机中3 000 r·min-1离心10 min。取上层血清,将同组各血清混合,于56 ℃水浴锅中灭活30 min,使用0.22 μm微孔滤膜过滤灭菌后移入无菌离心管中,置于-20 ℃保存备用。
2.3 HUVEC-HCT116共培养模型体系构建与分组
取对数生长期的HUVEC细胞和HCT116细胞,胰酶消化制成单细胞悬液,以1∶1的比例分别接种在Transwell小室的上室和下室中,构建HUVEC-HCT116共培养体系,并于37 ℃、5% CO2细胞培养箱中静置培养。HUVEC-HCT116共培养体系构建后,实验分为共培养模型组、黄芪-莪术-重楼配伍低剂量组、黄芪-莪术-重楼配伍中剂量组、黄芪-莪术-重楼配伍高剂量组,另设HUVEC细胞单独培养为单培养对照组。
2.4 细胞增殖实验
将对数生长期的HUVEC细胞接种于96孔板,根据分组,分别给予10%的空白对照血清以及10%的低、中、高剂量黄芪-莪术-重楼配伍含药血清,培养箱中继续培养。于24、48 h后各取出一块96孔板检测,每孔加入10 μL CCK-8孵育1 h后,酶标仪于450 nm波长处测定每孔的吸光度(OD)值并计算细胞相对增殖率。细胞相对增殖率=OD含药血清/OD空白对照血清×100%。
2.5 单层血管内皮渗透性实验
根据分组,依次在HUVEC-HCT116共培养体系中加入10%的空白对照血清以及10%的低、中、高剂量黄芪-莪术-重楼配伍含药血清,单培养对照组给予10%的空白对照血清,培养箱中继续培养48 h。各组上、下室更换等体积无血清培养基后,在上室中加入1 mg·mL-1FITC-dextran,37 ℃培养箱孵育30 min。30 min后分别取100 μL各组Transwell下室培养基,荧光酶标仪检测吸收波长为480 nm、发射波长为520 nm的各组荧光强度。以FITC-dextran荧光强度来反映单层血管内皮通透性。
2.6 跨血管内皮迁移实验
取对数生长期的HUVEC细胞,用DiO细胞膜荧光探针工作溶液进行染色,胰酶消化后制备成单细胞悬液,铺于Transwell小室(8.0 μm)中,并取对数生长期的HCT116细胞铺于下室构建共培养体系,另设下室不含HCT116细胞的HUVEC单培养组作为单培养对照组。待HUVEC单培养组细胞形成致密单层后,将Transwell小室移至新的24孔板中。取对数生长期的HCT116细胞,用DiI细胞膜荧光探针工作溶液进行染色,胰酶消化后,按照每孔3×104个加入含HUVEC单层的Transwell上室中,并根据分组依次加入10%的空白对照血清以及10%的低、中、高剂量黄芪-莪术-重楼配伍含药血清,HUVEC单培养组加入10%的空白对照血清。下室均加入含20%胎牛血清的RPMI 1640培养基。培养箱中静置培养32 h,荧光显微镜观察拍摄迁移细胞数量。
2.7 免疫荧光实验
根据分组,依次在HUVEC-HCT116共培养体系中加入10%的空白对照血清以及10%的低、中、高剂量黄芪-莪术-重楼配伍含药血清,单培养组给予10%的空白对照血清,48 h后从培养箱中取出。4%多聚甲醛室温固定15 min,0.25% Triton透膜15 min,再用5%BSA封闭液封闭30 min。PBS洗涤后,加入一抗(ZO-1 1∶100)4 ℃孵育过夜。加入FITC标记的山羊抗兔二抗(1∶500)室温孵育1 h,PBS 洗涤后,DAPI染核,超高分辨率激光共聚焦显微镜观察拍照,采用Image J软件进行荧光强度分析。
2.8 Western blot实验
取出分组给药48 h后的HUVEC-HCT116共培养体系,预冷PBS洗涤HUVEC细胞,加细胞裂解液裂解细胞后,离心收集蛋白。BCA法蛋白定量后,加入蛋白上样缓冲液,100 ℃、10 min加热变性,-80 ℃保存备用。SDS-PAGE凝胶电泳、转膜,5%BSA室温封闭2 h。封闭后加入一抗(RhoA、ROCK、ZO-1 1∶500,GAPDH 1∶2 000),4 ℃孵育过夜。室温孵育HRP偶联的二抗(1∶1 000)1 h后,ECL显色。采用Image J软件进行蛋白条带灰度值分析。
2.9 统计学方法

3 结果
3.1 黄芪-莪术-重楼配伍对HUVEC细胞增殖的影响
与空白对照组相比,给药24 h后黄芪-莪术-重楼配伍各剂量含药血清均可抑制HUVEC细胞的增殖,但差异无统计学意义。给药48 h后,黄芪-莪术-重楼配伍各剂量含药血清均可抑制HUVEC增殖,差异有统计学意义(P<0.01),且呈现剂量依赖性。黄芪-莪术-重楼配伍各剂量组HUVEC的相对增殖率均在80%以上,表明黄芪-莪术-重楼配伍虽可抑制HUVEC的增殖但对其增殖活性的影响较弱。结果见图1。
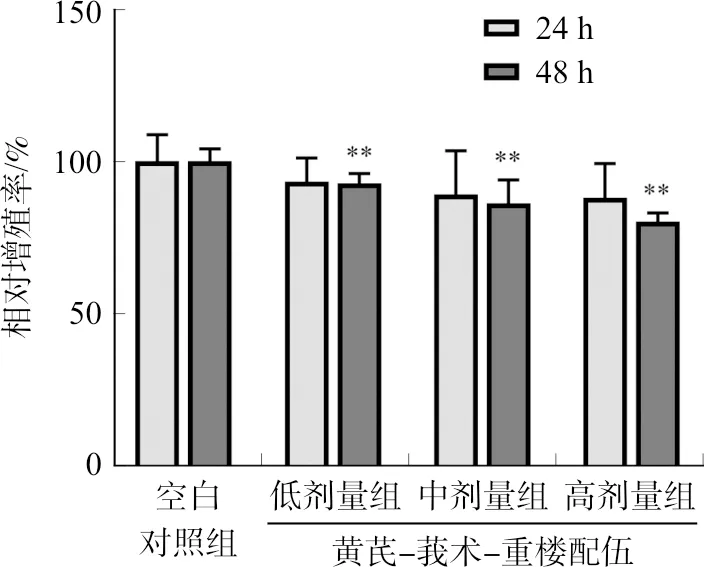
注:与空白对照组相比,**P<0.01。图1 黄芪-莪术-重楼配伍对HUVEC细胞增殖的影响Fig.1 Effect of Huangqi-Ezhu-Chonglou combination on the proliferation of HUVECs
3.2 黄芪-莪术-重楼配伍对单层HUVEC细胞通透性的影响
共培养模型组的荧光强度较单培养对照组明显增加(P<0.01),表明HCT116与HUVEC共培养后,会破坏HUVEC单层通透性,促进FITC-dextran的渗出;与共培养模型组相比,黄芪-莪术-重楼配伍各剂量组荧光强度表达明显减弱(P<0.01),FITC-dextran的渗出明显减少,受损HUVEC单层的通透性明显降低,且呈剂量依赖性。结果见图2。
3.3 黄芪-莪术-重楼配伍对结肠癌HCT116细胞跨血管内皮迁移的影响
与单培养对照组相比,共培养模型组跨越单层血管内皮的HCT116数量明显增多(P<0.01);黄芪-莪术-重楼配伍各剂量组跨越单层血管内皮的HCT116数量较共培养模型组均显著减少(P<0.05,P<0.01)。结果见图3。
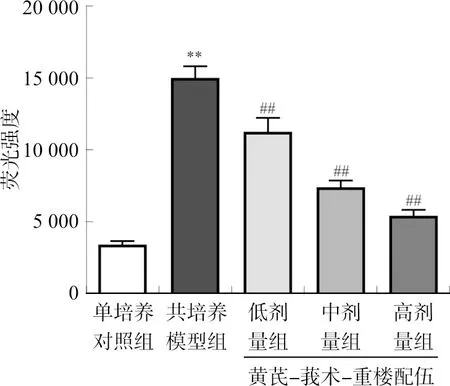
注:与单培养对照组相比,**P<0.01;与共培养模型组相比,##P<0.01。图2 黄芪-莪术-重楼配伍对单层HUVEC细胞通透性的影响Fig.2 Effect of Huangqi-Ezhu-Chonglou combination onpermeability of monolayer HUVECs

注:绿色荧光为HUVEC致密单层;红色荧光为跨内皮迁移的HCT116;与单培养对照组相比,**P<0.01;与共培养模型组相比,#P<0.05,##P<0.01。图3 黄芪-莪术-重楼配伍对HCT116细胞跨血管内皮迁移的影响Fig.3 Effect of Huangqi-Ezhu-Chonglou combination on transvascular endothelial migration of HCT116 cells
3.4 黄芪-莪术-重楼配伍对HUVEC细胞ZO-1表达的影响
免疫荧光结果显示,紧密连接蛋白ZO-1主要集中在HUVEC细胞膜上表达。与单培养对照组相比,共培养模型组ZO-1荧光强度较弱且呈断点状分布,蛋白表达量明显减少(P<0.01);黄芪-莪术-重楼配伍各剂量组ZO-1荧光强度较共培养模型组显著增强(P<0.01),其分布也较为连续,未出现明显断点,蛋白表达量明显增加(P<0.05,P<0.01)。结果见图4~5。

注:与单培养对照组相比,**P<0.01;与共培养模型组相比,##P<0.01。图4 免疫荧光法检测黄芪-莪术-重楼配伍对HUVEC细胞ZO-1表达的影响Fig.4 Effect of Huangqi-Ezhu-Chonglou combination on the expression of ZO-1 in HUVECs by immunofluorescence assay
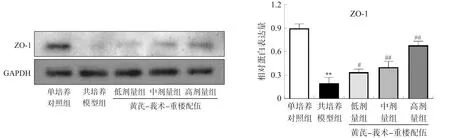
注:与单培养对照组相比,**P<0.01;与共培养模型组相比,#P<0.05,##P<0.01。图5 各组HUVEC细胞中ZO-1蛋白表达的比较Fig.5 Comparison of ZO-1 protein expression in HUVECs in each group
3.5 黄芪-莪术-重楼配伍对RhoA、ROCK蛋白表达的影响
与单培养对照组相比,共培养模型组RhoA、ROCK蛋白表达显著增加(P<0.01);与共培养模型组相比,黄芪-莪术-重楼配伍各剂量组RhoA、ROCK蛋白表达显著降低(P<0.05,P<0.01)。见图6。
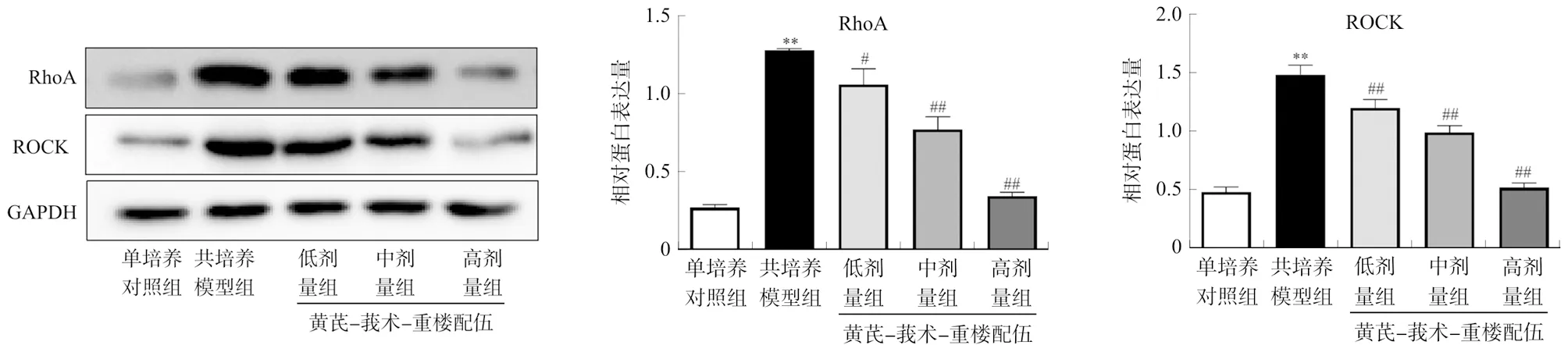
注:与单培养对照组相比,**P<0.01;与共培养模型组相比,#P<0.05,##P<0.01。图6 各组HUVEC细胞中RhoA、ROCK蛋白表达的比较Fig.6 Comparison of RhoA and ROCK protein expressions in HUVECs in each group
4 讨论
研究表明,维护血管间紧密连接和保持血管完整性是诱导肿瘤血管正常化、减少转移的重要策略[15]。现代药理研究表明,黄芪、莪术、重楼均可抑制肿瘤细胞增殖、转移,抑制肿瘤血管新生以及修复内皮损伤、保护血管[16-20]。三者配伍使用益气活血解毒,一能解毒散邪,杀伤肿瘤细胞;二能荣养血脉,修复血管内层与整体形态,维护血管屏障。三药协同增效,扶正祛邪、标本兼顾,共同发挥抑制肿瘤转移的作用。课题组前期研究也发现黄芪-莪术配伍可抑制结肠癌与血管内皮的黏附进而抑制结肠癌血行转移。黄芪与莪术的主要成分黄芪多糖与姜黄素联用能减少血管分支和出芽,改善肿瘤血管的形态结构,诱导肿瘤血管正常化,抑制血管过度渗漏进而抑制肿瘤的发展[21];基于前期研究基础,本研究发现黄芪-莪术-重楼配伍能改善HCT116细胞引起的血管内皮损伤,维护血管屏障的通透性,并抑制HCT116细胞的跨内皮迁移。
ZO-1是紧密连接的主要组成,连接Occludin与肌动蛋白骨架纤维(F-actin),决定着紧密连接的结构和功能[22],与内皮细胞通透性的关系最为密切,常作为细胞间屏障功能的主要评价指标[23]。研究表明,肿瘤细胞可以分泌基质金属蛋白酶(MMPs)、血管内皮生长因子(VEGF)等多种物质破坏ZO-1,促进紧密连接的解离,增加细胞间空隙与血管通透性,从而有利于肿瘤细胞的血行转移[24-25]。Zhang等[26]研究发现麦冬皂苷C1能通过增强血管内皮ZO-1的表达,维护血管的完整性,阻止非小细胞肺癌渗出血管,进而抑制非小细胞肺癌的转移。魏殿芳[27]研究也表明阿司匹林上调紧密连接蛋白ZO-1和Occludin后,能够降低血脑屏障的通透性,抑制肺癌的脑转移。前期研究发现,含黄芪-莪术-重楼配伍的芪术抗癌方抑制MMP-9、VEGF等的表达后,可以抑制结肠癌原位移植瘤的肝转移[28]。本实验使用不同剂量的黄芪-莪术-重楼配伍含药血清处理HUVEC-HCT116共培养体系后发现,黄芪-莪术-重楼配伍能够上调HUVEC-HCT116共培养体系中HUVEC细胞ZO-1的表达,提示黄芪-莪术-重楼配伍可能通过调控ZO-1蛋白,维护血管屏障功能,发挥抑制HCT116细胞跨内皮迁移的作用。
RhoA/ROCK是调控内皮细胞屏障功能的重要信号通路[29],紧密连接的结构与功能以及紧密连接蛋白的分布与表达也受RhoA/ROCK的调控。肿瘤细胞分泌相关细胞因子激活RhoA及其效应分子ROCK后,能够促进ZO-1的磷酸化,导致紧密连接解体、血管通透性增加[30-31]。而使用ROCK抑制剂抑制RhoA/ROCK通路的激活则可以改善血管屏障功能的损伤,抑制肿瘤转移[32-33]。本研究也发现,HUVEC与HCT116共培养后,RhoA、ROCK蛋白的表达显著增加,提示HCT116细胞可能通过激活HUVEC细胞RhoA/ROCK通路抑制ZO-1蛋白的表达,破坏血管内皮间的紧密连接,进行跨内皮迁移。黄芪-莪术-重楼配伍可能通过抑制RhoA/ROCK通路的激活,增强ZO-1蛋白的表达,维持血管的通透性与屏障功能,从而发挥抑制结肠癌HCT116细胞跨内皮迁移的作用。
本研究通过体外构建HUVEC-HCT116共培养体系,模拟结肠癌细胞穿越血管内皮的相关过程,探究黄芪-莪术-重楼配伍对结肠癌跨血管内皮血行转移的影响。但体外共培养模型难以完全反映肿瘤跨越血管内皮实现血行转移的复杂过程,后续我们将通过体内实验进一步研究黄芪-莪术-重楼配伍对肿瘤血行转移的影响,为补气活血解毒法抗肿瘤转移的临床应用提供依据。
