基于DARTS 技术的丹参素钠直接结合靶蛋白鉴定*
2022-03-11陈缘静蒋薇薇李丽华张成中
陈缘静,蒋薇薇,李丽华,张成中,张 川,2,贾 丹**
1 海军军医大学 药学系,上海 200433;2 上海大学 医学院,上海 200444
丹参素是唇形科植物丹参(Salvia miltiorrhiza Bge.)中主要的水溶性酚酸类化合物,广泛用于心血管疾病的预防和治疗。丹参素结构中含有邻二酚羟基,易被氧化、稳定性差;另外由于羧基的存在,水溶性强,很难透过细胞膜的脂质双分子层,口服给药时绝对生物利用度低;同时羧基能够与葡萄糖醛酸结合随尿液排出体外,故在体内的半衰期很短,极大地限制了丹参素的临床应用[1]。丹参素钠是丹参素的羧酸盐,两者生物活性相当,但前者性质更为稳定。
丹参素钠注射剂于2016 年由CFDA 批准为中药一类新药进入Ⅰ期临床试验(CXZL1000089),用于冠心病及稳定性心绞痛的治疗。研究表明,丹参素钠可通过减轻自由基损伤、抑制炎症反应、防止心肌缺血损伤、促进血管内皮生长等多种途径发挥心脏保护作用[2]。但是,目前丹参素钠直接结合的靶蛋白仍不明确,其潜在心血管保护作用机制仍待深入研究。
明确药物作用靶点,有助于针对靶点进行药物结构的优化改造,以增强药效及降低药物的毒副作用。药物亲和反应靶点稳定技术(drug affinity responsive target stability,DARTS)是一种新型靶标鉴定方法,它的原理是药物与靶蛋白结合后能够稳定靶蛋白,使其抵抗蛋白酶的消化作用。该技术最大优势在于活性化合物无需任何结构修饰、不影响药物活性,适用于任何小分子化合物的靶蛋白鉴定[3]。目前,该技术已成功用于多种药物的靶点鉴定。因此,本研究拟采用DARTS 技术鉴定丹参素钠可能的直接结合靶蛋白,探究其心血管保护作用机制,为临床应用提供科学依据。
1 材 料
1.1 细胞
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)由海军军医大学药学系药理学教研室赠与。
1.2 药品与试剂
丹参素钠盐由海军军医大学药学系中药鉴定学教研室提供(纯度≥99%),用磷酸盐缓冲液(PBS)配成50 mmol·L-1母液于-20 ℃保存备用,使用时用细胞培养液稀释至不同浓度。胎牛血清(FBS)购自Gibco Life Technology Co.(澳大利亚);Dulbecco 改良的Eagle 培养基(DMEM)和PBS 购自Hyclone(Thermo Fisher);青霉素、链霉素和胰蛋白酶购自Gibco-BRL Co.(Rockville,MD,USA);哺乳动物蛋白提取试剂盒M-PER®(Thermo Scientific);链霉素蛋白酶(Pronase)(Roche,美国);蛋白酶抑制剂(Complete Mini,Roche,美国);,磷酸酶抑制剂、5×SDS-PAGE 蛋白上样缓冲液、快速银染试剂盒(碧云天生化公司);CD44 抗体(BioVision);GAPDH抗体、重组人CD44 蛋白(Abcam);IRDye 800CW 山羊抗兔或IRDye 680RD 山羊抗鼠二抗(Rockland Immunochemicals,Inc.,美国)。
2 方 法
2.1 细胞培养
HUVEC 细胞用含10% FBS、100 U·mL-1青霉素和100 μg·mL-1链霉素的DMEM 培养基培养,置于37 ℃、5%CO2的培养箱中,取对数生长期的细胞进行后续实验。
蛋白提取按照M-PER®试剂盒说明书进行操作。取约1×107个贴壁生长的HUVEC 细胞,弃去完全培养基,以预冷PBS 液洗涤3 次,加入含蛋白酶抑制剂和磷酸酶抑制剂的提取缓冲溶液1 mL,冰上孵育10 min,涡旋5 min,4 ℃14000×g 离心15 min,收集上清液即为蛋白溶液。BCA 法测定蛋白浓度,立即进行后续实验。
2.2 链霉素蛋白酶Pronase 浓度的考察
取含有100 μg 蛋白的20 μL 反应体系,共7份,分别加入2 μL 不同终浓度的Pronase(0、0.01%、0.03%、0.1%、0.3%、1%和3%,浓度以蛋白酶质量相对于总蛋白质量的百分数表示),混匀后室温孵育30min,分别加入5×SDS-PAGE 蛋白上样缓冲液6μL,煮沸10 min,进行聚丙烯酰胺凝胶电泳(SDSPAGE),对凝胶进行硝酸银染色,采用GS-800 光密度扫描仪(Bio-Rad,美国)采集图像。
2.3 丹参素钠浓度的考察
取含有100 μg 蛋白的20 μL 反应体系,共6 份,分别加入不同终浓度(0、10、50、250、500、1000 μmol·L-1)的丹参素钠2 μL,混匀后室温孵育60 min,分别加入终浓度为0.03%的Pronase 2 μL,混匀后室温孵育30 min,分别加入5×SDS-PAGE 蛋白上样缓冲液6 μL,煮沸10 min,后续步骤同上。
2.4 链霉素蛋白酶、丹参素钠浓度的考察
取含有100 μg 蛋白的20 μL 反应体系,共7份,分别加入终浓度500 μmol·L-1的丹参素钠2 μL,混匀后室温孵育60 min,分别加入不同终浓度的Pronase(0、0.01%、0.03%、0.1%、0.3%、1%和3%,浓度以蛋白酶质量相对于总蛋白质量的百分数表示)2 μL,混匀后室温孵育30 min,分别加入5×SDSPAGE 蛋白上样缓冲液6 μL,煮沸10 min,后续步骤同上。
2.5 DARTS 实验鉴定丹参素钠拟结合靶标蛋白
参照文献报道[4,5],取含有100 μg 蛋白的20 μL反应体系,共7 份,分别加入不同终浓度的丹参素钠(0、10、50、250、500、1000 μmol·L-1)2 μL,混匀后室温孵育60 min,分别加入终浓度0 或0.03%的Pronase(浓度以蛋白酶质量相对于总蛋白质量的百分数表示)2 μL,混匀后室温孵育30 min,分别加入5×SDS-PAGE 蛋白上样缓冲液6 μL,煮沸10 min,进行SDS-PAGE 电泳,银染,取目标条带交由生工生物工程(上海)股份有限公司通过基质辅助激光解吸电离-飞行时间质谱(MALDI-TOF)及特异性肽段进行蛋白质解析,并通过Western blotting 验证。
2.6 免疫印迹实验(Western blotting)
取30 μg 蛋白样品进行SDS-PAGE 电泳,转移至PVDF 膜(0.45 μm),5%脱脂牛奶室温封闭2 h。然后将膜与CD44(1∶2000)和GAPDH(1∶3000)一抗4 ℃孵育过夜,最后与IRDye 800CW 山羊抗兔或IRDye 680RD 山羊抗鼠二抗(1∶5000)室温避光孵育2 h。GAPDH 作为内参。LI-COR 检测系统和Tanon图像系统(Tanon,China)分析蛋白条带灰度。
2.7 表面等离子共振分析丹参素钠与潜在靶标蛋白的结合
将50 μg·mL-1纯化的人全长CD44 蛋白(Abcam)应用氨基偶联法固定到HisCap 传感器芯片表面。在流动相缓冲液(1×PBS,0.5% DMSO)中加入不同浓度的丹参素钠,观测芯片产生的响应信号。使用Biacore T2000(GE Healthcare)控制软件计算结合和解离速率常数。结合亲和力用结合速率常数与解离速率常数的比率表示。
3 结果
3.1 DARTS 实验
在DARTS 实验中,蛋白酶的作用浓度是考虑的首要因素。不同终浓度的蛋白酶Pronase(0、0.01%、0.03%、0.1%、0.3%、1%和3%)对HUVEC 细胞总蛋白的消化作用如图1A 所示。与不加Pronase的对照组相比,较低浓度的Pronase(0.01%)对蛋白的消化作用较弱,蛋白条带与对照组几乎没有差别;而较高浓度的Pronase(0.1%、0.3%、1%和3%)对蛋白的消化作用过强,分子量较大的蛋白几乎完全被消化成分子量较小的蛋白或肽段。因此,选取消化作用适中的0.03% Pronase 作为本次DARTS 实验中的酶浓度。
药物与靶蛋白的结合存在浓度依赖关系,因此药物浓度是DARTS 实验中的另一个重要因素。对于亲和力较低或亲和力未知的化合物,文献推荐使用浓度为500 μmol·L-1的化合物,在此浓度下不会因为化合物的浓度过高产生非特异性结合[6]。比较不同浓度丹参素钠作用下Pronase 对HUVEC 细胞总蛋白的消化作用,结果如图1B 所示。在较高浓度(1000 μmol·L-1)的丹参素钠作用时,给药组与对照组的蛋白条带能够呈现出差异,在低分子量处对照组较重。而在较低浓度(10、50 μmol·L-1)的丹参素钠作用时,给药组与对照组的差异不明显。因此,为了能够鉴定出更为明显的丹参素钠的结合蛋白,选取500 μmol·L-1丹参素钠作为本实验中的药物浓度。
在500 μmol·L-1丹参素钠浓度下,加入不同浓度的Pronase 作用。如图1C 所示,500 μmol·L-1丹参素钠、0.03% Pronase 作用时,给药组与对照组的差异蛋白条带较为明显。接下来,将HUVEC 细胞蛋白裂解液与不同浓度的丹参素钠孵育,然后用0.03%Pronase 消化。采用SDS-PAGE 的方法来表征DARTS 实验的结果,从凝胶上鉴别出给药组和对照组中的差异蛋白条带。银染结果表明,与丹参素钠孵育的细胞蛋白裂解物约在100 kDa 处有明显的条带,且随着丹参素钠浓度的增加愈加清晰(图1D)。根据DARTS 技术原理,丹参素钠能够保护此条带中的蛋白使其抵抗pronase 链霉蛋白酶的消化作用,故认为此条带中的蛋白是可能的丹参素钠在HUVEC 细胞中的结合靶蛋白。

图1 DARTS 实验中链霉素蛋白酶Pronase、丹参素钠作用浓度的考察
3.2 蛋白质谱分析及Western blotting 验证丹参素钠结合蛋白
采用基质辅助激光解吸电离飞行时间串联质谱(MALDI-TOF/TOF MS),分析对照组与丹参素钠给药组的SDS-PAGE 差异蛋白切割胶。结合两次蛋白质谱分析结果,通过Mascot 检索,利用特异性肽段,结合蛋白分子量、肽段可信度的综合评分,初步筛出CD44 可能为丹参素钠的结合靶蛋白,有4 条特异性肽段被鉴定到(见图2A)。将经过DARTS 实验的样品,采用蛋白质印迹(Western blotting)通过CD44 鼠抗人单克隆抗体进一步证实。结果如图2B 所示,不同浓度的丹参素钠与目的蛋白CD44 结合后,均不同程度地提高了目的蛋白CD44 的稳定性,降低了Pronase 对CD44 的消化作用。
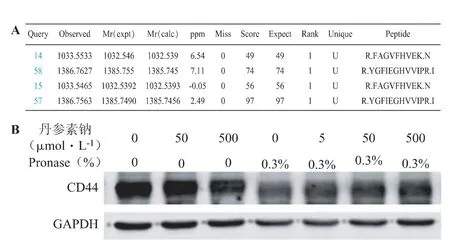
图2 (A)靶蛋白的质谱鉴定结果(B)Western blotting 验证丹参素钠与结合靶标蛋白CD44 的DARTS 实验结果
3.3 利用表面等离子体共振(SPR)技术测定丹参素钠与靶蛋白之间的结合常数
DARTS 及蛋白质免疫印迹实验表明,丹参素钠在HUVEC 细胞中可能的结合靶蛋白为CD44,然后用BiacoreT200 生物分子相互作用分析系统、进行丹参素钠与靶蛋白CD44 相互作用的动力学分析。成功测定了丹参素钠1000、500、250、125、62.5、31.25、15.625 μmol·L-1等浓度下的响应值,计算出丹参素钠与靶蛋白CD44 的结合常数为4.84×10-4mol·L-1,见图3。

图3 CD44 对不同浓度的丹参素钠的响应曲线
4 讨论
前期课题组利用HuProtTM20K 人类蛋白组芯片,发现丹参素钠可与370 个蛋白产生特异性结合[7]。尽管该方法是一种鉴定蛋白质-小分子相互作用快速经济、高通量的手段;但其自身也存在一些局限性[8]:蛋白质组芯片是在体外分子水平研究蛋白质与化合物的相互作用的,芯片中的蛋白质固定之后失去了它们的天然结构;高丰度蛋白会干扰低丰度蛋白的检测,导致假阳性结果;非特异性结合存在干扰效应;该技术是基于“勾钓”原理,无法鉴别与化合物产生瞬时作用的靶蛋白。
本实验以DARTS 技术鉴定丹参素钠在人脐静脉内皮细胞中的结合靶蛋白。该方法最大的优势是小分子化合物无需任何结构修饰,不影响化合物的生物活性。鉴于DARTS 实验对于蛋白酶作用浓度及药物浓度都有严格的要求,本实验通过酶浓度和化合物浓度梯度实验,确定了以0.03%的蛋白酶浓度和500 mmol·L-1的化合物浓度作为实验的最终条件。
结果表明,丹参素钠在HUVEC 细胞中可能的结合靶蛋白为CD44。CD44 是一种细胞表面跨膜糖蛋白,参与细胞的增殖、分化、迁移以及血管生成等多项生命活动[9]。研究表明,CD44 与心血管疾病密切相关。Yang LW 等[10]发现,小鼠CD44 缺乏可保护心脏抵抗血管紧张素Ⅱ诱导的心脏纤维化;Suleiman M等[11]报道,CD44-透明质酸相互作用参与细胞外基质重塑、组织纤维化和心力衰竭等过程。另外,大量研究发现,CD44 在许多癌细胞中都有异常表达,与癌症的侵袭和转移有着密切的联系[12]。丹参素钠可为CD44 小分子抗肿瘤抑制剂的设计提供新型骨架。
本实验利用表面等离子体共振技术(surface plasmon resonance,SPR)测定丹参素钠与靶蛋白之间的结合常数为4.84×10-4mol·L-1,药物与靶蛋白的结合能力较弱,有可能是该技术本身的局限性。SPR生物传感器灵敏度较低,尤其当生物识别原件为分子量较大的膜蛋白(如CD44)、而被检测的药物分子量较小时,响应信号就会比较弱[13]。所以测得分子量小的丹参素钠与靶蛋白膜蛋白CD44 之间的结合常数较小,并不代表丹参素钠的靶蛋白不是CD44。丹参素钠在人脐静脉内皮细胞中的直接结合靶蛋白为CD44,可能通过与CD44 蛋白结合并发挥心血管保护作用。后续需要在分子、细胞及整体动物水平上围绕丹参素钠对CD44 的生物学效应开展深入研究。