外泌体miR-9-3p在非小细胞肺癌血清中表达及检测的临床意义
2022-03-11王琳娜李荣娟
肺癌是最常见的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌病例总数的80%以上
。早期诊断可显著改善预后,但大多数患者在首次诊断时已进展到中晚期,5年生存率相对较差
。因此寻找对NSCLC患者进行早期筛查和诊断方法一直是医学界研究的热点。目前肺癌的早期筛查主要依靠低剂量螺旋CT
,确诊的金标准为肿瘤组织活检病理组织学检查
,但低剂量螺旋CT对早期肺癌漏诊率较高,活检病理组织学作为有创检查不适合早期诊断;近年来常规肿瘤标志物检测一度作为早期肺癌筛查指标,但敏感性、特异性不尽如人意。
miRNA是内源性非编码小分子RNA,可用于调节细胞的增殖、分化和凋亡
。外泌体是纳米级囊泡,直径为30~100 nm,几乎所有类型的细胞都可分泌
。外泌体是miRNA运输的主要载体之一,可以存在于尿液、唾液、血浆或恶性分泌物中
。近年来,研究发现
miRNA在肿瘤的诊断、预后和治疗中发挥重要的作用,miRNA可能成为NSCLC的新型肿瘤标志物。miR-9-3p是新发现的miRNA之一,在肝癌、胃癌、胶质瘤患者中的表达明显下调
。在本研究中,对NSCLC患者和肺部良性病变受试者血清外泌体中miR-9-3p的表达进行了比较和分析,并讨论了NSCLC 血清外泌体中miR-9-3p联合癌胚抗原(CEA)、细胞角蛋白19片段抗原21-1(CYFRA21-1)检测诊断NSCLC的价值。
1 临床材料与方法
1.1 临 床 材 料 收 集2016 年1 月 至2017 年12 月在青岛大学附属医院经组织病理学确诊的80例NSCLC患者为研究对象。男42例,女38例;年龄39 ~82 岁,平 均 年 龄(52.63±13.18)岁;临 床 分期:Ⅰ期10例、Ⅱ期30例、Ⅲ期32例、Ⅳ期8例;组织学分类:肺腺癌44例、肺鳞癌36例。良性对照组50例包括肺结核、肺脓肿、良性肺结节等,男26 例,女24 例;年 龄38 ~79 岁,平 均 年 龄(53.64±14.32)岁。两组患者性别、年龄等基线资料比较差异无统计学意义(
>0.05),具有可比性。该研究取得医院伦理委员会的批准(医院伦理批准文号:Qdlyy201512097),所有受试者签署知情同意书。
1.2 选取标准 纳入标准:所有入选病例均经病理组织学确诊为NSCLC;均为原发性肺癌;血清样本收集之前,患者没有接受过化疗、放疗或其他抗肿瘤治疗;均有血清外泌体miR-9-3p、CEA、CYFRA21-1检查资料;研究所需资料齐全。排除标准:排除转移性肺癌;排除伴有其他部位恶性肿瘤者;排除严重肝、心、肾功能不全者。
1.3 方法 受试者清晨空腹时采集外周静脉血约5 mL,以1 500 g离心10 min,随后取上清在4 ℃下12 000 g离心10 min。2 h内用一份血清样本检测肿瘤标志物CEA、CYFRA21-1水平,第二份置于-80 ℃冰箱保存,直到提取总RNA。
本研究就女性免疫性不孕与慢性生殖道炎症及微量元素的关系进行探究与分析,结果显示,免疫性不孕的女性患者其阴道分泌物炎性因子(IL-6、IL-8及TNF-α)及血清铜均高于健康正常孕妇,血清硒及锌均低于健康正常孕妇,且不同分类与病程免疫性不孕者的阴道分泌物炎性因子及血清微量元素指标差异有统计学意义,Logistic分析显示,上述检测指标均与女性免疫性不孕有密切关系,进而肯定了上述指标与女性免疫性不孕的关系。其中慢性生殖道炎症导致的炎性细胞因子表达增强可较大程度反映生殖道的炎性损伤,微量元素对于子宫内膜及生殖系统其他方面的影响也较大程度存在,且对免疫的失调影响较大[17-19]。
提取外泌体之前需在室温下将血清样本进行解冻,随后取上清300 μL,加入外泌体提取试剂60 μL(美国Invitrogen
总外泌体分离试剂盒,货号4480025),在4 ℃孵育30 min,然后室温下以12 000 g离心10 min,最后使用100 μL PBS缓冲液重悬沉淀,得到血清外泌体。使用miRcute miRNA提取分离试剂盒(中国天根科技生化有限公司)从外泌体中提取miRNA。通过加尾法,使用Mir-X miRNA First-Strand合成试剂盒 (TaKaRa中国) 将提取的miRNA 逆转录为cDNA。采用TB-Green Premix ExTaq Ⅱ (TaKaRa中国) 试剂进行实时荧光定量PCR检测。使用U6基因作为内参基因,采用2
法计算miR-9-3p表达的相对定量。所有实验均重复3次。
混合装配生产线是指在一条生产线上,通过改变装配零部件的型号来生产不同种类的产品[1]。混装生产线一方面由于每个工位装配零部件的不同加大了工人操作的难度与强度;另一方面经常在流水线更换产品时发生错装、漏装等问题。而防错系统可以有效地减小上述错误的发生,提高产品的合格率[2]。
1.4 统计学方法 使用Graphpad Prism 8软件和SPSS 25.0软件进行统计学分析。符合正态分布的计量资料使用
检验,不符合正态分布的计量资料使用Mann-Whitney
检验;计数资料采用卡方检验;Spearman相关分析;通过绘制ROC曲线求取miR-9-3p诊断NSCLC的最佳临界值;以病理诊断为金标准,用四格表法统计计算miR-9-3p、CEA、CYFRA21-1单项及联合检测诊断NSCLC的价值。
<0.05表示差异有统计学意义。
2 结果
英文作为通用语言,在翻译成各国的文字时需要遵循每个国家的特点进行翻译,翻译时需要结合本国的文化特色,风土人情以及人们的惯用语,这样翻译出来的文章才能够被广大读者理解和接受。下面对翻译方法加以详细描述。
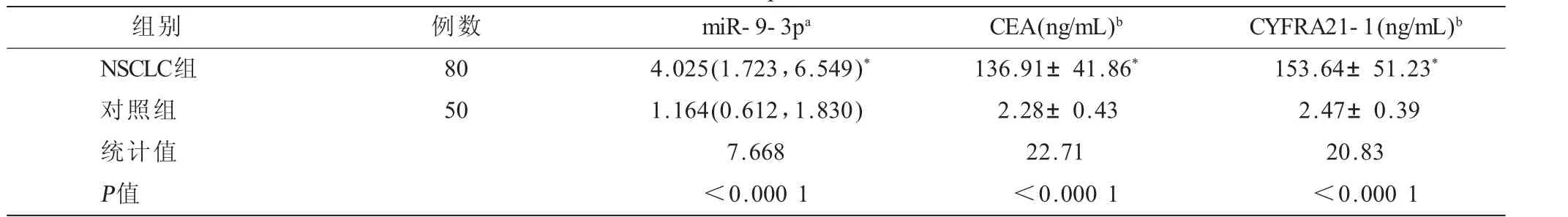
2.1 两组受试者血清外泌体miR-9-3p 及CEA、CYFRA21-1表达水平比较 NSCLC组血清外泌体miR-9-3p及CEA、CYFRA21-1表达水平明显高于良性对照组,差异有高度统计学意义(
<0.000 1),见表1。
2.2 NSCLC 血 清 外 泌 体miR-9-3p 与CEA、CYFRA21-1表达水平相关性分析 Spearman相关分析显示,NSCLC血清外泌体miR-9-3p 表达水平与CEA、CYFRA21-1 表达水平具有明显正相关(
=0.936、
=0.954,
<0.001、
<0.001),
<0.01。
小流域是河流水系中的基本集水单元,大流域生态治理的规划与实施,需要以小流域为基本治理单元。把大流域分解成不同层次、不同类型的小流域,这些小流域是一个个相对独立的生态系统,也是生态环境受到不同程度人为影响的一个个单元。从小流域存在问题出发,遵循正确的生态治理理念和做法,可以把这些小流域从生态环境退化的单元改造成为水—土—气—生各圈层良性循环、人类与环境和谐共存的单元。小单元的活动可以形成大系统的变化,同样,一个个小流域的生态修复将最终达成大流域整体生态系统的功能恢复与提升。
2.3 血清外泌体miR-9-3p联合CEA、CYFRA21-1诊断NSCLC 的价值比较 绘制血清外泌体miR-9-3p 诊 断NSCLC 的ROC 曲 线, 见 图1,miR-9-3p 诊断NSCLC曲线下面积 (ROC-AUC)为0.738,选取最大约登指数 (0.702) 对应的miR-9-3p 值作为诊断NSCLC 最佳临界值,为1.827。血清外泌体miR-9-3p、CEA、CYFRA21-1在NSCLC和对照组诊断结果与病理诊断结果对照,见表2。以病理诊断为金标准,血清外泌体miR-9-3p 联 合CEA、CYFRA21-1 诊 断NSCLC的 价值比较,见表3。三项联合检测诊断NSCLC的敏感性、准确性、阴性预测值与各单项检测比较明显提高,
<0.01。


3 讨论
肿瘤细胞释放的外泌体经常携带蛋白质、脂质和核酸,在局部和远处的受体细胞之间交换必要的信息
。由于外泌体可以在体液中很容易被获得,可以作为肿瘤“液体活检”潜在的生物标志物
。外泌体携带血液循环中的miRNA,其磷脂膜可以保护最上层的核糖核酸,不被核糖核酸酶降解,miRNA在外泌体中非常稳定
。miRNA是一类长度约为22个核苷酸的内源性、短单链非编码的RNA分子,与肿瘤进展、细胞分化、细胞凋亡或细胞信号传导密切相关,对真核生物基因转录后调控具有重要作用
。miRNA表达谱已被用于肿瘤诊断、分期和预测预后
。
许多研究表明,miR-9 在肿瘤中表达异常。miR-9在胰腺癌、肝癌以及鼻咽癌中抑制肿瘤细胞的增殖和侵袭
。在胶质瘤患者中,miR-9-3p通过靶向FOXG1抑制胶质瘤细胞的增殖和凋亡
。从骨髓间充质干细胞提取的外泌体miR-9通过下调内皮细胞特异性分子-1的表达抑制膀胱癌的进展
。miR-9在卵巢癌中表达上调可以降低E- 钙粘蛋白的表达从而促进肿瘤转移
。在本研究中,我们重点研究了miR-9-3p在NSCLC中的表达,结果表明与对照组相比,NSCLC患者中miR-9-3p的表达显著上调,表明miR-9-3p可能是NSCLC诊断的潜在生物标志物。本研究还做了NSCLC患者中miR-9-3p与常规标志物CEA、CYFRA21-1血清水平相关性分析,结果显示miR-9-3p表达水平与CEA、CYFRA21-1表达水平具有明显正相关性;血清miR-9-3p、CEA、CYFRA21-1三项联合检测诊断NSCLC的敏感性、准确性、阴性预测值与各单项检测比较明显提高,有利于临床早期诊断,减少误漏诊。
外泌体作为新一代诊断标志物,具有诸多优点,为多种疾病的诊断开辟了新的思路。本研究笔者只探讨了外泌体miR-9-3p在NSCLC血清中的表达水平,及联合常规标志物诊断NSCLC的价值,在后续工作中还要进一步深入研究血清miR-9-3p与不同临床病理因素(肿瘤大小、组织类型、临床分期、复发转移及预后)相关性,为NSCLC的诊疗提供依据。
[1] LAIS OSMANI ,FREDERIC ASKIN ,EDWARD GABRIEL SON,et al.Current WHO guidelines and the critical role of immunohistochemical markers in the subclassification of non-small cell lung carcinoma (NSCLC):Moving from targeted therapy to immunotherapy[J].Semin Cancer Biol,2018,52(10):103-109.
[2] REBECCA L SIEGEL,KIMBERLY D MILLER,AHMEDIN JEMA.Cancer statistics,2019 [J].CA Cancer J Clin,2019,69(1):7-34.
[3] 荆利民,李东,李振强,等.低剂量CT 联合血清肿瘤标志物诊断肺结节的临床价值[J].医学影像学杂志,2019,29(3):504-507.
[4] 牟金凤.纤支镜刷片病理细胞学和活检病理组织学在肺癌诊断中的临床意义[J].临床医药文献杂志,2018,5(24):75.
[5] KUAN-LI WU,YING-MING TSAI,CHI-TUN LIEN,et al.The Roles of MicroRNA in Lung Cancer[J].Int J Mol Sci,2019,20(7):1611.
[6] 郭梦玲,王熙才,陈艳.外泌体miRNA 与肺癌的发生发展[J].中国肿瘤生物治疗杂志,2020,27(4):457-462.
[7] RUI CHEN,XIN XU,ZIJUN QIAN,et al.The biological functions and clinical applications of exosomes in lung cancer[J].Cell Mol Life Sci,2019,76(23):4613-4633.
[8] GIOVANNI NIGITA,ROSARIO DISTEFANO,DARIOVENEZIANO,et al.Tissue and exosomal miRNA editing in Non-Small Cell Lung Cancer[J].Sci Rep,2018,8(1):10222.
[9] JIANWEN ZHEN,HENGXUN ZHANG,HONGZHI DONG,et al.miR-9-3p inhibits glioma cell proliferation and apoptosis by directly targeting FOXG1[J].Oncol Lett,2020,20(2):2007-2015.
[10] JIE TANG,YUN LI,KAI LIU,et al.Exosomal miR-9-3p suppresses HBGF-5 expression and is a functional biomarker in hepatocellular carcinoma[J].Minerva Med,2018,109(1):15-23.
[11] SHAOHUA CUI,ZHUOAN CHENG,WENXIN QIN,et al.Exosomes as a liquid biopsy for lung cancer[J].Lung Cancer,2018(116):46-54.
[12] YAN SUN,CHUNHUI HUO,ZHI QIAO,et al.Comparative Proteomic Analysis of Exosomes and Microvesicles in Human Saliva for Lung Cancer [J].J Proteome Res,2018,17 (3):1101-1107.
[13] SOOK SHIEN LEE,YOKE KQUEEN CHEAH.The Interplay between MicroRNAs and Cellular Components of Tumour Microenvironment ( TME ) on Non-Small-Cell Lung Cancer(NSCLC) Progression[J].J Immunol Res,2019(4):1-12.
[14] YUE-TING TANG,YI-YAO HUANG,JING-HUAN LI,et al.Alterations in exosomal miRNA profile upon epithelial-mesenchymal transition in human lung cancer cell lines[J].BMC Genomics,2018,19(1):802.
[15] XINA ZHANG,BUQING SAI,FAN WANG,et al.Hypoxic BMSC-derived exosomal miRNAs promote metastasis of lung cancer cells via STAT3-induced EMT[J].Mol Cancer,2019,18(1):40.
[16] JUAN WANG,BO WANG,HANQIANG REN,et al.miR-9-5p inhibits pancreatic cancer cell proliferation,invasion and glutamine metabolism by targeting GOT1[J].Biochem Biophys Res Commun,2019,509(1):241-248.
[17] YI HAN,YUBO LIU,XIRAO FU,et al.miR-9 inhibits the metastatic ability of hepatocellular carcinoma via targeting beta galactoside alpha-2,6-sialyltransferase 1[J].J Physiol Biochem,2018,74(3):491-501.
[18] 刘小柳,吴柏灯,张鑫,等.外泌体在胶质瘤微环境中的研究进展与应用[J].检验医学与临床,2021,18(14):2122-2125.
[19] HONGZHOU CAI ,XUEJIAN YANG,YANG GAO,et al.Exosomal MicroRNA-9-3p Secreted from BMSCs Downregulates ESM1 to Suppress the Development of Bladder Cancere[J].Mol Ther Nucleic Acids,2019(18):787-800.
[20] LI ZUO,XIAOLI LI,YUE TAN,et al.Prospective pathway signaling and prognostic values of MicroRNA-9 in ovarian cancer based on gene expression omnibus (GEO):a bioinformatics analysis[J].J Ovarian Res,2021,4(1):29.
