茶树原位转化方法的建立
2022-03-10周承哲常笑君朱晨程春振陈裕坤赖钟雄林玉玲郭玉琼
周承哲 常笑君 朱晨 程春振 陈裕坤 赖钟雄林玉玲 郭玉琼
(1. 福建农林大学园艺学院,福州 350002;2. 福建农林大学茶产业研究院/茶学福建省高校重点实验室,福州 350002;3. 福建农林大学园艺植物生物工程研究所,福州 350002)
茶树(Camellia sinensis(L.)O. Kuntze)系山茶科山茶属多年生常绿木本植物,其叶片常用于加工成世界上销量最大的无酒精饮料——茶[1]。茶因富含茶多酚、茶氨酸及咖啡碱等多种特征性次生代谢物,具有卓越的保健功效及优异的风味品质[2]。在茶树基础生物学研究中,特征次生代谢产物生物合成相关基因的调控机制是研究热点[3-5]。为精确研究与茶树优良性状相关基因的功能,提升突破性茶树新品种的选育效率,亟需建立一套高效、稳定的茶树遗传转化体系。
迄今,茶树基因功能验证大多依赖拟南芥和烟草等模式植物的异源表达系统[6-8]。然而,生物合成网络的复杂性和多样性,往往使得异源表达系统不适用于茶树特征基因功能鉴定。而茶树基因功能基础研究的缺失,也制约了生产上急需的突破性新品种定向选育。此外茶树具有童期长,优良性状难以早期鉴定等特点,导致依赖于系统选种和杂交育种的传统茶树育种手段效率低下[9]。2001年,Mondal等[10]首次建立了一种以茶树子叶为外植体诱导体胚发生的遗传转化体系,利用农杆菌介导法获得了转基因茶树。此后,陆续有基于组织培养成功在茶树本物种上实现转基因的案例[11-12]。
由于茶树体胚富含多酚类物质,且体胚的诱导、成熟和萌发时间较长,使得茶树组织培养过程中存在严重的褐化现象,且可重复性差。因此,现阶段依赖于组织培养的茶树转基因体系普遍实施周期长、转化率低,难以获得转基因植株[13-14]。1987年,Feldmann和Marks建立了一种直接利用农杆菌菌液浸泡萌发的拟南芥种子获得转基因植株的原位转化方法[15]。该方法具有不依赖于组织培养、操作简单、试验周期短及转化效率高等特点,已成功在 棉 花(Gossypium hirsutum)[16]、白 菜(Brassica campestris)[17]、番 茄(Solanum lycopersicum)[18]、沙 田 柚(Citrus maxima)[19]、伏 令 夏 橙(Citrus sinensis)[20]及龙眼(Dimocarpus longan)[21]等园艺植物上取得应用,为建立高效稳定的茶树遗传转化体系提供新的思路。
本研究以去顶芽和腋芽的茶树实生幼苗为转化受体,利用根癌农杆菌侵染茶苗伤口,经抗性筛选获得阳性茶树转基因植株。该茶树原位转化方法将为茶树基因功能研究和种质创新奠定坚实的基础。
1 材料与方法
1.1 材料
成熟健康的‘铁观音’、‘白叶1号’和‘龙井43’茶树实生幼苗来自福建农林大学南区茶山试验基地。
根癌农杆菌(EHA105)和pCAMBIA1301质粒均由福建农林大学园艺植物生物工程研究所保存[22]。
1.2 方法
1.2.1 茶树实生幼苗去顶芽和腋芽处理 用单蒸水清洗成熟健康的‘铁观音’、‘白叶1号’和‘龙井43’茶树种子,直播于含有营养土(珍珠岩∶蛭石∶泥炭土=1∶1∶2)的塑料花盆中,置于光照培养箱25℃暗培养至含有4片真叶的茶树幼苗,然后用消毒的切片刀切除顶芽和腋芽,保留真叶备用。
1.2.2 根癌农杆菌侵染液的制备 将根癌农杆菌菌液(携带pCAMBIA1301质粒)加入25 mL YEB(Yeast Extract Mannitol Broth)液体培养基(含有50 mg/L Kan和50 mg/L HYG)中,于恒温摇床培养箱(28℃、转速200 r/min)中暗培养。利用紫外分光光度计测定农杆菌菌液浓度,当OD600值达0.6-0.8时,使用高速离心机(转速4 000 r/min,离心5 min)收集菌体。利用25 mL的MS(Murashige and Skoog)液体培养基(含10 mmol/L的MgCl2和100 μmol/L的AS)重悬收集获得的菌体,于28℃振荡培养,测定菌液OD600值至0.6-0.8时,用于后续侵染茶树实生苗。
1.2.3 农杆菌侵染茶树幼苗及共培养 用封口膜在切口周围缠成漏斗状,吸取根癌农杆菌菌液注入漏斗状封口膜,以侵染切口。侵染40 min后,弃盛有菌液的漏斗状封口膜。为防止切口失水,立即用封口膜封住切口保湿,置于培养箱中于28℃暗培养2 d。利用双蒸水以相同的方法侵染茶树幼苗作为阴性对照。
1.2.4 抗性芽筛选 打开覆盖切口的封口膜,用蘸有60 mg/L的HYG溶液的棉签擦拭切口处2次,并留下一滴HYG溶液后,重新用封口膜封住切口,于25℃培养箱中暗培养。当切口处长出抗性芽后再补光继续培养至2-3片真叶,用于后续鉴定。
1.2.5 再生抗性芽的分子生物学鉴定 分别取0.1g抗性芽及未转化的再生植株叶片,采用改良后的CTAB法提取茶树基因组DNA[23]。以抗性芽gDNA为模板,利用GUS标记基因引物和HYG标记基因引物(表1)进行PCR检测验证。参考陈裕坤等[21]建立的PCR反应体系。以未转化的再生植株gDNA为模板作为阴性对照。参照Zhou等[24]的基因克隆方法,将抗性芽扩增产物进行胶回收、连接转化后委托铂尚生物技术(福州)有限公司测序。
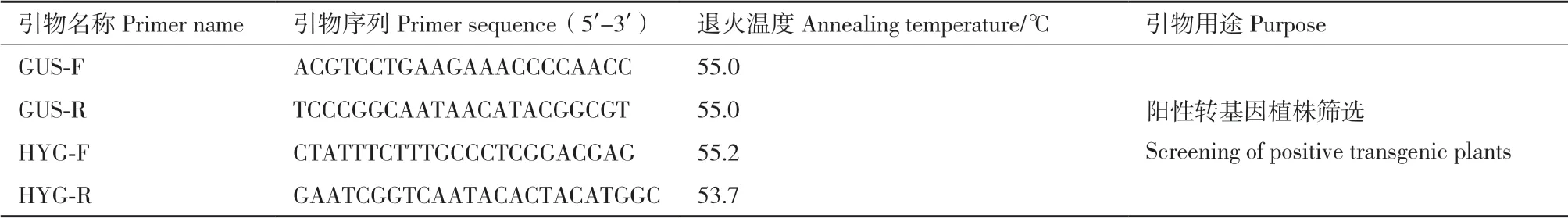
表1 引物序列信息Table 1 Primer sequenle information
1.2.6 阳性再生抗性芽扦插 当抗性芽长至10 cm左右,木质化程度约2/3时,用以扦插。剪取长度约3 cm带有一片成熟叶和一个饱满腋芽的穂条,确保剪口平滑,与母叶呈平行的斜面。为提高插穗的成活率,将剪口浸在62.5 g/L的生根粉溶液中1min,然后斜插于被水浸润的穴盘营养土中,深度为穗条长度的2/3至叶柄与土层表面平齐。边扦插边将插穗附近的土稍压实,扦插后立即浇水,置于25℃温室中暗培养。
1.2.7 转基因植株回收处理 对转基因过程中所使用的各类材料包括穴盘、封口膜、镊子、侵染液和营养土等进行回收与灭菌处理,防止转化的质粒向环境释放。
2 结果
2.1 茶树抗性芽再生
约3周龄茶树实生幼苗长至含有4片真叶,且尚未木质化时可进行去顶芽和腋芽处理,利用根癌农杆菌菌液侵染伤口,共培养2 d后,即利用HYG进行抗性筛选,最终抗性芽再生率超过90%,共获得299个抗性芽(图1)。暗培养2-3周后,所有抗性芽均从茶苗腋芽的伤口处再生,且每株都只能长出一个抗性芽,去顶芽的伤口处无一长出再生芽。当植株长出抗性芽之后,再对茶苗进行光照培养。约2-3周后,抗性芽逐渐长大,当拥有2-3片叶时,可对其进行阳性鉴定。
2.2 转基因茶树再生芽阳性鉴定
获得的299个抗性芽中,‘铁观音’、‘白叶1号’和‘龙井43’再生芽分别为86、134和79个,分别取所有再生芽的叶片0.1 g用以提取gDNA后进行分子生物学鉴定。结果表明,不同茶树品种转化率有所不同,‘铁观音’转化率最高,达到8.14%(7/86);‘白叶1号’次之,转化率为2.99%(4/134);‘龙井43’的转化率最低,为2.53%(2/79)。所有阳性再生芽中,GUS和HYG标记基因经多次PCR检测仍为阳性(图2),且PCR扩增产物测序结果与GUS和HYG片段序列一致,表明PCR检测结果可信度高。
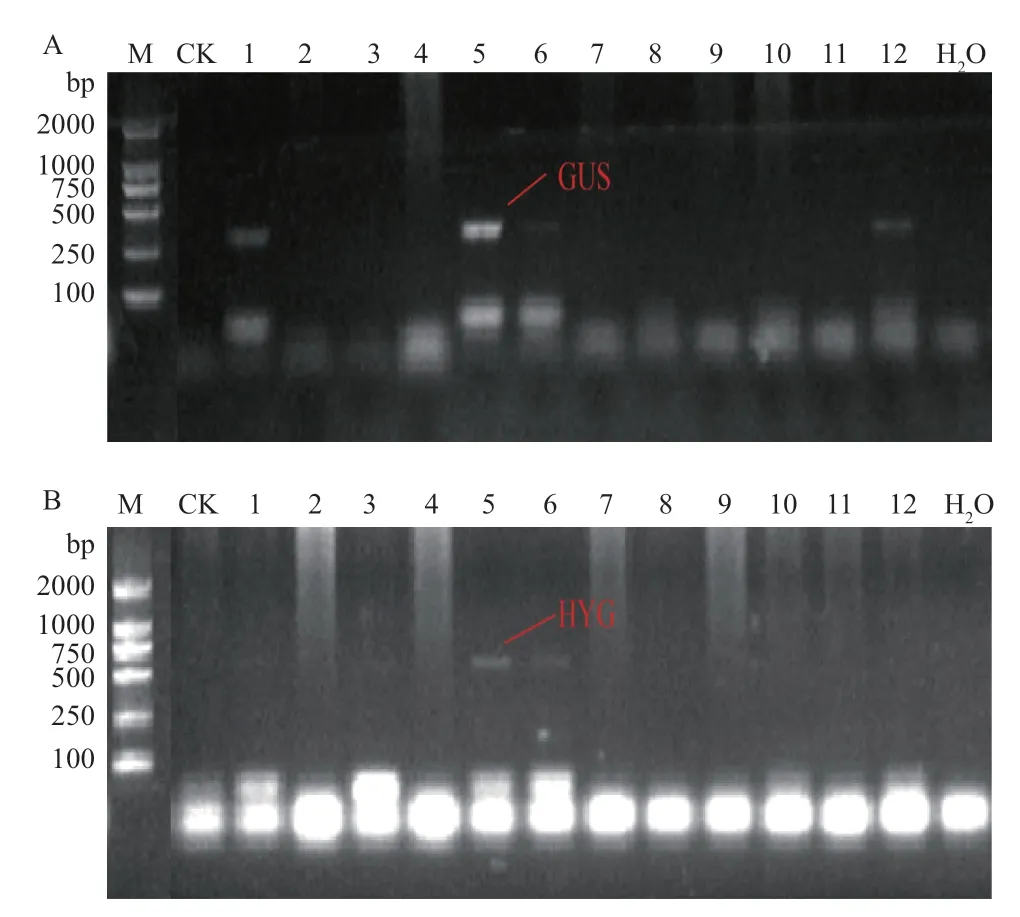
图2 转基因植株的标记基因检测Fig. 2 Detection of marker genes in the transgenic plants
2.3 转基因植株扦插
当再生芽长至10 cm左右,且有2/3木质化时,即可剪取穂条进行短穗扦插(图1-I,J),扦插后的转基因插穗的生长和发育状况正常,能长出新芽。插条生长过程中,又对其进行多次标记基因的PCR鉴定,结果依旧为阳性,表明利用茶树原位转化获得阳性再生芽后,可通过扦插方式快速获得茶树转基因植株。

图1 茶树转基因植株的获得Fig. 1 Process of obtaining transgenic tea plants
3 讨论
迄今,茶树基因功能研究主要通过体外试验或依赖于拟南芥、烟草等模式植物的异源表达系统进行验证[25]。然而,生物合成网络具有复杂性、多样性及特异性。例如,茶树富含儿茶素、茶氨酸及咖啡碱等多种特异代谢物[1],在拟南芥或烟草体内往往缺乏相关合成底物,使得异源表达系统不适用于茶树特征基因功能鉴定及调控关系研究。与模式植物相比,茶树基础分子理论的研究相对薄弱,这也制约了突破性茶树新品种定向选育。针对以上问题,Zhou等[26]建立了一种高效、简便的茶树叶肉细胞原生质体提取方法,可广泛应用于茶树特征次生代谢物合成调控基因的瞬时表达研究。然而,茶树仍旧缺乏一套高效稳定的永久转化体系。
目前,茶树转基因主要通过依赖组织培养的农杆菌介导法,但大量研究发现茶树体内富含抑菌性多酚类物质是建立高效、稳定茶树遗传转化体系的主要障碍[11-12,27-28]。一方面,茶树组织培养过程中,外植体组织会释放大量酚类物质,进而聚合成暗黑色的大分子化合物,导致外植体产生严重褐化,影响再生植株诱导[29];另一方面茶多酚具有强力的抗菌作用,在转化过程中会抑制农杆菌活性,进而影响转化率[30]。此外,茶树组织培养诱导体胚难度较大、体胚成熟和萌发所需时间较长,也严重影响了转基因效率[11]。综上,现有的茶树转基因体系仍旧无法突破转化效率低,再生能力差的瓶颈。本研究建立的茶树原位转化方法无需准备茶树无菌试管苗,无需诱导胚状体,无需继代转接抗性芽,与现有的茶树转基因技术相比,具有操作步骤简便,实施成本低,试验周期短等优点。
茶树原位转化具体实施过程中,抗性芽再生率是农杆菌介导的原位转化能否成功的关键因素。本研究利用可拉伸的封口膜,在茶树切口处缠绕成漏斗形后进行农杆菌侵染,可使菌液既不外漏又可与伤口充分接触,提高了转化效率。在共培养阶段,维持植株被侵染伤口的湿度对抗性芽再生至关重要[31]。在沙田柚的原位转化研究中发现,伤口被封口膜包裹的幼苗能比伤口没有被包裹的幼苗再生更多的抗性芽[19]。其次,农杆菌侵染植株伤口后进行暗培养也是促进抗性芽再生的重要措施,研究表明暗培养有助于柑橘转基因抗性芽再生[31-32]。因此,本研究利用封口膜包裹经HYG筛选后的茶树幼苗伤口同样可起到保湿的效果,并且在共培养之初,同样采用暗培养,在此基础上茶树抗性芽再生率可达到90%以上。待到长出再生芽之后再进行光照培养可加快再生芽的生长速度。此外,本研究发现茶树抗性芽只能从去腋芽的伤口处再生,推测是由于去腋芽的伤口处生长代谢旺盛,芽的再分化能力强,容易诱导不定芽。因此,对去腋芽处的伤口进行侵染有利于提高转化率。
扦插是利用植物“细胞的全能性”进行快速无性繁殖的方法,也是现阶段茶树育苗的主要手段,具有繁殖系数大,发根成苗快的优点[33]。建立原位转化方法获得转基因再生芽后,通过短穗扦插可获得生长和发育状况正常的扦插苗,因此,每一个阳性的再生芽即为一个转基因株系,与依赖组培的传统转基因方法相比,大大加速了获得转基因植株的周期。综上所述,本研究建立的茶树原位转化方法为茶树基因功能研究和种质创新奠定坚实的基础。
4 结论
本研究针对茶树缺乏高效、稳定的遗传转化体系问题,建立了一种不依赖组织培养的茶树原位转化转基因方法。经过抗性筛选,成功获得转基因再生芽。‘铁观音’、‘白叶1号’和‘龙井43’的转化率分别为8.14%、2.99%和2.53%。剪取转基因再生芽进行短穗扦插,插穗的生长和发育状况正常,可成功获得茶树转基因植株。
