赤霉素代谢调控与绿色革命
2022-03-10李毅丹单晓辉
李毅丹 单晓辉
(1. 吉林省农业科学院农业生物技术研究所/吉林省农业生物技术重点实验室,长春 130033;2. 吉林大学植物科学学院,长春 130062)
赤霉素(gibberellins,GAs)作为重要的植物激素,其发现和研究的历程始终与农业生产密切相关。20世纪30年代,第一种GA是在导致水稻茎秆过度伸长的致病性真菌(藤仓赤霉Gibberella fujikuroi)代谢物中被发现。自此之后,研究者相继在植物和真菌中鉴定出了136种GAs,均为二萜类化合物[1]。其中,只有少量的GAs具有内在的生物活性,控制着植物生长发育(包括种子萌发、茎伸长、叶膨大、花和种子发育等)的各个方面[2]。这些具有生物活性的GAs包括GA1、GA3、GA4和GA7[1,3-5],它们与生长素、细胞分裂素、脱落酸、乙烯和油菜素甾醇被并称为六类植物激素。其他GAs则是生物活性GAs的生物合成前体、失活产物和代谢副产物。
生物活性GAs是通过复杂的生物合成和信号传导途径来控制生长和发育的。随着生化、遗传和基因组等研究手段的丰富,大多数编码GAs生物合成和失活酶的基因以及信号传导途径中重要蛋白的基因正逐一被鉴定出来。这些基因的鉴定有助于了解GAs代谢的调控机制[6]。影响GAs生物合成或信号传导的一些重要基因在农业生产中也得到了广泛的应用。其中,半矮化等位基因的引入显著提高了高施氮条件下谷物的可收获产量,是20世纪作物育种领域的重大成果,为“绿色革命”的实现作出了巨大贡献。最具有代表性的就是国际水稻研究所(International Rice Research Institute,IRRI)和国际小麦玉米改良中心(International Maize and Wheat Improvement Center,CIMMYT)先后推出的半矮化高产水稻品种和半矮化高产小麦品种[7-9]。
“绿色革命”是1968年3月美国国际开发署署长W·S·高达在华盛顿举行的国际开发学会年会上发表的以“绿色革命:成就与担忧”为标题的演说中首次提出的[10]。“绿色革命”一词虽已被普遍应用,但并没有形成准确的概念。一般情况下,“绿色革命”是指20世纪60-70年代世界各地谷物单产大幅增加的这一过程[7-8,11-13]。“绿色革命”的实现主要依赖于两方面进步:一是高产、稳产、广适的谷物品种育成;二是包括化肥、农药、灌溉、耕作等在内的农业技术革新[14-16]。本文将着重围绕“绿色革命”中涉及的代表性品种,系统介绍优良性状形成的赤霉素代谢调控机制。同时,综合赤霉素代谢调控研究的新发现和现代生物技术的新发展,提出后“绿色革命”时期赤霉素代谢调控在作物遗传改良中应用的方向和亟待解决的问题。
1 赤霉素代谢调控概览
GAs是由牻牛儿基牻牛儿基焦磷酸(geranylgeranyl pyrophosphat,GGPP)为前体物质,经过一系列复杂的生化过程,最终合成的二萜类化合物[1-5](图1)。这一过程主要依赖于3种不同类型酶的催化,包括萜烯合成酶(terpene synthases,TPSs)、细胞色素P450单加氧酶(cytochrome P450 monooxygenases,P450s)和2-酮戊二酸依赖性双加氧酶(2-oxoglutarate-dependent dioxygenases,2ODDs)。2个TPSs:ent-copalyl二磷酸合酶(ent-copalyl diphosphate synthase,CPS)和ent-kaurene合酶(ent-kaurene synthase,KS)在质体中催化了GGPP向四环烃中间体ent-kaurene的转化过程[17-18];然后,通过2个P450s:ent-kaurene氧化酶(ent-kaurene oxidase,KO)和ent-kaurenoic酸氧化酶(ent-kaurenoic acid oxidase,KAO),在 内 质 网 上 将ent-kaurene转 换为GA12[17,19];随后GA12通过GA13-氧化酶(GA 13-oxidase,GA13ox)的 催 化 生 成GA53,GA12和GA53分别在GA20-氧化酶(GA 20-oxidase,GA20ox)和GA3-氧化酶(GA 3-oxidase,GA3ox)的多步催化下,最终转化为具有生物活性的GAs[20-24]。另外,在赤霉素的生物合成过程中,还发现了一系列导致赤霉素失活的酶,对于有效调节植物中生物活性GAs的浓度具有重要意义。其中,最重要的失活反应是由2ODDs类的GA2-氧化酶(GA 2-oxidase,GA2oxs)催化[25-27]。新近研究发现P450s类的CYP714D1能够催化GA4、GA9和GA12的降解[19,28],而甲基转移酶(methyltransferases,MT)类的赤霉素甲基转移酶(gibberellin methyltransferases,GAMT)也具有可能引发赤霉素失活的作用[29]。
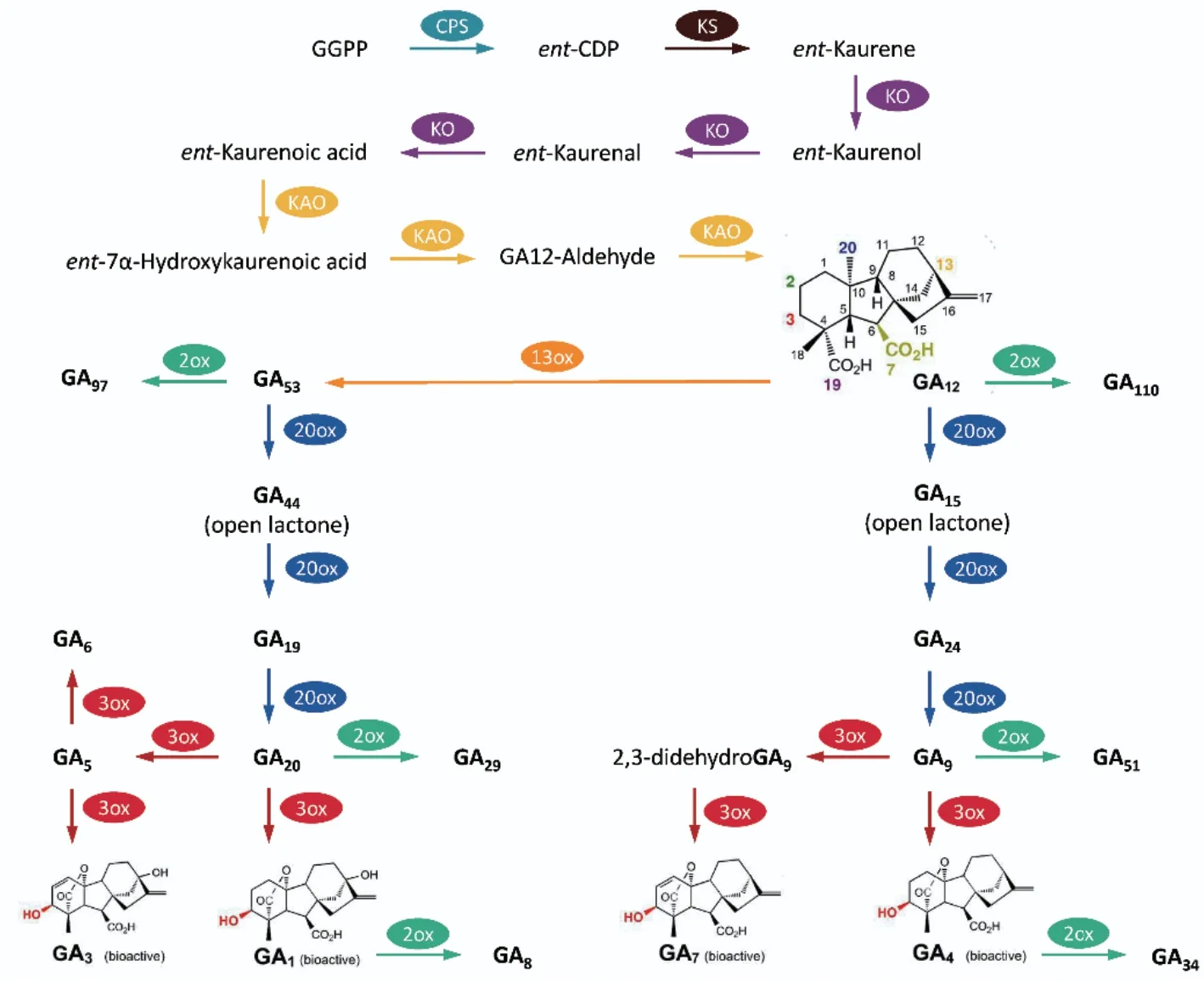
图1 植物中赤霉素的生物合成途径示意图Fig. 1 Gibberellin biosynthesis pathways in plants
生化、遗传和结构分析表明,具有生物活性的GAs是通过GA-GID1-DELLA信号传导模块发挥其生物学功能。具有生物活性的GAs与受体GIBBERELLIN INSENSITIVE DWARF1(GID1) 结合,诱导GID1的构象变化,并募集生长阻遏物DELLA蛋白以形成GA-GID1-DELLA复合物。随后,DELLA被泛素化进而被蛋白酶体降解[1,4,30-31](图2)。大量研究还证实其他激素信号和环境条件的变化也是通过影响赤霉素代谢基因的表达,从而影响GAs含量和DELLA水平,与GA-GID1-DELLA调控模块相互作用,进而实现表型或生理生化方面的改变[32-38]。作为重要的功能蛋白,DELLA可通过蛋白质-蛋白质相互作用,与众多代谢通路形成互联网络,发挥重要的调节作用[31,36,39-41]。
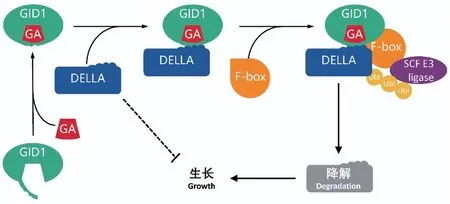
图 2 GA-GID1-DELLA信号传导途径示意图Fig. 2 Sketch of GA-GID1-DELLAsignal transduction
随着赤霉素代谢调控相关基因的相继鉴定,不仅从赤霉素代谢调控层面为众多成功的农作物遗传改良给予了机制解析,还为认知植物中存在的多种赤霉素调控机制提供了更清晰的试验证据,也逐渐为利用赤霉素调控对农作物进行精准的遗传改良奠定了坚实的理论基础。
2 小麦“绿色革命”基因REDUCED HEIGHT-1(Rht-1)
在单纯依赖经验育种的时代,增加小麦高度就可以增加产量。相关研究也证实了小麦株高与产量呈正相关性[42-44]。然而,20世纪20年代后,随着氮肥的广泛使用,导致传统小麦品种突长、倒伏严重,亟需降低作物高度。至20世纪60年代,通过引入REDUCED HEIGHT-1(Rht-1)同源的半矮化系列等位基因,作物总高度降低了12%-20%[45]。这些等位基因的引入不但成功地解决了倒伏问题,同时还显著提高了产量,株高与产量之间的一般正相关性被打破。由于半矮化性状能够与更高的施肥率、更广泛的农药使用和更大规模的机械化相结合,在接下来的几十年里Rht-1等位基因为全球小麦产量的增长作出了重大贡献,并几乎成为了“绿色革命”的同义词。CIMMYT的Norman Borlaug也因其在半矮化小麦品种培育和推广中发挥的重要作用,获得了1970年的诺贝尔和平奖。目前,在美国新培育的小麦品种中仍有超过90%的含有Rht-1等位基因[46]。
对Rht-1等位基因的研究自“绿色革命”开始一直延续至今。最早的研究发现,在含有Rht-1等位基因的半矮化材料中,生物活性GAs水平较高[47],并且对外施GAs也不敏感[48],初步说明该基因不影响GAs的生物合成,而是与信号传导相关。1999年,首次克隆获得小麦的Rht-1,并证明其属于DELLA蛋白类。结构分析发现Rht-1等位基因是由于在DELLA结构域中发生了突变,导致小麦对GAs的敏感性降低,产生半矮化表型[8](图3)。直到2011年,Pearce等[49]才利用酵母双杂交技术在体外首次确认了Rht-1和GID1之间的相互作用。不仅证实了Rht-1是通过GA-GID1-DELLA信号途径发挥生物学功能,还确认了Rht-B1b、Rht-D1b、Rht-B1e、Rht-B1c、Rht-D1c、Rht-B1d等一系列Rht-1等位基因会导致产生不同的株高表型[49-51],但其中的具体调控机制仍有待进一步解析。
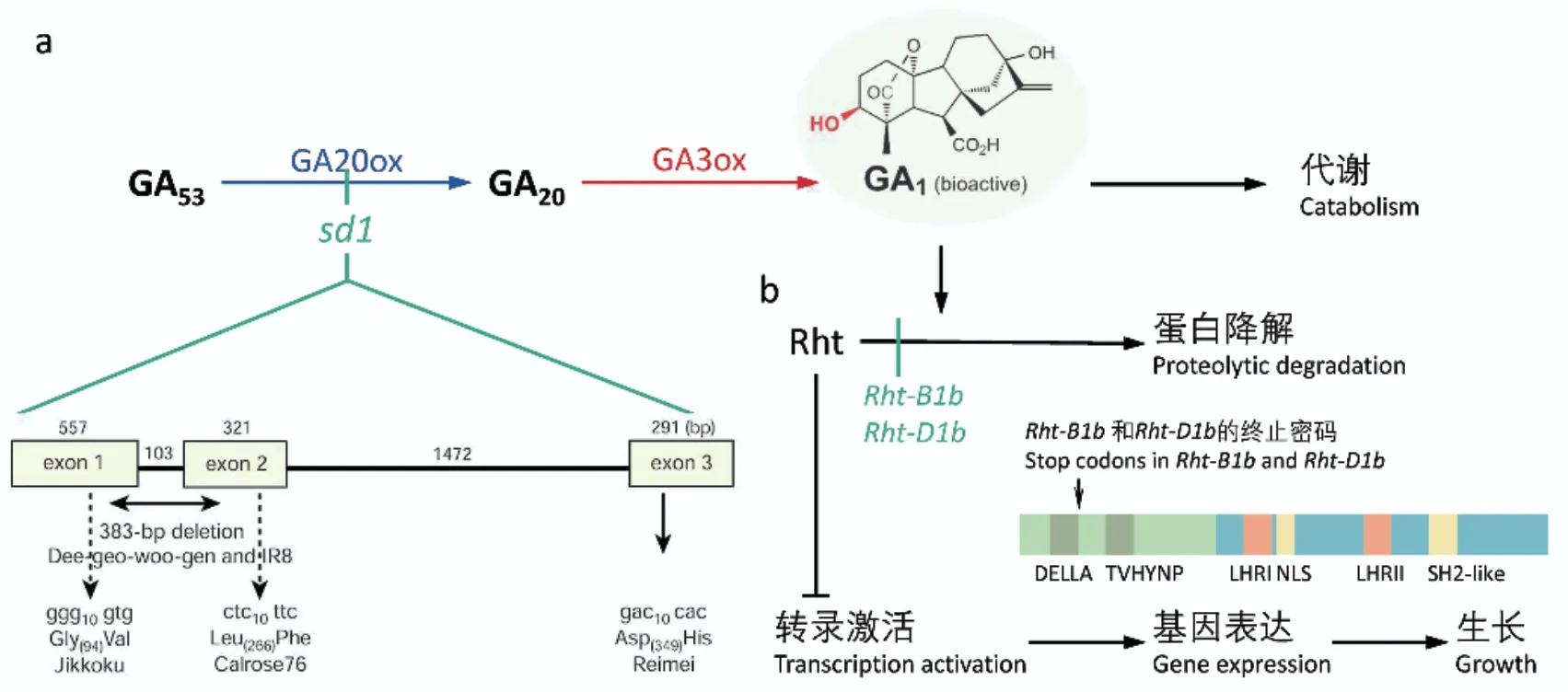
图3 赤霉素合成和信号传导途径中的“绿色革命”基因Fig.3 Green Revolution genes in gibberellin biosynthesis and signal transduction
3 水稻“绿色革命”基因semidwarf-1(sd-1)
与小麦相比,半矮秆水稻对全球谷物产量的影响更为显著。20世纪60年代,半矮化水稻品种在亚洲地区的广泛推广,导致水稻产量在几年内翻了一番,直接促成了“绿色革命”在亚洲地区的兴起。水稻的“绿色革命”被证实是由于从韩国水稻品种Deo-Geo-Woo-Gen(DGWG)中引入了一个主要的隐性半矮化基因。美国利用γ辐照在粳稻中也创制出了类似的半矮化系Calrose76,并将半矮化基因定名为semidwarf-1(sd-1),该基因与DGWG中的半矮化基因是等位基因[52]。
研究发现源自DGWG的隐性半矮化等位基因导致了水稻中GA20ox初始底物GA53的积累[9,53-54],表明水稻中的半矮杆表型是由于GA20ox活性降低造成的。进一步分析发现编码GA20ox的OsGA20ox2与sd-1位点密切相关,所有sd-1半矮化系均是由于OsGA20ox2发生了突变。来自DGWG的sd-1等位基因有一个383 bp的缺失,而其他独立的sd-1等位基因也均是编码区发生了错义突变[9,54](图3)。以上结果表明,水稻的sd-1位点编码的是负责调控赤霉素生物合成的OsGA20ox2,这使得对水稻sd-1等位基因的发掘和利用成为水稻株型改良的一个重要研究方向。
4 赤霉素代谢调控为“绿色革命”的新贡献
回顾“绿色革命”的历程,半矮化水稻和小麦品种的培育及推广对“绿色革命”起到了决定性的作用。赤霉素缺乏的品种既表现出植株半矮化,又具有更多的分蘖或分支数,不但增强了抗倒伏能力,还提升了收获指数[55]。然而,赤霉素也会抑制作物对氮的吸收和利用[56],造成必须大量使用氮肥才能保证“绿色革命”品种的高产稳产。进入21世纪,为保证农业可持续发展,开发氮高效利用的新“绿色革命”品种成为了新的目标。赤霉素代谢调控与植物的氮利用存在着密切的联系,但具体的机制尚不清晰[57-58]。2018年和2020年,Li等[56]和Wu等[59]分别发现了水稻中GROWTH-REGULATING FACTOR 4(GRF4)和NITROGENMEDIATED TILLER GROWTH RESPONSE 5(NGR5)2个重要的氮高效利用相关基因,解析了赤霉素代谢如何参与氮代谢。其中GRF4是促进和整合氮同化、固碳和植物生长的转录因子,通过与GIF1(GRF-interacting factor 1)的相互作用发挥其生物学功能。但GRF4-GIF1的相互作用会受到DELLA的抑制(图4)。因此,调控GRF4和DELLA的平衡可在确保籽粒产量的同时,有效提高“绿色革命”品种的氮素利用效率[56,60]。水稻转录因子NGR5可促进氮依赖的PRC2(polycomb repressive complex 2)的募集,通过对组蛋白甲基化状态的改变,阻断了抑制分蘖基因的表达,进而促进分蘖。但NGR5还能够被GA-GID1复合体结合并降解,导致其无法发挥促进分蘖的生物学功能。研究发现DELLA蛋白的积累能够竞争性地抑制GAGID1与NGR5相互作用(图5)。这一发现不但解释了“绿色革命”品种的分蘖增加的机理,而且证实了提高NGR5表达量不仅可提高水稻氮肥利用效率,而且还可保持其优良的半矮化和高产特性,使水稻在适量减少施氮条件下获得更高的产量[59]。这些研究成果不仅丰富了对于赤霉素作用机理的认识,而且从分子水平揭示了“绿色革命”半矮化品种在高氮条件下增产的原因。也为“少投入、多产出、保护环境”的绿色高产高效农作物分子设计育种奠定了理论基础。赤霉素代谢调控再一次为“绿色革命”作出了新贡献。
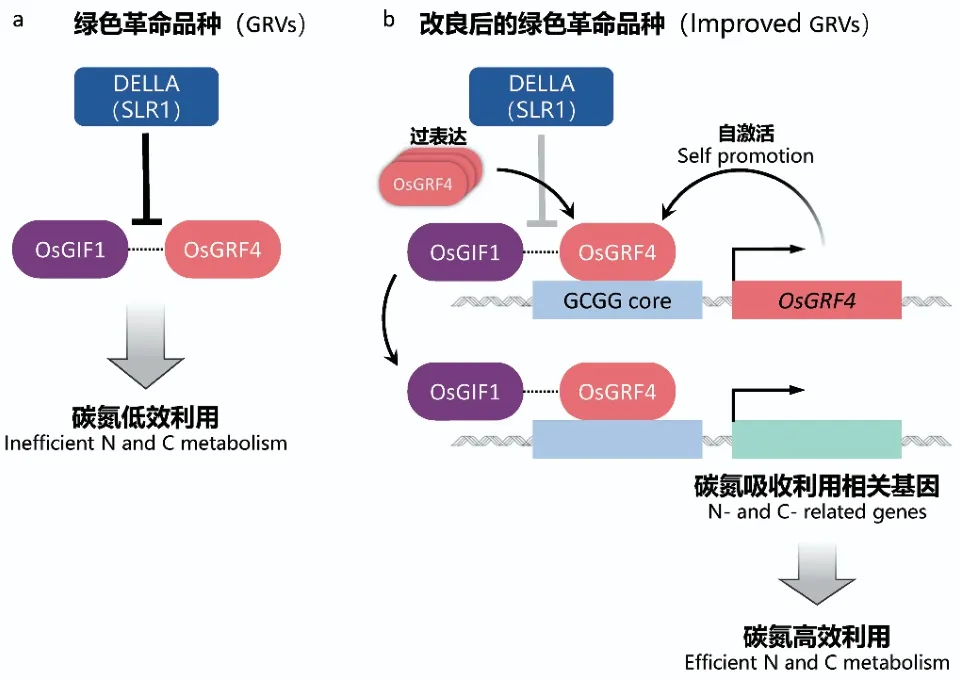
图4 GRF4提高水稻中碳氮代谢效率Fig. 4 GRF4 increases the efficiency of nitrogen and carbon metabolism in rice
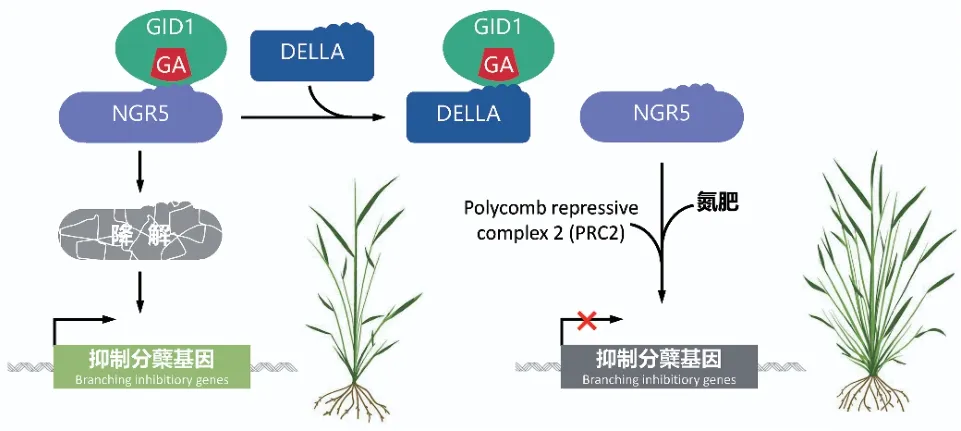
图5 NGR5基因影响水稻分蘖数量的调控机理Fig. 5 Mechanism of NGR5 regulating rice tillering
5 赤霉素代谢调控与“绿色革命”品种的广适性
赤霉素代谢调控与植物广适性密切相关,主要通过关键酶基因的转录和表达变化完成的。作为主要负责GAs降解的GA2ox类酶,在影响植物适应性中发挥了重要的作用。GA2ox类基因参与影响植物适应性的研究最早始于拟南芥。AtGA2ox3、AtGA2ox6和AtGA2ox7等参与了耐受盐、旱、冷的胁迫响应[61-65]。GA2ox类基因参与非生物胁迫响应与APETALA2/ETHYLENE RESPONSE FACTOR(AP2/ERF)类转录因子密切相关。例如盐胁迫下拟南芥中DDF1(DWARF AND DELAYED FLOWERING1)和DDF2能够直接激活GA2ox7从而导致生物活性GA水平下降,进而促进DELLA类抑制蛋白RGL3(RGA-like 3)的表达;冷胁迫下CBF1(DREB1B)的过表达则会通过激活GA2ox3和GA2ox6的表达来降低活性GA的含量;而渗透胁迫诱导的ERF5和ERF6的表达会引起GA2ox6的上调表达从而影响GA的合成(图6)。在病原菌侵染条件下,茉莉酸(jasmonic acid,JA)介导的JAZ(JASMONATE ZIMDOMAIN)蛋白降解会解除其对DELLAs和MYC(myelocytomatosis proteins)转录因子的抑制。MYC2同时也会促进DELLA的表达(图6)。此后,水稻中的多个GA2ox类基因也参与了多种生物和非生物胁迫的响应过程[66-70]。
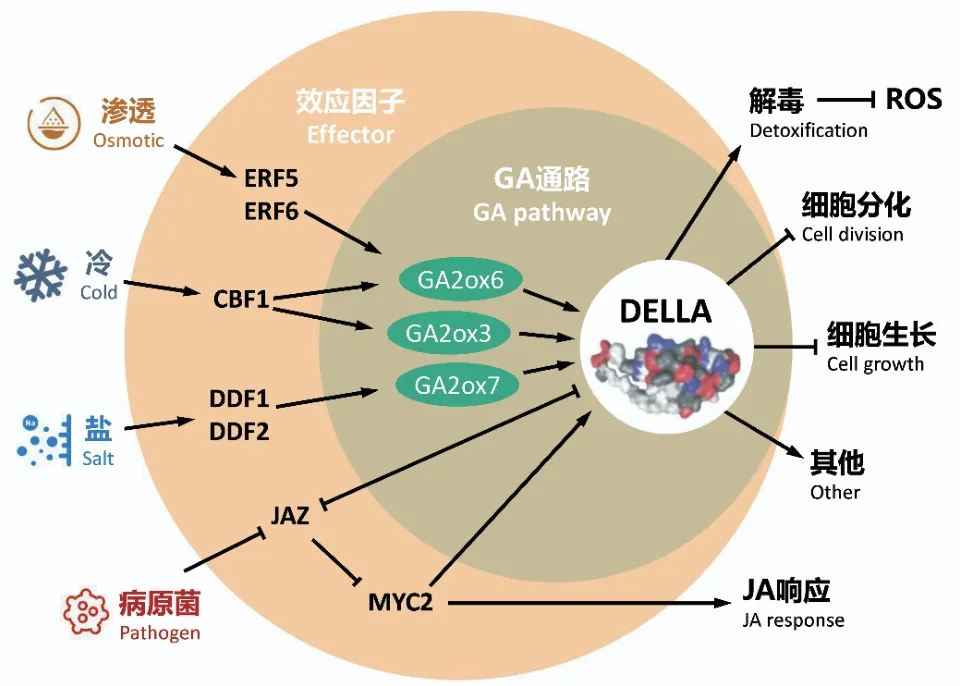
图6 赤霉素参与不同胁迫响应的示意图Fig.e 6 A simplified model for the role of GAs in stress response
在对野生二粒小麦[71]、面包果[72]、杨树[73]、水稻[68]、玉米[74]、番茄[75]等植物的研究中,发现以GA2ox类基因为代表的赤霉素代谢调控相关基因对植物干旱胁迫响应也具有较强的规律性。多数GA2ox类基因干旱胁迫下在根中表达下调,而GID1表达上调,在叶片中,GA2ox和GID1的表达模式则与根中相反。因此,推测植物的不同部位中借助GAs调控耐旱响应可能存在不同的机制。在根中GA2ox类基因下调表达导致根中GAs降解减弱,从而GAs含量上升;同时,GID1表达上调,导致植物体内的GA-GID1复合体增加,使其对DELLAs的降解诱导作用增强,从而减弱DELLAs对生长的抑制作用,进而促进根的伸长以获得更多的水分。而叶片中GA2ox类基因上调和GID1的表达下调则导致GA-GID1复合体减少,DELLAs的降解减弱,对生长的抑制作用增强,减少水分的消耗。因此,根据环境条件的变化,通过调节GAs水平使其达到最佳生长速率,可能是植物中普遍存在的主动适应机制[38]。因此,赤霉素信号通路是进一步拓宽作物广适性、提高作物产量的主要研究目标之一。随着相关研究的深入和生物技术的不断发展和完善,通过合理的遗传改良,赤霉素代谢调控相关基因有望在拓展作物品种的广适性上继续发挥重要的作用。
6 “绿色革命”基因的应用
随着技术的进步,越来越多的科研人员开始利用生物学手段对作物进行遗传改良。基于赤霉素代谢调控的相关理论研究成果培育新型的“绿色革命”品种,已成为一个主要研究方向。
在作物株高改良方面,小麦中系列Rht等位基因的发现和应用,创制出一批半矮化小麦品种[76-77];水稻中利用EMS诱变和RNAi等技术,也获得了许多sd-1突变体,培育出一系列半矮化水稻品种[78-79]。2019年,钱前院士课题组通过对sd-1进行基因编辑,成功的降低了优良水稻品种卡萨拉斯和特特普的株高,在保持材料原有理想农艺特性的基础上,提高了这两个品种的抗倒伏性[80]。2020年,吉林省农业科学院农业生物技术研究所对玉米中sd-1同源基因ZmGA20ox2进行了基因编辑,也成功的获得了抗倒伏性状突出的半矮化的玉米材料。
在提高作物广适性方面,研究者也通过对赤霉素调控的遗传改良进行了非常多的尝试。最有代表性的成果是通过在水稻中表达一些OsGA2ox6突变体,实现了适度降低GAs水平的效果。导致水稻株高降低,分蘖增加,根系扩张,水分利用效率和光合作用速率提高,非生物和生物胁迫耐受性增强。这些有益性状的组合不仅使得后代材料具有广泛的抗逆性和抗病性,而且产量也提高了10%-30%[67]。这一成果有力的支持了通过精细调控GAs水平提高作物广适性这一设想的可行性。这些结果表明,以“绿色革命”基因的研究成果为基础,结合现代生物技术进行育种改良,是丰富作物品种遗传多样性的有效途径。
7 总结与展望
虽然植物中的赤霉素合成及信号传导的代谢调控通路已经基本构画完成,但仍有大量的问题需要解决:(1)GAs合成相关的2ODD基因家族成员众多,且存在着明显的时空表达特异性。要对这些基因进行利用,有必要对其中的调控机理进行深入研究。(2)对GAs失活途径中GA2ox和GA13ox等家族成员的了解并不深入,需要在更多作物中进行相关酶和基因的鉴定,为解析这些酶的基本生理功能提供更多的信息。另外,虽然已有大量研究证实GAs失活酶的转录调控对植物生长非常重要,但其转录调控的分子机制也仍然未知。(3)DELLA蛋白作为重要的枢纽性蛋白,其通过转录调控和蛋白间相互作用参与了大量植物生长调控过程。随着技术进步,有必要采用系统生物学、比较基因组学、功能基因组学等研究方法,在更多的物种中研究DELLA的功能,以便未来在作物改良中进行合理的应用。(4)虽然Rht-1和sd-1的应用取得了巨大的成功,但其他半矮化等位基因似乎都未能实现既保持作物产量又降低株高减少倒伏的效果。未来仍需要进一步的研究,来明确解析使Rht-1和sd-1实现“绿色革命”的发育和代谢机制。另外,如何利用基因编辑等新技术对赤霉素代谢相关基因进行精细调控,创制新的“绿色革命”品种,也将成为一个重要课题。