陆地棉GhSDP1及其启动子的克隆与表达分析
2022-03-10刘萌萌韩立军刘宝玲薛金爱李润植
刘萌萌 韩立军 刘宝玲 薛金爱 李润植
(山西农业大学分子农业与生物能源研究所,太谷 030801)
棉花(Gossypium hirsutum)与油菜、大豆、花生、芝麻等一样,是我国及全球重要油料作物。棉籽油作为棉花纤维生产的副产品既可以作食用油又可以制备生物柴油。棉籽的脂肪酸含量和组成是判定棉花油品质的重要指标,亦与棉籽储存品质和种子萌发等密切相关。因此,研究棉籽油脂合成和分解代谢及其调控机制,对于提高种子含油量、品质改良、种子储藏和种子萌发及幼苗生长发育调控等具有重要意义。
三酰甘油(triacylglycerol,TAG)是植物油脂的主要组成成分,也是真核生物中能量贮存的最主要形式,在多种酶的作用下由3分子长链脂肪酸和1分子甘油酯化而成[1]。植物中贮存的三酰甘油是食品工业原料和人类重要营养源,其大部分被用作食品制备和食用油[2]。种子贮藏油以三酰甘油(TAG)的形式存在,高等植物在种子萌发时期,储存的三酰甘油作为能量来源为种子萌发提供所需物质能量[3]。在种子萌发过程中,种子中储存的TAG首先被TAG脂肪酶水解,释放出游离脂肪酸,这些脂肪酸被运输到过氧化物酶体中,并经过多次β-氧化循环被氧化为乙酰辅酶A[4-5]。乙酰辅酶A为乙醛酸循环提供底物,以产生用于幼苗生长的葡萄糖[6-7]。
三酰基甘油脂肪酶(TAG ligase)在生物体内TAG的分解及利用中发挥重要作用。据报道,番茄脂 肪 酶LeLID1(lipase homologous to DAD1,LID1)和拟南芥脂肪酶AtSDP1(SUGAR-DEPENDENT 1,SDP1)是三酰基甘油脂肪酶,在种子萌发过程中降解油脂为种子萌发和幼苗生长提供碳源和能量[8-9]。拟南芥AtSDP1的突变导致种子萌发受阻[10],通过RNAi技术抑制甘蓝型油菜中BnSDP1的表达显著增加种子中TAG的含量[11]。沉默烟草中NtSDP1导致叶、茎、根中的TAG含量增加,这些研究表明SDP1型的脂肪酶是植物中一种重要的三酰基甘油脂肪酶[12]。SDP1编码的酶蛋白拥有特异性的patatin结构域,内含GXSXG保守基序,主要在种子中表达,SDP1与绿色荧光蛋白融合表达实验显示其定位于油体表面[13]。利用RNAi技术敲除大豆中4个同源的GmSDP1,转基因大豆植株中TAG的含量明显提高[14]。这些研究表明脂肪酶SDP1参与植物油脂代谢,而有关其如何调控棉花油脂降解的研究未见报道。
本研究以棉花脂肪酶基因GhSDP1为切入点,进行基因克隆和结构分析,检测时空表达,尤其是在逆境胁迫下的表达谱。进一步克隆该基因的启动子和分析顺式作用元件,构建GhSDP1启动子的GUS融合表达载体,经农杆菌介导在烟叶中瞬时表达,鉴定GhSDP1启动子活性,为深入解析棉籽油脂分解代谢调控机制,以及油脂代谢参与胁迫响应机理和棉花种子萌发等生长发育提供新知识。
1 材料与方法
1.1 材料
本氏烟草(Nicotiana benthamiana),大肠杆菌(Escherichia coli)DH5α菌 株,根 癌 农 杆 菌(Agrobacterium tumefactions)GV3101菌种,植物表达载体pCAMBIA1301,供试材料陆地棉品种冀丰1271均由山西农业大学分子农业与生物能源研究所提供。
1.2 方法
1.2.1 陆地棉GhSDP1的克隆 根据模式植物拟南芥AtSDP1的蛋白序列,利用BlastP搜索棉花基因组数据库CottonFGD(https://cottonfgd.org/),结合转录组中各种胁迫处理表达谱数据,筛选鉴定获得在非生物胁迫中上调表达的GhSDP1,依据参考基因组GhSDP1序列设计用于克隆该基因编码序列的引物。使用Plant Total RNA Kit提取棉籽的总RNA,使用ABM公司的反转录试剂盒5×All-In-One MasterMix(with AccuRT Genomic DNA Removal Kit)反转录成cDNA。以棉籽cDNA为模板,采用天根公司的高保真酶Pfu DNA Polymerase进行PCR反应。20 μL反应体系为10×Pfu Buffer 2 μL、dNTP Mix(2.5 mmol/L)1.6 μL、Pfu DNA Polymerase 0.5 μL、上 下游引物(表1)各0.5 μL、cDNA模板2 μL、RNasefree H2O 12.9 μL。PCR反应程序为94℃ 5 min;94℃30 s,58℃ 30 s,72℃ 30 s,30个 循 环;72℃ 10 min。PCR产物经1%琼脂糖凝胶电泳后,割胶回收目的条带,然后连接到pMD18-T载体上,转化至大肠杆菌DH5α感受态细胞,筛选阳性克隆后送上海生工生物工程有限公司测序。
1.2.2 陆地棉GhSDP1的表达特性分析 冀丰1271号脱绒种子直接播种于营养土中,待幼苗长至2片真叶且叶面完全展开时,选取长势一致、生长健壮的幼苗,将根部冲洗干净,用吸水纸吸干根部多余的水,将幼苗的根部分别进行200 mmol/L NaCl、15% PEG处理,处理的植株在(25±2)℃培养箱,连续光照条件下生长,低温处理的幼苗放于4℃培养箱中培养,分别于0(未胁迫处理)、1、3、6、12、24和48 h采集真叶叶片,提取总RNA,反转录合成cDNA,以棉花histone为内参基因。使用TaKaRa公司的TB GreenTMPremix Ex TaqTMⅡ荧光定量PCR试剂盒进行qRT-PCR反应。反应总体系为TB Green Premix Ex Taq II 5 μL、上下游引物(表1)各0.4 μL、cDNA模 板0.8 μL、RNase-free H2O 3.4 μL。反应程序为95℃ 10 min;95℃ 15 s,61℃ 1 min,40个循环。用2-ΔΔCt法进行基因的相对表达量分析。每个样品设置3个生物学重复。运用LSD多重比较检验(P<0.05)进行差异显著性分析,通过SPSS 25.0软件分析结果。

表1 本研究所用引物Table 1 Primers used in this study
1.2.3 烟草种植 将本氏烟草种子用70%的乙醇消毒后再经无菌水冲洗,播种于1/2 MS营养基中,置于25℃培养箱,18 h/8 h昼夜培养,待烟草幼苗刚长出两片叶子时移栽至营养土(土∶蛭石=10∶1)的混合土中,取用本氏烟草(6周龄)叶片为材料。
1.2.4SDP1启动子序列分析 利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/) 及New PLACE(https://www.dna.affrc.go.jp/PLACE/?action=newplace)在线网站分析所克隆的SDP1上游启动子区域上的顺式作用元件,并确定启动子区域所包含基序的种类与数量。
1.2.5 引物设计及SDP1启动子片段的克隆 根据NCBI网站(https://www.ncbi.nlm.nih.gov/)上公布的棉花GhSDP1上游启动子区域序列,采用Primer 6.0软件设计1对扩增引物pGhSDP1-F/pGhSDP1-R(表1),并在上下游引物的5′端分别加上PstI和NcoI酶切位点,以冀丰1271棉花基因组DNA为模板,PCR扩增目的片段。
用CTAB法[15]适当改良后提取棉籽总DNA,以所提取的棉籽DNA为模板,通过高保真聚合酶(购自全式金公司)用引物pGhSDP1-F/pGhSDP1-R进行PCR扩增,1%琼脂糖凝胶电泳后割胶回收目的片段并纯化。将纯化、回收后得到的目的片段与克隆载体经T4连接酶连接,其摩尔比约为3∶1。PCR后的连接产物转入大肠杆菌DH5α感受态细胞中,培养过夜后挑取单克隆菌落进行菌落PCR验证,电泳检测为阳性克隆的菌液送至上海生工生物工程有限公司测序。
1.2.6 载体连接及农杆菌的转化 用PstI和NcoI限制性内切酶对目的片段和pCAMBIA1301载体进行双酶切验证,回收目的片段和目的载体。利用同源重组将GhSDP1启动子片段(pGhSDP1)连接至去除了CaMV35S启动子的pCAMBIA1301载体的相应位点。使GhSDP1启动子片段代替 pCAMBIA1301载体中的CaMV35S启动子,并与GUS报告基因融合,载体构建简图如图1所示。通过热激法将重组载体转化至大肠杆菌感受态细胞DH5α中,平板培养基37℃过夜培养,挑取单菌落于液体培养基中继续培养,提取质粒后进行双酶切验证。将鉴定为阳性克隆的菌液送至上海生工生物工程有限公司测序。提取测序验证正确的重组质粒通过液氮冻融法转化到根癌农杆菌GV3101中,进行菌落PCR鉴定和质粒PCR验证。
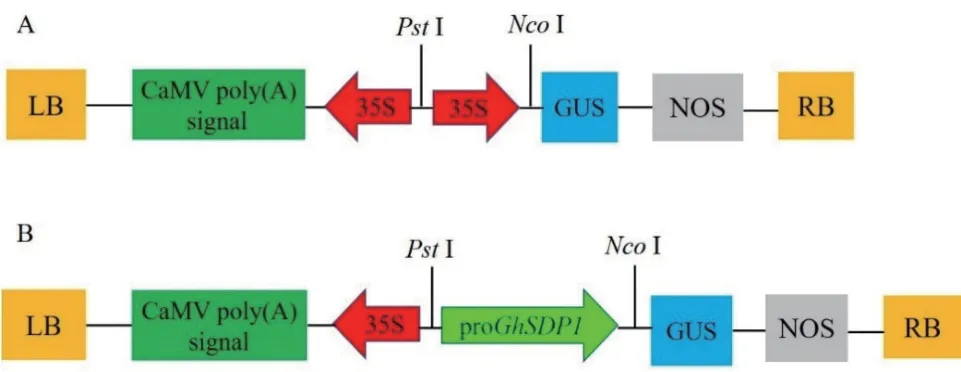
图1 构建的pCAMBIA1301-proGhSDP1植物表达载体简图Fig.1 Diagram of constructing pCAMBIA1301-proGhSDP1 plant expression vector
1.2.7 农杆菌介导的烟草瞬时表达与GUS染色 挑选经验证已转入重组载体的农杆菌阳性菌株和转pCAMBIA1301空载的农杆菌,接种于含50 μg/mL卡那霉素(Kan)和50 μg/mL利福平(Rif)的LB液体培养基中,同时以未转入任何载体的GV3101菌株作为阴性对照,28℃,100 r/min过夜培养至OD600为0.4-0.6。在4℃,5 000 r/min条件下,离心8-10 min收集菌体沉淀。用现配的侵染液(表2)重悬菌体沉淀,将菌液浓度调至OD600约为0.2,室温孵育2-4 h后侵染烟草叶片。选取长势一致且生长健壮、颜色鲜绿的本氏烟草幼苗(6周龄)作为试验材料,用现配的侵染液注射侵染[16],浸染后的烟草继续培养2 d。

表2 烟草农杆菌侵染液配置Table 2 Preparation of tobacco infecting solution
按照张丽华等[17]方法对转基因烟草进行GUS组织化学染色。取侵染后的新鲜组织,置于GUS染液中完全浸泡,37℃染色过夜,染色后去除GUS染液,用75%无水乙醇脱色处理至对照组叶片为无色,体视显微镜观察染色结果并拍照。
2 结果
2.1 陆地棉GhSDP1的克隆
根据已报道的拟南芥AtSDP1的蛋白序列,利用BlastP搜索棉花基因组数据库CottonFGD,筛选棉花SDP1同源基因。结果发现,该基因在A亚组(Gohir.A13G002700,A13)、D亚 组(Gohir.D13G00 2600,D13)各有一个拷贝,结合转录组中各种胁迫处理表达谱数据,发现D亚组GhSDP1差异表达显著,最终鉴定获得在非生物胁迫中上调表达的GhSDP1。以冀丰1271陆地棉棉籽的cDNA为模板,克隆获得GhSDP1编码序列(CDS)为2 541 bp(图2),与基因组所注释的该基因编码序列存在部分碱基差异,但蛋白序列一致。

图2 GhSDP1的CDS及编码的氨基酸序列Fig. 2 CDS of GhSDP1 gene and its encoded amino acid sequence
2.2 GhSDP1在不同胁迫处理下的表达模式分析
分别用不同胁迫(200 mmol/L NaCl、4℃、15%PEG)处理棉花幼苗,观察幼苗在不同时间点的表型(图3)。各胁迫处理以0 h(未胁迫,锥形瓶中加等量营养液)作为对照。盐胁迫处理12 h后,棉花叶片仍饱满挺拔,而胁迫24 h后,叶片开始皱缩(图3-A)。在4℃冷胁迫处理下,胁迫24 h时,棉花叶片卷曲下垂,随着胁迫时间的延长,叶片下垂程度加剧(图3-B)。在15% PEG模拟干旱胁迫处理下,胁迫6 h时,棉花叶片卷曲下垂,随着胁迫时间的延长,处理24 h后叶片严重萎蔫(图3-C)。

图3 棉花幼苗在不同胁迫处理下的表型观察Fig.3 Phenotype observation of cotton seedlings under different stress treatments
为了探究GhSDP1在非生物胁迫下的表达特性,利用qRT-PCR进一步分析GhSDP1基因在棉花幼苗不同胁迫处理下的表达谱。用200 mmol/L NaCl、4℃、15% PEG胁迫分别处理两片真叶的棉花幼苗,探究不同胁迫时间处理时GhSDP1的差异表达。如图4所示,在盐胁迫处理下,GhSDP1的表达量呈先升高后降低的趋势,12 h的表达量最高,约为对照(0 h,未胁迫处理)的2倍(图4-A)。在4℃低温处理条件下,处理0-6 h,GhSDP1表达量先上升后下降,随着胁迫时间的延长,其表达量又开始上调,24 h时的表达量约为对照的2.6倍,且二者间差异达显著水平(P<0.05)(图4-B)。在15% PEG模拟干旱胁迫处理下,处理0-3 h,GhSDP1表达量先上调后下调,在6-12 h内持续上调表达,随着胁迫时间的增加,其表达量下降(图4-C)。
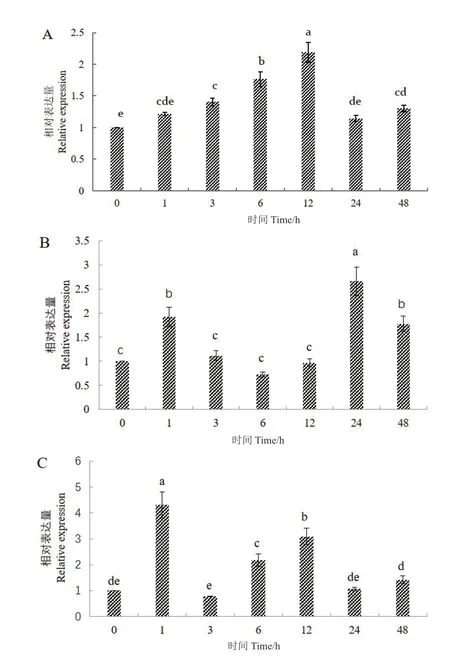
图4 GhSDP1在不同胁迫处理下的表达情况Fig.4 Relative expressions of GhSDP1 gene under different stress treatments
2.3 GhSDP1启动子克隆及顺式作用元件分析
以棉籽DNA为模板,采用上游引物pGhSDP1-F和下游引物pGhSDP1-R,扩增GhSDP1基因启动子片段获得1 884 bp的扩增产物,与目的片段实际大小一致(图5)。将其与克隆载体pMD18-T连接,并转化DH5α感受态细胞、测序。结果显示,获得的启动子片段与棉花参考基因组测序结果相似性达97%。
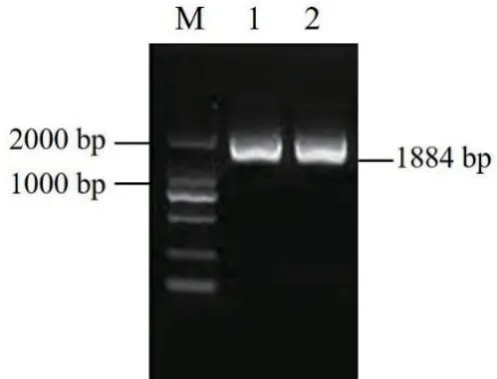
图5 陆地棉GhSDP1启动子的PCR扩增产物Fig.5 PCR amplified product of GhSDP1 promoter in G.hirsutum
利用PlantCARE对所克隆的GhSDP1上游启动子序列进行分析,结果(表3)显示,GhSDP1上游启动子除了包含大量核心启动子元件TATA-box以及在启动子和增强区域常见的顺式作用元件CAATbox外,还包含了与光响应有关的元件GATABOX以及一些植物激素响应元件,如赤霉素应答元件GAREAT等。结果表明,GhSDP1的表达可能受光、赤霉素和脱落酸等多种环境条件的影响。另外,该启动子区还含有一些与植物的抗逆性有关的元件,如干旱响应相关元件MYB1AT和MYBCORE,干旱及低温响应元件MYCCONSENSUSAT,盐、水杨酸及光响应元件GT1CONSENSUS,抗病响应相关元件BIHD1OS和损伤修复元件WBOXNTERF3等。此外,GhSDP1上游启动子还包含了花粉特异表达的顺式作用元件 POLLEN1LELAT52。这表明GhSDP1在植物生长发育及胁迫响应中可能行使重要功能。
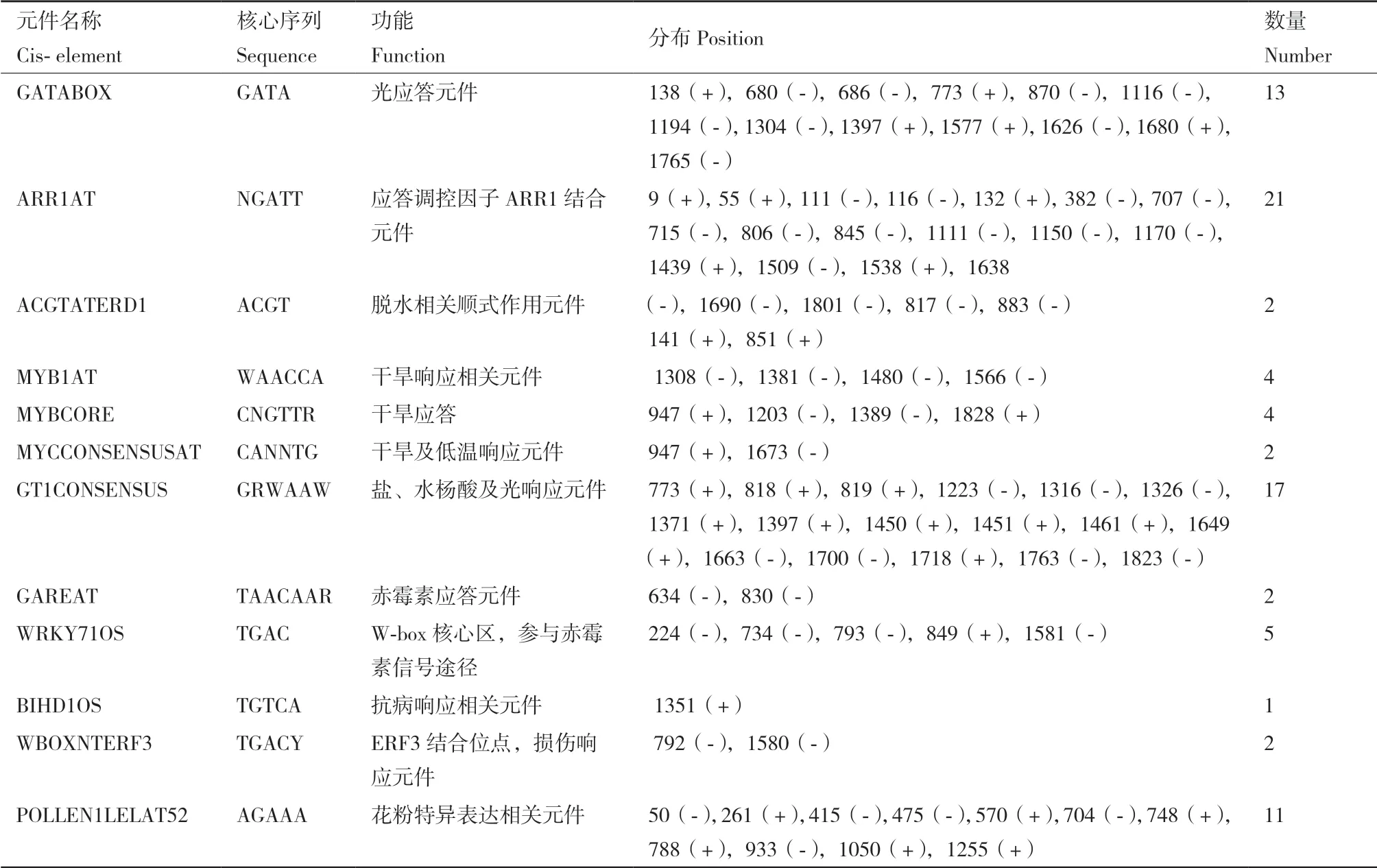
表3 棉花GhSDP1基因启动子部分顺式作用元件Table 3 Part of putative cis-acting elements and their positions in the GhSDP1 promoter
2.4 GhSDP1启动子的GUS报告基因表达载体的构建
为了进一步确定棉花GhSDP1启动子的活性,扩增GhSDP1的ATG上游启动子区域序列1 884 bp(图5),经割胶回收,与去除CaMV35S启动子片段的pCAMBIA1301载体连接,转化至大肠杆菌DH5α,并提取质粒,经PstI和NcoI双酶切后,进行凝胶电泳检测,可获得一条1 884 bp的DNA片段(图6),表明GhSDP1启动子片段已成功连接pCAMBIA1301载体。将构建好的pGhSDP1∷GUS表达载体通过液氮冻融法导入根癌农杆菌GV3101感受态细胞中,在含有50 mg/L Kana和50 mg/L Rif的LB培养基上进行筛选,经菌落PCR鉴定获得阳性克隆,可用于后续试验。
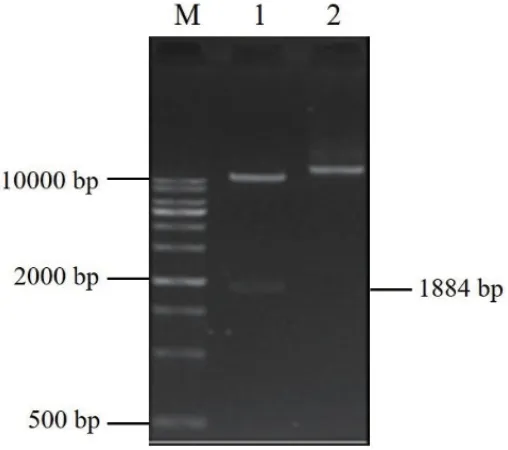
图6 表达载体重组子双酶切电泳图Fig.6 Electrophoresis of double-digested expression vector
2.5 GhSDP1启动子驱动GUS报告基因的表达分析
将携带有GhSDP1启动子片段的重组质粒的农杆菌通过注射法侵染烟草叶片,同时以转pCAMBIA1301空载的农杆菌侵染的烟草作阳性对照,未转入任何载体的GV3101菌株侵染的烟草作为阴性对照。共培养后进行GUS组织化学染色检测,通过体视显微镜观察染色结果。结果显示,携带有GhSDP1启动子片段的重组质粒及pCAMBIA1301质粒的农杆菌侵染的烟草叶片GUS报告基因表达,叶片被染成明显的蓝色(图7-A-B)。而未转入任何载体的GV3101菌株侵染的烟草叶片未被染上蓝色,表明没有GUS报告基因表达(图7-C),说明所克隆的GhSDP1启动子片段具有较强的启动子活性。

图7 携带有pGhSDP1∷GUS载体的农杆菌侵染烟草叶片GUS染色Fig.7 GUS staining of the tobacco leaves infected by agrobacterium containing the pGhSDP1∷GUS vector
3 讨论
植物种子中贮存的油脂是食用油的主要来源,同时也是重要的工业原料。油料作物育种的首要目标是提高种子的含油量。目前,关于油脂代谢的研究主要聚焦于油脂合成积累,而对参与油脂降解过程中相关基因的调控机理的研究相对较少。启动子作为启动基因转录的一段DNA序列,对基因的表达调控至关重要,其通过RNA聚合酶进行识别与结合,进而来控制基因表达的起始和表达强度[18]。为了解陆地棉油脂降解重要基因GhSDP1表达调控的分子机制,本研究对陆地棉油脂降解基因GhSDP1在不同胁迫处理下的表达模式进行分析,在非生物胁迫处理下,棉花幼苗叶片的表型发生明显变化,其生长受到不同程度的抑制,结果表明,GhSDP1对盐、干旱、低温胁迫均有不同程度的响应,推测可能与其启动子区所含有的相关参与逆境调控的应答元件有关。
启动子是一种重要的顺式作用元件,其在基因转录水平上发挥重要作用,从而调控基因的表达水平。因此,为了进一步探究GhSDP1的表达特性,本研究克隆了GhSDP1的启动子,并对其进行序列分析。分析结果显示,GhSDP1启动子区除了包含了大量核心启动子元件TATA-box以及在启动子和增强区域常见的顺式作用元件CAAT-box外,主要还包括一些与逆境应答有关的顺式作用元件(MYB1AT、MYCCONSENSUSAT、GT1CONSENSUS等)。MYB1AT元件与白桦BpbHLH112启动子的干旱诱导有关[19]。玉米ZmCBF3启动子活性分析表明,MYCCONSENSUSAT元件参与ZmCBF3启动子对低温胁迫的响应[20]。已有研究表明,GT1CONSENSUS在植物的盐胁迫响应中起重要作用,在盐胁迫条件下甜瓜CmLOX08启动子能够驱动GUS报告基因的表达[21]。同样,白桦BpZFP4启动子区的GT1CONSENSUS元件也参与白桦的盐渗透响应[22]。以上分析表明,GhSDP1启动子可能对GhSDP1在不同胁迫下的诱导表达起一定的调控作用。
脱落酸、赤霉素等植物激素不仅能够调控植物生长发育,其作为一种调节因子还提高了植物对不良环境的适应性[23-26]。脱落酸是一种重要的内源激素,喷施脱落酸能增加油菜种子含油量[27]。赤霉素的功能不同于脱落酸,其能促进种子萌发,由于种子在萌发过程中需要消耗油脂等营养物质来满足种子萌发和幼苗形态建成所需的能量,因此,赤霉素有利于种子油脂消耗而不利于油脂的积累。据报道,DELLA蛋白是一种能够限制植物生长发育的抑制因子,赤霉素信号能够抑制DELLA蛋白的表达,从而上调与种子脂肪分解相关的SFARs类GDSL脂酶基因的表达,最终抑制种子中油脂的积累[28]。与脱落酸响应元件相比,GhSDP1启动子区具有较多拷贝的赤霉素响应元件。一方面,赤霉素可以促进种子中油脂的降解;另一方面,研究发现,启动子区顺式作用元件的数目可能会影响基因表达的强度和诱导特性[29]。目前还不清楚赤霉素响应元件GAREAT如何调控下游基因GhSDP1的表达和强度,以及赤霉素信号途径在陆地棉种子油脂降解中的作用。
启动子驱动GUS报告基因的表达,从而检测其活性,已被广泛应用于多种植物基因功能的研究。CaMV35S启动子在菊花中驱动GUS外源基因的表达分析表明,2×35S启动子比35S启动子可以更加高效地促进GUS的表达[30]。转基因拟南芥GUS组织化学染色发现,魔芋AaHSFB1启动子主要在叶中进行表达[31]。本研究以GUS为报告基因,成功构建了植物表达载体pCAMBIA1301-pGhSDP1并进行烟草瞬时转化,结果表明,所克隆的GhSDP1启动子能驱动报告基因GUS有效表达。
目前,关于SDP1的研究已有较多报道。作为一种三酰基甘油脂肪酶,其主要参与油脂降解。拟南芥sdp1缺失突变体导致其幼苗在与纯化油体相关的脂肪酶活性方面缺陷,其发芽后生长表现出停滞,外源提供葡萄糖可以恢复突变体正常生长[8]。例如,拟南芥中发现的第一个调控油脂降解的转录因子AtAHL4,在种子萌发过程中抑制编码TAG脂酶SDP1的表达,从而调控植物体内TAG的降解[32]。马铃薯块茎中同时干扰StAGPase和StSDP1的表达,使得用于淀粉合成的碳流转向脂质生物合成,提高了其营养组织中的含油量[33]。研究表明,基因的表达模式主要受上游启动子的表达调控,为了探究GhSDP1的表达模式是否由于其上游启动子的调控,进一步通过烟草瞬时转化来探究陆地棉GhSDP1启动子的功能。本研究中构建的载体,目的是使SDP1启动子启动GUS的表达,GUS染色的结果显示所克隆的GhSDP1启动子活性较强。进一步需通过启动子功能区的缺失分析等来确定核心顺式作用元件及对基因表达强度的影响。
4 结论
成功克隆了陆地棉SDP1编码序列(2 541 bp)和启动子序列。启动子序列长度为1 884 bp,含有多种与逆境应答有关的顺式作用元件。GhSDP1参与棉花对盐、干旱、低温胁迫的响应。SDP1启动子有效驱动GUS报告基因的表达,显示启动子活性强。