牡丹根腐病原菌拮抗细菌抑菌活性物质分析
2022-03-10杨瑞先刘萍王祖华阮宝硕汪智达
杨瑞先 刘萍 王祖华 阮宝硕 汪智达
(洛阳理工学院环境工程与化学学院,河南 洛阳 471023)
牡丹根腐病又称烂根病,是牡丹种植中的重要土传病害。调查发现该病在牡丹多个种植区发生严重,如在菏泽和洛阳主要观赏区,根腐病的发病率一般在20%左右,严重地块可达到40%以上[1]。该病主要为害牡丹根部,植株感病后,支根和须根变黑腐烂,并逐渐向主根扩展,造成地上部分长势衰弱,叶片失绿、发黄,发病严重时整株常因无法吸收水分和养分导致植株萎蔫直至枯死[2]。目前,研究认为引起牡丹根腐病的病原菌主要为腐皮镰刀菌(Fusarium solani),但尖孢镰刀菌(F. oxysporum)和立枯丝核菌(Rhizoctonia solani)等在根腐病的发生和发展过程中,通常与腐皮镰刀菌(F. solani)混合侵染,导致牡丹根腐病的发生机制较为复杂[3-4]。
目前,在生产过程中主要采用农业措施和化学防治的方法控制牡丹根腐病的发生[5-6],虽取得了一定效果,但未从根本上解决根腐病的防治难题。牡丹根腐病防治过程中主要存在两个困难:一是牡丹为多年生植物,若采用轮作和换土的方法,在实际生产中难以实施,且成本较大;二是化学防治的效果不理想,且易造成病原菌抗性增加和土壤中农药残留,因此,急需探索根腐病防治的新途径。生物防治作为一种安全有效的防治方法日益受到重视,尤其是利用选育的内生拮抗菌株对植物病害进行防治,可从根本上抑制病原菌生长繁殖,改善土壤微生态环境,控制植物连作条件下土传根腐病病害的发生,且能够有效避免化学农药带来的防治缺点。
近年来,研究者采用4种商用生防菌剂MC -1(枯草芽胞杆菌Bacillus subtilis制剂)、B130-1(巨大芽胞杆菌B. megaterium制剂)、BA31和 BXN(枯草芽胞杆菌B. subtilis制剂)进行牡丹根腐病的防治,结果表明菌剂BA31和 BXN对牡丹根腐病的防治效果较好,其防效可达80%以上[7]。王雪山等[8]从牡丹根际土壤中分离获得了7株对牡丹根腐病原菌具有平板拮抗作用的细菌菌株,其抑菌带宽度在2-5 mm之间,为牡丹根腐病的生物防治提供了一些微生物资源。孟国庆等[9]从多年生牡丹发病植株根际土壤中获得了两株对牡丹根腐病原菌具有抑菌作用的菌株,经鉴定均为芽孢杆菌属(Bacillus)细菌。这些微生物在牡丹根腐病的生物防治中表现出了很好的应用潜力。
为进一步拓展牡丹根腐病的生防菌资源,本研究从健康牡丹根部组织中进行内生细菌的分离,通过前期筛选获得了2株对牡丹根腐病菌具有拮抗作用的细菌,并将其鉴定为解淀粉芽胞杆菌(B.amyloliquefaciens)。本文在前期研究的基础上,进一步探讨2个菌株抑菌活性物质的组成,并解析在抑菌作用过程中发挥主要生防作用的次生代谢产物,以期为牡丹根腐病的生物防治提供新的微生物资源,并为将来2个菌株在牡丹根腐病防治中的实际应用提供理论研究基础。
1 材料与方法
1.1 材料
1.1.1 供试病原菌:牡丹根腐病原菌(F. solani)由本课题组2019年4-5月间从洛阳牡丹国花园根腐病发病植株上分离、鉴定并保存的致病能力强的菌株。
1.1.2 供试内生细菌:解淀粉芽胞杆菌(B. amyloliquefaciens)md8和md9由本课题组 2019年9-10月间分离自洛阳理工学院牡丹种植地健康牡丹根部组织。
1.1.3 供试培养基:内生细菌纯化采用 TSA 培养基(胰蛋白胨3 g,植物蛋白胨1 g,氯化钠1 g,琼脂15 g,定容至1 L,pH7.2);根腐病原菌的纯化及平板抑菌作用采用PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂15-20 g,蒸馏水1 L,自然pH);拮抗菌株脂肽类物质的提取采用Landy 培养基[10]。
1.2 方法
1.2.1 拮抗牡丹根腐病原菌内生细菌菌株的鉴定 根据菌落形态特征和16S rDNA基因序列鉴定具有拮抗作用的内生细菌菌株md8和md9,具体方法参考文献[11]。
1.2.2 菌株md8和md9脂肽类化合物合成基因PCR 检测分析 以菌株md8和md9的基因组DNA为模板,通过PCR 扩增Fengycin 合成基因fenA,Surfactin 合成基因srfAA,Iturin 合成基因ituD,分别参考Koumoutsi和Hsieh文献合成基因引物[12-13],引物序列详见表1,引物由上海生工生物工程股份有限公司合成。PCR反应体系为25 μL,扩增程序为95℃预变性5 min;94℃变性1 min、55℃退火1min、72℃延伸1 min,共35个循环;72℃延伸10 min。1%琼脂糖凝胶电泳检测菌株md8和md9 基因组中相关脂肽类化合物合成基因的扩增情况。PCR产物切胶回收后,连接到载体pMD18-T 上,转化至大肠杆菌DH5α感受态细胞,挑取阳性克隆测序。测序由上海生工生物工程股份有限公司完成,DNA测序后的产物序列利用NCBI 数据库的Blast 程序进行同源检索,与GenBank 数据进行比对分析。
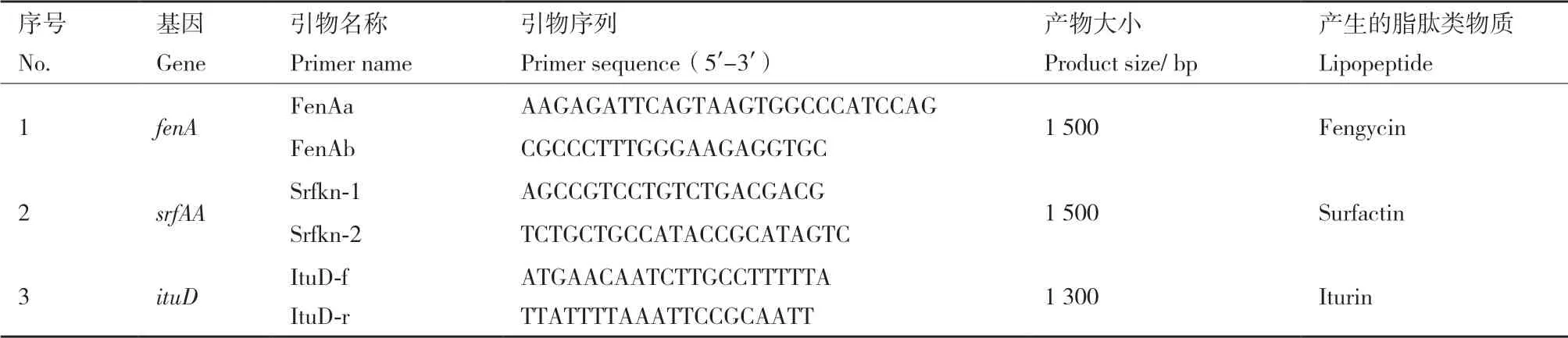
表1 脂肽类物质合成基因片段引物序列Table 1 Primer sequence for lipopeptide biosynthesis genes fragments
1.2.3 菌株md8和md9脂肽类物质的提取、凝胶层析分离及抑菌活性测定
1.2.3.1 脂肽类物质的提取及凝胶层析分离 采用酸沉淀和甲醇抽提法提取菌株md8和md9的脂肽类粗提物,具体方法参考文献[10]。将菌株md8和md9产生的脂肽类粗提物配制成合适浓度,利用Sephadex LH-20凝胶柱(1.6 cm×80 cm)进行分离纯化,上样体积2 mL,洗脱溶剂为甲醇,流速为1 mL/min,紫外检测波长为220 nm,每5 min收集1管,合并相关主要洗脱峰,用真空冷冻干燥机进行减压蒸干,磷酸缓冲液(0.2 mol/L,pH=7.0)溶解备用。
1.2.3.2 脂肽类物质及凝胶层析分离组分抑菌活性测定 采用牛津杯对峙培养法测定菌株md8和md9脂肽类粗提物及凝胶层析分离组分对牡丹根腐病原菌的抑菌活性。具体方法为:取直径5 mm根腐病原菌接种于PDA 培养基平板中央,将牛津杯插至距培养皿边缘1.5 cm处,将150 μL过滤除菌的脂肽类粗提物及凝胶层析分离组分分别加入牛津杯中,每个处理重复3 次,对照只接种病原菌,28℃培养箱培养5 d后,测量抑菌带的宽度。
1.2.4 菌株md8和md9脂肽类物质合成基因荧光定量PCR分析
1.2.4.1 菌体收集 采用平板对峙法准备用于荧光定量PCR分析的细菌样品。具体方法为:在平板一侧划线接种拮抗细菌菌株,另一侧接种直径5 mm根腐病原菌菌饼,28℃倒置培养。分别收集对峙培养2 d、3 d、4 d、5 d、6 d和7 d的细菌菌体5 mg,以平板仅接种拮抗菌株的细菌菌体为对照,所有收集菌体均置于1.5 mL离心管中-80℃冷冻备用。每 10个平板作为1个生物学重复,每个样品设置3次重复。共采集 14 组样品,分别包括菌株md8和md9 与根腐病原菌对峙培养后2 d、3 d、4 d、5 d、6 d和7 d的细菌样品12组,以及在PDA平板上仅接种细菌菌株md8和md9,培养2 d后收集的菌体样品2组。
1.2.4.2 菌体RNA的提取、质量检测及逆转录聚合酶链反应 按照OMEGA E.Z.N.A®Bacterial RNA Kit(Omega Bio-Tek公司)试剂盒说明书的使用方法提取细菌样品RNA,利用NanoDrop 2000分光光度计在260/280 nm处测定各样品RNA的浓度和纯度。按照PrimeScriptTMRT reagent Kit with gDNA Eraser Kit(TaKaRa公司)试剂盒说明书的使用方法将细菌样品RNA反转录为cDNA。
1.2.4.3 荧光定量PCR检测 根据DNA 测序获得的拮抗菌株脂肽类物质合成基因序列,设计荧光定量PCR引物,序列详见表2,由上海生工生物工程股份有限公司合成。以细菌rpsJ基因(编码细菌核糖体蛋白)作为内参基因[14],利用ABI7500实时荧光定量PCR仪(Applied Biosystems公司,USA)对样品进行定量检测。荧光定量PCR的反应体系为:2×SYRBR Green Buffer 10 μL;引物(10 μmol /L)0.5 μL;cDNA模板 2μL;ddH2O 6.4 μL,总体积为20 μL。PCR的反应程序为:95℃ 预变性30 s,95℃ 变性5 s,60℃ 退火30 s,循环40 次。实时荧光定量结果Cq值采用 2-△△Ct方法进行相对定量[15]。

表2 脂肽类物质合成基因荧光定量PCR引物序列Table 2 Primer sequences for lipopeptide biosynthesis genes in RT-qPCR
1.2.5 基质辅助激光解吸飞行时间质谱鉴定抑菌物质 利用基质辅助激光解吸附飞行时间质谱(MALDI-TOF-MS)分析菌株md8和md9凝胶层析分离组分中具有抑菌活性的物质成分结构。MALDITOF-MS 具体方法参照文献[16],使用337 nm 氮激光源解吸附和电离,采用α-氰-4-羟肉桂酸(α-cyano-4-hydroxycinnamic acid)为基质,将具有抑菌作用的分离组份置于仪器离子源进行测定,质量扫描范围为100 - 2 000 Da。
1.2.6 数据统计与分析 试验数据采用SPSS 19 和Excel 2010 软件进行分析。
2 结果
2.1 拮抗菌株md8和md9的鉴定
经前期筛选,菌株md8和md9对牡丹根腐病原菌具有显著的抑菌作用。利用形态学特征和分子生物学方法进行菌株鉴定。形态结果表明菌株md8和md9的菌落均为白色,圆形,干燥,边缘不规则,环状凸起,革兰氏染色均为阳性,菌体均为杆状(图1)。菌株md8和md9的16S rDNA PCR扩增产物长度分别为1 446 bp和1 438 bp,其在 GenBank中的登录号分别为MT233097和MT233098,利用NCBI中的BLAST软件进行比对分析,结果表明菌株md8和md9与解淀粉芽胞杆菌(B. amyloliquefaciens)序列相似度高达99%,选取与其序列相似性较高的模式菌株,通过MEGA 7.0软件中的邻近法构建系统发育树(图2),系统发育树结果表明,菌株md8和md9与解淀粉芽胞杆菌(B. amyloliquefaciens)聚在同一分支。结合形态学特征和16S rRNA基因分子生物学鉴定,将菌株md8和md9鉴定为解淀粉芽胞杆菌(B. amyloliquefaciens)。

图1 拮抗菌株md8和md9菌落和菌体形态特征(10×100)Fig.1 Colonies and morphological characteristics of antagonistic strain md8 and md9(10×100)
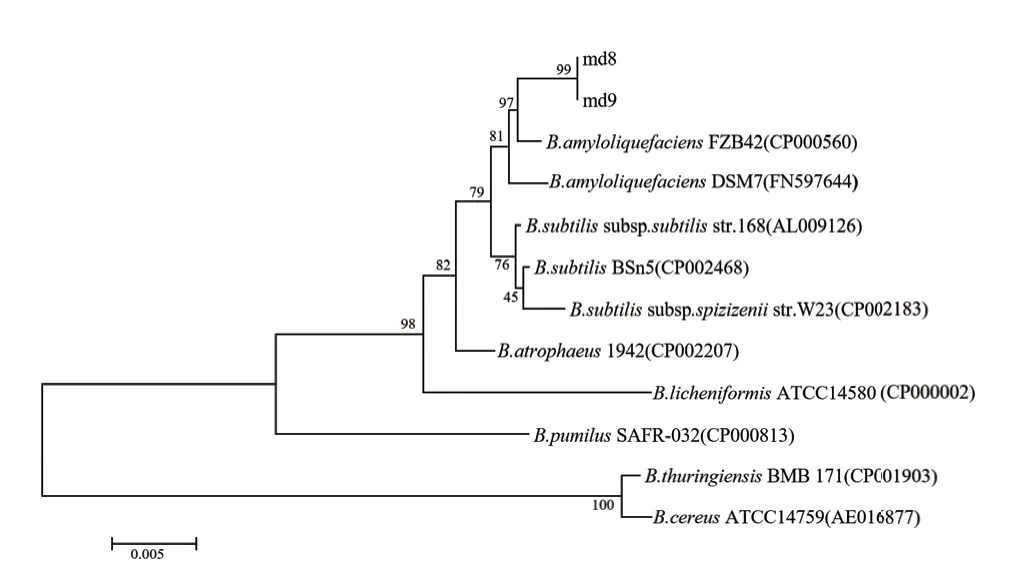
图2 基于16S rDNA序列构建的拮抗细菌md8和md9的系统发育树Fig.2 Phylogenetic tree of antagonistic strain md8 and md9 based on 16 S rDNA sequences
2.2 菌株md8和md9脂肽类物质合成基因分析
利用3对引物对拮抗菌株md8和md9脂肽类物质合成基因进行PCR扩增,结果表明拮抗菌株md8和md9均能够扩增获得ituD、fenA和srfkAA基因片段,其片段大小分别约为1 300 bp、1 500 bp和1 500 bp(图3)。将扩增获得的特异条带回收纯化,克隆测序,分别获得菌株md8和md9的3个脂肽类物质合成基因片段序列。Blastn 比对结果表明,菌株md8的合成基因组中ituD基因片段(1 312bp)与B. amyloliquefaciensUMAF6639(CP006058)序列同源性达到99%,fenA基因片段(1 559 bp)与B.amyloliquefaciensB15(CP014783)同源性达到99%,srfAA基因片段(1 632 bp)与B. amyloliquefaciensMBE1283(CP013727)同源性达到98%;菌株md9的合成基因组中ituD基因片段(1 328 bp)与B. amyloliquefacienssubsp.plantarumCAUB946(HE617159)序列同源性达到99%,fenA基因片段(1 555 bp) 与B. amyloliquefaciensY2(CP003332)同源性达到99%,srfAA基因片段(1 640 bp)与B.amyloliquefaciensLFB112(CP006952)同源性达到99%。利用 Blastx 将获得的基因片段序列与 NCBI 数据库中非冗余蛋白质序列进行比对,结果发现,菌株md8和md9的fenA、srfAA、ituD基因片段序列分别与解淀粉芽孢杆菌(B. amyloliquefaciens)非核糖体物质芬荠素合成酶蛋白序列、表面活性素合成酶蛋白序列、伊枯草菌素类杆菌霉素D合成酶蛋白序列相似性达到99%,说明利用特异引物所扩增获得的基因片段为相应的非核糖体物质类脂肽类物质合成基因序列,表明菌株 md8和md9具有合成脂肽类抑菌物质的能力。
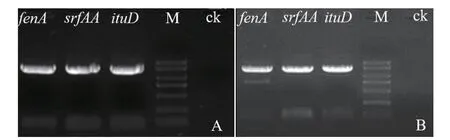
图3 菌株md8和md9脂肽类物质合成基因片段PCR扩增电泳结果Fig. 3 Electrophoresis of PCR amplified lipopeptide biosynthesis gene fragments of strain md8 and md9
2.3 菌株md8和md9脂肽类物质合成基因荧光定量PCR分析
平板对峙实验结果表明,不同培养时间菌株md8和md9对牡丹根腐病原菌的抑菌作用有所变化,对峙培养后的5-7 d抑菌作用相对稳定(图4)。利用RNA提取试剂盒提取处理样品和对照样品的RNA,结果显示所有样品RNA提取质量较好,OD260/280均在 1.9-2.1 之间,能够有效满足后续试验要求。利用反转录试剂盒将所有细菌样品RNA反转录为cDNA,同时利用引物进行实时荧光定量 PCR。结果表明菌株md8和md9的ituD、fenA和srfAA合成基因在与牡丹根腐病原菌的对峙培养过程中其相对表达量发生了不同程度的变化(图5和6)。与对照表达量相比,菌株md8芬荠素(fenA)和伊枯草菌素(ituD)合成基因在对峙培养6 d时相对表达量达到高峰,分别是对照的3.8倍和6.1倍,表面活性素合成基因(srfAA)的表达量在整个对峙培养过程中相对稳定,仅为对照的2-3倍。菌株md9fenA和ituD合成基因表达量在对峙培养5 d时达到高峰,分别是对照的4.6倍和7.8倍,srfAA的表达量在整个对峙培养过程中相对稳定,也仅为对照的2-3倍。荧光定量PCR结果表明,菌株md8和md9ituD合成基因在与根腐病原菌的对峙培养过程中被诱导表达,其表达量显著高于对照基因的表达量,推测菌株md8和md9合成的伊枯草菌素类物质可能在牡丹根腐病原菌平板抑制过程中发挥主要抑菌作用,同时fenA合成基因也被诱导表达,表明芬荠素类物质对牡丹根腐病原菌也具有一定的抑制作用。
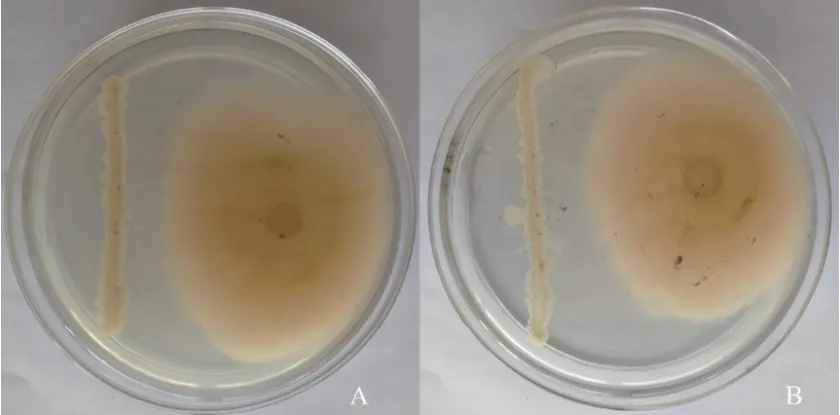
图4 菌株md8和md9对牡丹根腐原菌的平板抑制作用(平板对峙培养6 d)Fig.4 Inhibitory effect of strain md8 and md9 inhibiting F. solani on the plate(plate confrontation cultured 6 d)
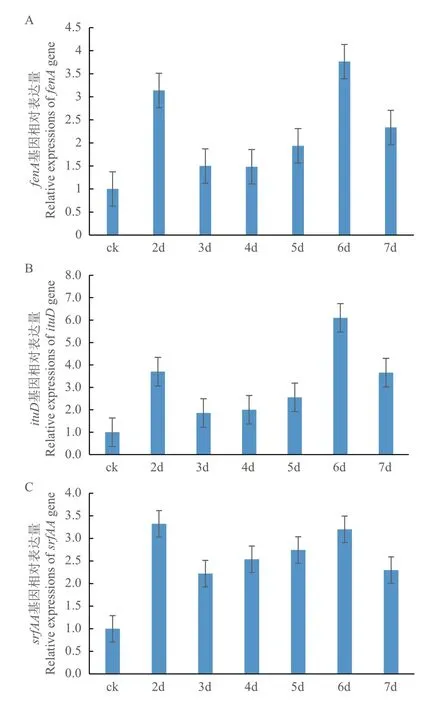
图5 菌株md8脂肽类物质合成基因在抑制牡丹根腐病原菌时的相对表达量Fig.5 Relative expressions of the lipopeptide biosynthesis genes of strain md8 inhibiting F. solani on the plate
2.4 菌株md8和md9脂肽类粗提物及凝胶层析组分的抑菌活性
菌株md8和md9脂肽类粗提物对牡丹根腐病原菌具有明显的平板抑制作用,其抑菌带宽度均可达到10 mm(图7-A)。两个菌株的脂肽类粗提物利用Sephadex LH-20凝胶层析柱层析分离,结合时间和220 nm处的吸光度收集分离组分,菌株md8共收集到10个分离组分,分别命名为A1-A10,菌株md9共收集12个分离组分,分别命名为B1-B12。牛津杯对峙培养法测定不同收集组分的抑菌活性,结果表明,菌株md8 层析分离组分A4和A5对牡丹根腐病原菌具有明显的抑菌作用,其抑菌带宽度分别为5.2 mm和3.1 mm(图7-B),菌株md9 的3个分离组分B2、B3和B4对牡丹根腐病原菌具有不同程度的抑菌作用,其抑菌带宽度分别为1.3 mm、6.2 mm和5.4 mm(图7-C),其中组份B3对牡丹根腐病原菌的抑菌效果最为显著,推测其为菌株md9抑制根腐病原菌的主要活性物质。
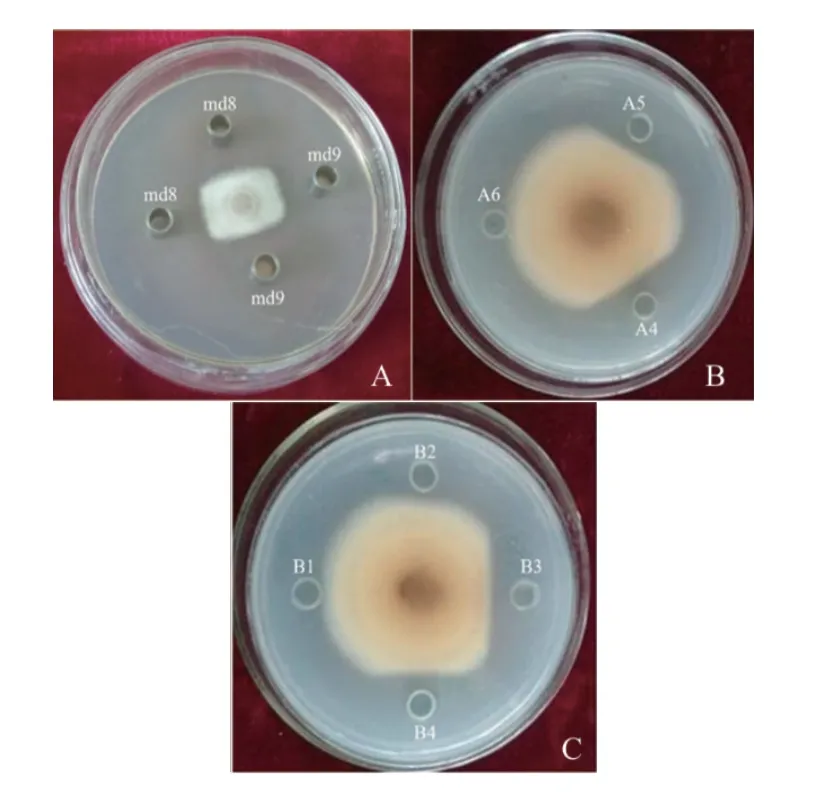
图7 菌株md8和md9脂肽类粗提物和凝胶层析分离组分对牡丹根腐病原菌的平板抑制作用Fig.7 Inhibition effect of lipopeptide extract and separation components via gel chromatography of strain md8 and md9 inhibiting F. solani
2.5 菌株md8和md9具抑菌活性分离组分的MALDI-TOF-MS分析
为进一步明晰菌株md8和md9对根腐病原菌具有抑菌作用的凝胶层析分离组分的物质种类,利用 MALDI-TOF-MS分析具有抑菌活性的凝胶层析分离组分。菌株md8凝胶层析组分A4和A5 MALDITOF-MS分析结果表明(图8),其中组分A4质子化峰值m/z=1 031和1 045,其中1 031和1 045差一个亚甲基(-CH2),推测这种化合物为脂肪酸链相差一个亚甲基(-CH2)的同系物,与C14-C15的Bacillomycins D[M+H]+加 合 峰 相 对 应,同时在组分A4中含有m/z=1 081的离子峰,与C16 Bacillomycins D的[M+Na]+加合峰相吻合,由已知文献确定,菌株md8的组分A4主要为C14 Bacillomycins D[17]。组份A5的质谱显示在m/z=1 058、1 072和1 086处出现3个离子峰,其中1 058和1 072差一个亚甲基(-CH2),1 072和10 86之间差一个亚甲基(-CH2),表明它们为同系物,与属于C15-C17 的Iturin B[M+H]+加合峰相对应,同时在组分A5中含有m/z=1 096的离子峰,其响应量相对较弱,与C15 Iturin B[M+K]+加合峰相吻合,由已知文献确定,菌株md8的组分A5主要为C15 Iturin B[17]。菌株md9对根腐病原菌具有抑制作用的3个组分B2、B3和B4经 MALDI-TOF-MS分析(图9),组分B2的质谱显示在m/z=1 519和1 533处出现离子峰,对应于C20-C21 Fengycin A[M+H]+加合峰,由已知文献确定,组分B2的主要物质为Fengycin A[18];组分B3的质谱显示在m/z=1 072和1 086出现二个离子峰,对应于C15 Iturin B的质核比,同时在B3组分中含有m/z=1 083的离子峰,其响应量也相对较强,与C15 Bacillomycins D的[M+K]+加合峰相吻合,表明B3组分中可能含有C15 Iturin B和C15 Bacillomycins D两种物质;组分B4的质谱显示在m/z=1 058和1 086处出现2个离子峰,推测菌株md9组分B4的主要物质种类为C15 Iturin B。
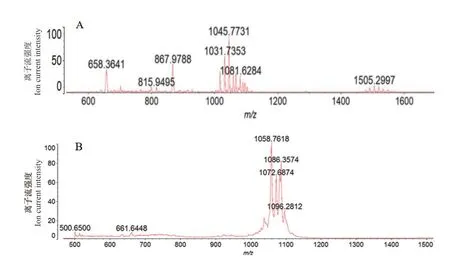
图8 菌株md8凝胶层析分离组分A4(A)和A5(B)的MALDI-TOF-MS分析Fig.8 MALDI-TOF-MS analysis of separation component A4(A)and A5(B)produced by the strain md8
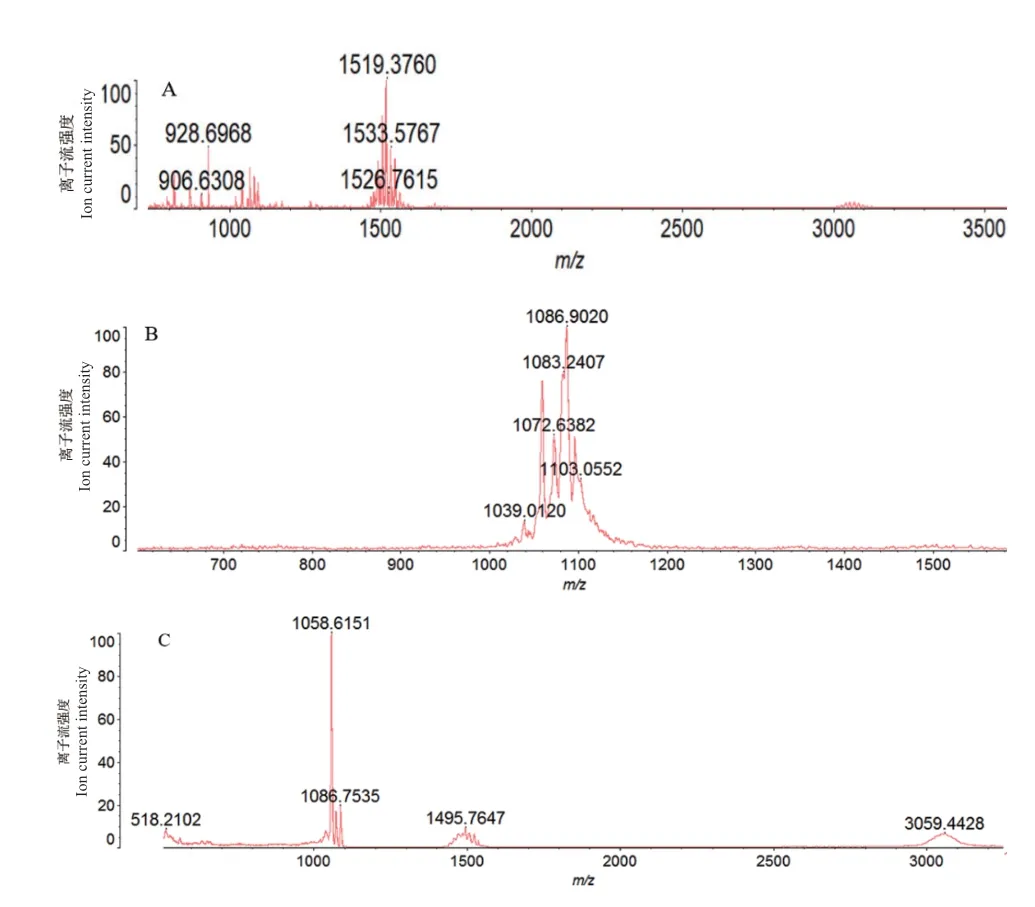
图9 菌株md9凝胶层析组分B2(A)、B3(B)和B4(C)的MALDI-TOF-MS分析Fig.9 MALDI-TOF-MS analysis of separation component B2(A),B3(B)and B4(C)produced by the strain md9
3 讨论
牡丹根腐病是严重影响牡丹栽培管理的一种土传病害,其发病机制复杂,病原菌难以清除,目前尚无有效的防治方法。本研究对内生解淀粉芽胞杆菌(B. amyloliquefaciens)md8和md9抑制牡丹根腐病原菌的活性物质成分进行了分析,结果表明菌株md8和md9合成的伊枯草菌素类物质为抑制牡丹根腐病原菌菌丝生长的主要活性物质。目前研究表明,解淀粉芽胞杆菌(B. amyloliquefaciens)产生的脂肽类化合物是其发挥生防作用的主要抗菌物质,主要包含表面活性素(surfactins)、伊枯草素(iturins)和芬荠素(fengycins)三大类群[19-20]。其中伊枯草菌素(iturins)分子量约为1 000 Da,家族成员包括Iturins A、B、C、D,杆菌霉素Bacillomycins D、F、L等,Bacillomycin D 是Iturin家族的一类抗菌脂肽,它与Iturin 结构相似,其氨基酸组成不同[21]。芬荠素(fengycins)分子量约为1 500 Da,家族成员主要包括Fengycins A和B,伊枯草菌素和芬荠素均具有强烈抑制真菌生长的能力,尤其对丝状真菌抑制作用更加明显[22]。桑建伟等[16]研究发现内生解淀粉芽胞杆菌(B. amyloliquefaciens)BEB17对香蕉枯萎病菌(F. oxysporumf.sp.cubense)起主要抑制作用的物质为芬荠素和伊枯草菌素;向亚萍等[23]研究发现杆菌霉素和芬荠素在菌株B1619 抑制番茄枯萎病菌(F. oxysporumf.sp.lycopersici)中起到相当重要的作用;杨洋[24]研究发现解淀粉芽胞杆菌(B.amyloliquefaciens)FZB42产出的杆菌霉素D和芬荠素是抑制禾谷镰孢菌(F. graminearum)生长的主要活性物质,尤其是杆菌霉素D的抑菌效果最为显著。牡丹根腐病原菌属于镰刀菌属(Fusarium)真菌,与香蕉枯萎病菌、番茄枯萎病菌和禾谷镰孢菌为同属病原菌,本研究表明菌株md8和md9抑制根腐病原菌生长的主要抑菌活性物质为Iturin B、Bacillomycin D和Fengycins A,其中Iturin B和Bacillomycin D抑菌作用较为显著,Fengycins A抑菌作用相对较弱,表明伊枯草菌素类物质在牡丹根腐病原菌生长过程中发挥主要的抑制作用,这与前人的研究结果是一致的。后期可进行菌株发酵条件的优化,进一步纯化获取 Iturin B和Bacillomycin D物质,以为牡丹根腐病原菌的防治提供良好的生防菌剂。
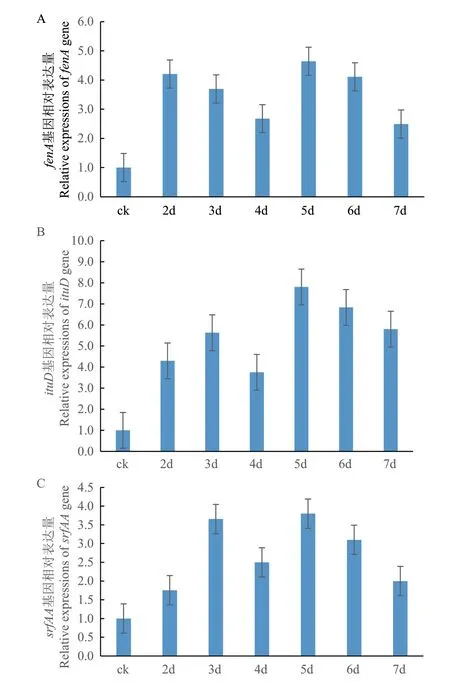
图6 菌株md9脂肽类物质合成基因在抑制牡丹根腐病原菌时的相对表达量Fig.6 Relative expressions of the lipopeptide biosynthesis genes of strain md9 inhibiting F. solani on the plate
解淀粉芽胞杆菌产生的抗菌脂肽化合物结构相对复杂,通过PCR扩增技术可对抗菌物质的编码调控基因进行检测,从而初步判断菌株产生抗菌物质的能力和种类[25-26]。本研究PCR检测结果表明菌株md8和md9含有3种脂肽类物质的合成基因,MALDI-TOF-MS分析结果表明两个菌株的抑菌活性物质中确实含有脂肽类物质,表明PCR检测技术可以快速识别、筛选抗菌脂肽的产生菌,同时也可初步判断菌株产生脂肽类物质的种类,也再次证实基因检测方法在抗菌脂肽产生菌鉴定方面具有较强的可行性。本研究中同时获得了菌株md8和md9对根腐病原菌具有显著抑制作用的物质Iturin B,但由于前期未设计检测Iturin B的编码调控基因,因此建议在利用基因检测技术进行抗菌脂肽产生菌的筛选时,应尽可能全面的对脂肽类类物质的编码调控基因进行检测,以更准确的判断菌株产生抗菌物质的种类,同时也可判断菌株是否能够产生新颖的抗菌物质。
Li等[27]研 究 了B.amyloliquefaciensSQR9四个脂肽类合成物质编码基因(fenA、bmyD、srfAA、dhbA)与6种土传病原真菌平板对峙培养时相对表达量的变化,结果表明在与腐皮镰刀菌(F. solani)和尖孢镰刀菌(F. oxysporum)对峙培养时,fenA、bmyD和srfAA基因均表现上调表达的趋势。Sajitha等[28-29]研 究 了 菌 株B. subtilisB1与Lasiodiplodia theobromae平板对峙培养时fenB和srfAA脂肽类物质合成编码基因表达量的变化,表明fenB基因在对峙培养4 d时其表达量显著增加,srfAA基因在细菌与病原真菌共培养的整个过程中表现出一个相对稳定的表达量。这些研究结果均表明生防细菌在与病原真菌共培养条件下,能够激活一些抗菌物质合成基因的表达,产生一些抗菌物质,从而为细菌获得有效的生存条件。本研究中菌株md8和md9在与腐皮镰刀菌(F. solani)共培养条件下,其ituD和fenA基因均表现上调表达,同时srfAA基因的表达量在共培养前期也显著增加,表明srfAA基因编码的表面活性素物质在菌株md8和md9抑制牡丹根腐病原菌的过程中具有协同增效作用,结合MALDI-TOFMS分析结果,再次验证了ituD基因编码合成的物质Bacillomycin D为菌株发挥抑菌作用的主要物质种类。但其抑菌活性物质如Iturin B、Bacillomycin D和Fengycins A对牡丹根腐病原菌的抑菌作用机制需进一步研究,同时为何表面活性素物质编码基因srfAA在细菌与真菌共培养的前期表达量相对较高,以及菌株md8和md9抑菌活性物质成分Iturin B物质编码基因ituB是否也能够被高效诱导表达均需做进一步的验证试验。
4 结论
菌株md8和md9伊枯草菌素(iturin)的合成基因ituD在与牡丹根腐病原菌对峙培养过程中相对表达量显著增加。MALDI-TOF-MS分析表明2个菌株中具有抑菌作用的组分主要为伊枯草菌素类物质Iturin B和Bacillomycins D,结合实时荧光定量PCR结果,推测菌株md8和md9在拮抗根腐病原菌过程中发挥主要生防作用的物质为伊枯草菌素(iturin)。