草莓根腐病病原真菌Ilyonectria novozelandica的鉴定
2022-03-10史芳芳褚继萍
史芳芳 褚继萍
(新疆生产建设兵团第十二师农业科学研究所,新疆乌鲁木齐 830088)
近年来,我国草莓的种植面积不断扩大,草莓病害造成的危害也逐年加重(陈道 等,2021),其中根部病害最为严重,造成巨大经济损失,成为草莓产业发展的主要障碍之一。草莓根腐病(strawberry root rot)是草莓根部重要病害之一(赵秀娟 等,2006),在世界草莓主产区均有发生,主要由土传病原真菌引起,草莓发病后植株矮小,最后全株萎蔫枯死,严重时可造成整个草莓生产园区毁灭。因此准确鉴定引起草莓根腐病的病原菌,对该病害的防治及抗病育种工作具有重要意义。
草莓根腐病是由多种病原物和环境相互作用引起的一大类病害的总称。常见的病原菌:引起草莓黑根腐病的主要有、sp、sp(Minegish,1989;Paulus,1990)、sp(徐淑华等,2004);引起草莓红心(中柱)根腐病的主要有、P.E.Nelson et K.Wilhelm;引起草莓白根腐病的主要有Prill、(裘维蕃,2001;Zveibil &Freeman,2005);引起草莓鞋带冠根腐病的主要有(Vahl ex Fr.)Kummer(Fox,2003)等。
土赤壳属真菌广泛分布在木本和草本植物的根内以及土壤中(Chaverri et al.,2011),属于腐生真菌或弱寄生真菌。该属大多数种类为植物病原菌,可引起植物根腐病和黑腐病等。土赤壳属的模式种是,目前,该属已知26 个种,包括从复合群中分出的14 个新种(Chaverri et al.,2011;Cabral et al.,2012a,2012b;Zeng &Zhuang,2013)。我国仅报道4 个种(Zhuang,2013;王玉君 等,2015),分别为、、、,都是从健康植株中分离得到的内生菌,目前没有从发病植株分离到土赤壳属的致病菌。
查阅相关文献发现前人对草莓病害病原菌的鉴定多基于形态特征和ITS 序列,有时不能鉴定到种水平。本试验采用形态学与多基因序列特异引物分析相结合的方法对引起草莓根腐病的病原菌进行鉴定。从草莓根部分离到该属1 个中国新记录种,结合形态鉴定和rDNA-ITS、-、(HIS)序列分析,对其进行形态描述和种类归属,明确草莓根腐病致病菌的新种类,为该病害的准确识别及综合防治和草莓抗病育种提供了理论依据。
1 材料与方法
1.1 材料
病原菌分离纯化培养基:PDA 培养基。仪器及试剂:水浴锅,生工生物工程(上海)股份有限公司;离心机,美国赛默飞世尔公司;PCR 扩增仪和凝胶成像仪,美国BIO-RAD 公司;电泳仪,北京六一生物科技有限公司等。PCR 扩增试剂购自广州东盛生物科技有限公司,普通植物基因组DNA 提取试剂盒(离心柱型)购自生工生物工程(上海)股份有限公司;引物合成及测序均由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 发病植株采集 2020 年9 月在新疆第十二师农业科学研究所草莓育苗网室采集红颜草莓脱毒原原种苗发病植株,症状表现为萎蔫,坍塌在栽培基质表面,其叶片、叶柄未表现发病症状,从形态学特征不能判断其病原菌,需要进行实验室病原菌培养进而确定其发病原因。用小铲子从基质槽中挖取约10 cm 带有根系的病株,将其放入自封袋中,做好标记。后期通过人工致病性试验和温室中自然感病状态进行症状综合对比。
1.2.2 病原菌的分离纯化 真菌的分离采用常规的组织分离法。将根部短缩茎切去表皮层,流水冲洗30 min,晾干;短缩茎用75%酒精消毒30 s,接着用无菌超纯水冲洗3~5 遍;再用10%次氯酸钠溶液消毒8~10 min,无菌超纯水冲洗3~5 遍,用灭菌的无菌滤纸将短缩茎上的水吸干,将短缩茎切割成小薄片,接种于已灭菌的PDA 平板上,每个平板中放3 片,28 ℃下培养3~4 d。待组织边缘部位有菌丝长出时,用接种环挑取单一菌丝转接到PDA 平板上继续培养纯化,同时接种5 个平板,观察来自5 个不同部位的菌丝生长状态的差异性。纯化3~4 次后可以得到纯化的病原分离物。
1.2.3 致病性测定 12 月将红颜草莓健康小苗种植在日光温室营养钵中,种植30 d 后用无菌接种针在健康草莓植株的根部短缩茎、叶部分别扎1 个小洞,然后将另一无菌针沾取分离纯化的病原菌孢子悬浮液(含孢子5 × 10个 · mL)接种到伤口处,接种后的植株置于温室中保湿培养,以健康草莓植株为对照,每个处理接种2 株,对照2 株,接种7 d 后对草莓植株进行观察。
1.2.4 病原菌的形态学鉴定 按照魏景超(1979)的真菌鉴定方法进行病原菌鉴定。将长满病原菌的PDA 平板置于4 ℃冰箱中处理1 周后,取出平板室温放置30 min。用无菌接种针挑取PDA 平板上的少量菌丝,悬浮于滴加无菌水的载玻片上,用高倍镜观察病原菌分生孢子形态。从病原菌的菌丝、菌丝分枝、孢子等形态特征来进行分类鉴定。
1.2.5 病原菌的分子生物学鉴定 用PD 液体培养基将纯化得到的单一菌株在28 ℃下摇菌振荡培养5 d,将培养得到的菌球用镊子取出置于研钵中,加液氮研磨成粉末,转入1.5 mL 离心管中,利用普通植物基因组DNA 提取试剂盒(离心柱型)提取DNA。首先采用真菌ITS 区域通用引物ITS1 和ITS4 对分离得到的菌株的ITS DNA 序列进行扩增,获得1 条大小约500 bp 的DNA 片段,然后利用-基因和基因特异引物(表1)分别对DNA 进行PCR 扩增。

表1 扩增草莓根腐病病原菌不同序列的引物
25 μL 的PCR 扩增反应体系包括:1 μL(约50 ng)模板DNA、12.5 μL PCR buffer mix(含Mg)、0.4 μmol · L引物各1 μL、DNA 聚合酶0.4 μL、ddHO 9.1 μL。
PCR 反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,35 个循环;最后72 ℃延伸5 min。PCR 产物在1%的琼脂糖凝胶上电泳40 min,DNA 核酸染料染色,凝胶成像仪观察,扩增产物送由生工生物工程(上海)股份有限公司测序。测序结果登陆GenBank 进行在线BLAST 核酸同源性比对,分别下载与-和序列最相近的土赤壳属序列以及柱孢属和新丛赤壳属序列共48 条(表2),以土赤壳相近种属菌种为外类群,利用MEGA 6.0 软件,采用NJ 邻接法进行进化树分析,以验证形态学特征鉴定结果的准确性及可靠性。

表2 构建系统进化树所用24 个菌株及48 个序列号
2 结果与分析
2.1 根腐病发病症状
用分离纯化的菌株接种后,草莓短缩茎、根部均染病。病原菌先侵染须根,须根呈水渍状,2~3 d 后叶片褪绿呈暗绿色并萎蔫,由外围叶片向内部叶片发展。随着病菌进一步侵染根部,根部变黑,茎基红褐色,直至全株枯死。近地果实亦发病,初呈水渍状,后变褐色至微紫色,果实软腐,潮湿时长满白色的浓密棉絮状菌丝。
2.2 致病性测定
通过对不同部位接种的致病性测定结果观察可知,在接种病原菌的健康草莓根部产生了病原菌菌丝,沾取菌丝进行病原菌培养,挑取菌丝置于显微镜下观察,发现重新培养的病原菌与原感染根腐病植株分离培养的病原菌菌落、菌丝等形态相同,根据柯赫氏法则判断,确定该病原菌为草莓根腐病的致病菌。
2.3 病原菌的形态学鉴定
病菌在PDA 培养基上25 ℃培养7 d,菌落直径达3.5~4.5 cm,质地棉毛状,橘黄色,气生菌丝发达,浅黄色到黄褐色,边缘金黄色,质地致密,边缘规则,产生同心圆环带,无渗出液。菌落背面浅黑棕色、边缘黄褐色(图1)。用高倍镜(10 × 20 倍镜)观察病原菌孢子形态。分生孢子梗简单或复杂,40~160 μm,通常着生于气生菌丝侧面或顶端,单一,不分枝或少分枝(图2)。分生孢子有大小两种,大型分生孢子丰富,圆柱形或棍棒状,直或稍弯,(19~38)μm ×(3~7)μm。初步判断为土赤壳属病原菌。

图1 病原菌菌落特征(7 d,PDA)
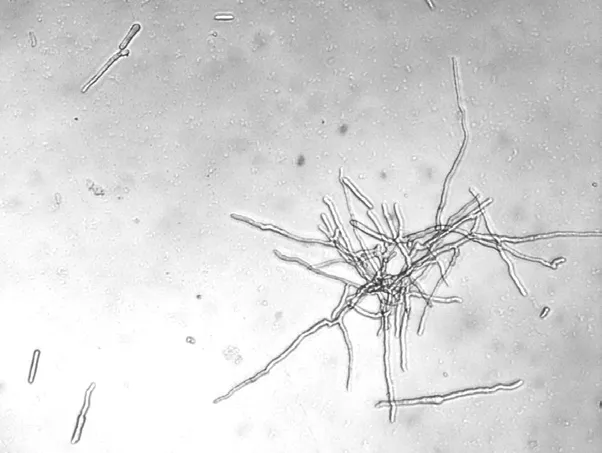
图2 病原菌分生孢子梗
2.4 病原菌的分子生物学鉴定
首先采用真菌ITS 区域通用引物ITS1 和ITS4对分离得到的菌株的ITS DNA 序列进行扩增,获得1 条大小约500 bp 的DNA 片段。对该片段进行测序,并在GenBank 上进行Blast 分析,比对结果表明该病原菌菌株与土赤壳属具有同源性。再基于-和基因特异引物进一步进行PCR扩增,获得800 bp 和500 bp 左右的条带(图3)。对扩增产物进行测序,片段大小为843 bp 和505 bp,将测序结果登陆GenBank 进行在线BLAST 核酸同源性比对,分别下载与-和序列最相近的土赤壳属序列以及柱孢属和新丛赤壳属序列共48 条,将该待测菌株-基因测序结果序列编号为ZJ16-1,基因测序结果序列编号为ZJ16-2,分别以为外类群利用系统发育分析软件对2 个不同基因测序序列进行分析,采用邻接法构建系统进化树;系统进化树显示(图4),基于-和基因的两个进化树分析结果一致,具有特征条带的菌 株 与的CBS 112593 菌株的自展支持率均为100%,据此可以进一步确定待测病原菌菌株为。
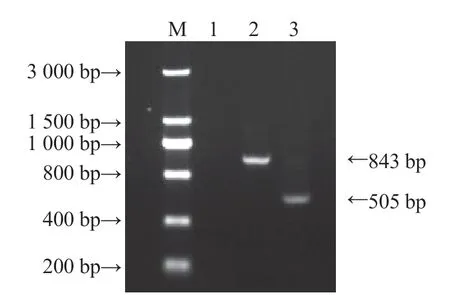
图3 基于EF-1α 和Histone H3 基因引物序列的PCR扩增结果

图4 基于EF-1α 和Histone H3 基因的系统进化树分析
3 讨论与结论
国外近两年有关于土赤壳属的4 个菌种、、、能 够引起厄瓜多尔地区的安第斯黑莓黑根腐病的报道(Jessica et al.,2019)。国内关于土赤壳属菌种的研究均集中在健康植株上(Zhuang,2013;王玉君等,2015),未见在发病植株上发现该属病原菌的报道,笔者首次在新疆地区发病植株上发现土赤壳属病原菌菌种,并通过筛选特异分子序列的方法,运用分子生物学手段对草莓根腐病病原菌进行鉴定,鉴定方法快速、准确。目前,对草莓病害病原菌的判断多基于形态特征和单一序列鉴定,而形态学鉴定耗时较长,有些类群缺乏足够的鉴定特征。同时,使用1 个单一DNA 序列也难以成功鉴定菌种。目前常用的多基因序列分析,可实现对病原菌进行相对快捷、准确的菌种鉴定。但多基因序列分析需要较繁杂的分子检测程序,对操作人员的技术水平和试验条件的要求较高。
传统检测方法中基于形态学特征难以判断病原菌种类,而传统病原菌分子生物学鉴定引物为ITS 序列,其保守性过高,对病原菌分类结果判断不准确,且不易将病原菌确定到某个种。本试验选择组蛋白H3 基因()结合延长因子1(-)基因进行鉴定,在草莓根腐病病原菌2个特异区段的基础上设计引物,获得草莓根腐病病原菌一组特异分子检测引物序列。一般情况下,通过PCR 扩增产物的电泳特征条带即可判断是否感染了目标菌,无需进行后续的基因测序和系统进化树分析,引物特异性高,检测准确,使得检测程序大大简化,方便快捷。
本试验为首次从发病草莓根部短缩茎分离到根腐病致病菌种,在此之前未见关于该菌种在我国草莓及其他作物上致病的报道。本试验提示并验证了该菌种为草莓根腐病致病菌,扩宽了草莓根部病害病原菌检测范围,对于综合防治草莓根腐病具有重要意义,且为该病害的准确识别及草莓抗病育种提供了理论依据。针对草莓根腐病新病原菌的发现,在病菌生物学特性方面尚需全面深入研究,病菌寄主范围尚待测定,病菌侵染特性及其机制有待深入研究,以便为生产上病害防治提供系统的理论依据。
