施用不同根际促生菌对辣椒生长和土壤微生物群落的影响
2022-03-10史亚晶史大伟王媛媛吴凤芝周新刚
史亚晶 史大伟 王媛媛 吴凤芝 周新刚*
(1 东北农业大学园艺园林学院,黑龙江哈尔滨 150030;2 中国铁路哈尔滨局集团有限公司农林管理所,黑龙江哈尔滨 150000)
植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)是自由生活在土壤中或附生于植物根际的一类可促进植物生长、防治病害、增加作物产量、改良土壤的细菌(Helman et al.,2012;Goswami et al.,2016)。多数PGPR 可通过固氮、产生铁载体、溶解矿物不溶性磷酸盐、产生植物激素如吲哚乙酸、合成1-氨基环丙烷-1-羧酸脱氨酶等促生长特性(Christine &Marco,2005;Wang et al.,2018),增加土壤养分供应,提高植物根表面积和对养分的吸收能力,以及改善土壤状况等方式影响作物的生长(Ortíz et al.,2008)。不同PGPR 菌株具有不同的促生特性,对植物的促生效应亦不同(Paungfoo et al.,2019)。
根际微生物群落的多样性和稳定性对植物生长以及生态系统的可持续性有重要作用(Yao &Allen,2006;葛诗蓓 等,2020)。土壤微生物群落的组成与其功能有着紧密的联系,土壤微生物群落组成的变化可能会改变群落的功能,从而对植物的适应性产生反馈作用,包括对植物的营养吸收、非生物及生物胁迫的耐受性(Sa et al.,2019)。土壤中外源施加的根际促生菌可以在植物根际存活增殖(Mandyal et al.,2012),同时会影响土壤中的常驻微生物,增强或抑制某些根际微生物的种群结构(Zhao et al.,2017)。本试验以新羊角和辣妹子2种辣椒为试材,选用5 种PGPR 菌株,通过比较各菌株对辣椒植株生长、叶绿素和养分含量的影响,筛选出对辣椒促生效果较好的菌株;并通过高通量测序技术分析了辣椒根际微生物群落组成,研究PGPR 对根际微生物的影响,以期为PGPR 在辣椒生产上的应用提供理论依据。
1 材料与方法
1.1 供试PGPR 菌株的培养与菌剂制备
供试PGPR 菌株为P1 贝莱斯芽孢杆菌()、P2 暹罗芽孢杆菌()、P23特基拉芽孢杆菌()、P33 枯草芽孢杆菌()、P8 铜绿假单胞菌(),均由东北农业大学设施蔬菜生理生态研究室提供。菌剂制备参考Khan 等(2019)的方法。5 种PGPR 菌株分别接种于LB 液体培养基中,收集对数生长期(OD=1)的细胞,4 ℃、7 000 r ·min温和旋转3 min,用0.9% NaCl 溶液洗涤3 次,然后重悬浮于无菌水中。
1.2 供试辣椒种子的灭菌与催芽
供试辣椒品种为前期试验筛选出的对PGPR 菌株响应效果较好的新羊角(Y)和辣妹子(L)(由哈尔滨市农信种子公司提供)。挑选饱满、无破损的种子,在10%漂白剂中浸泡30 min 进行表面灭菌,用灭菌水冲洗干净,55 ℃水浴30 min 后置于25~30 ℃恒温箱中催芽,出芽率达到80%后播种于育苗盘中。
1.3 盆栽试验
2019 年4—6 月在东北农业大学园艺站人工气候室中进行苗期盆栽试验。
以蛭石为栽培基质,对5 种PGPR 菌株进行筛选试验。分别对2 个辣椒品种进行接种PGPR 菌株处理和不接种PGPR 菌株处理(CK),试验共12个处理,每个处理重复3 次,每重复5 盆,共180 盆。筛选出P1 菌株,以普通大田黑壤土为栽培基质进行试验。分别对2 个辣椒品种进行接种P1 菌株处理和不接种P1 菌株处理(CK),试验共4 个处理,每处理重复3 次,每重复5 盆,共60 盆。
将具2 片真叶的辣椒幼苗定植于底部有孔的花盆(直径8 cm、高7 cm)中,每盆1 株,栽培期间每盆每次浇灌50 mL Hoagland’s 营养液,每隔24 h 浇灌1 次。试验期间随机更换盆栽的位置以减少试验误差。幼苗3~4 片真叶时,选取长势一致的盆栽苗,分别取各菌株悬浮液10 mL 均匀浇灌辣椒根围基质和土壤,菌液浓度为1.0 × 10CFU · mL(Yao &Allen,2006),对照浇灌10 mL 的无菌水。
1.4 植株生理指标的测定
不同PGPR 菌株处理20 d 后,分别测定辣椒植株株高、全株干质量、叶片叶绿素含量及植株全氮和全磷含量。用清水冲洗粘附在根系上的基质和土壤至干净,吸水纸擦干后,用米尺测量植株茎基部至主茎生长点之间的距离即为株高;取植株中部全展叶,采用分光光度法测定叶片叶绿素a、叶绿素b 和总叶绿素含量;将洗净的植株放入烘箱,迅速升温至105 ℃,保持30 min,然后降温至80 ℃将样品烘干至恒重,用电子天平称重;将烘干的植株样品研磨,过0.3 mm 筛,再进行HSO-HO高温消煮,采用SKALAR 流动分析仪测定植株全氮和全磷含量。
1.5 辣椒根际土壤的收集及其菌落DNA 提取
P1 菌株处理20 d 后将辣椒植株根部从花盆中轻轻取出,用手摇晃去除根系上的土壤,然后用无菌刷刷取紧贴根系的根际土壤(Zhou et al.,2019),每5 株的根际土壤混样,-80 ℃保存备用。根际土壤菌落DNA 的提取采用PowerSoil DNA Isolation Kit(MO BIO Laboratories,CA,USA)试剂盒。
1.6 根际土壤细菌和真菌的高通量测序
在Illumina MiSeq 平台上通过高通量测序来估计辣椒根际细菌和真菌群落组成。使用F515/R907引物扩增细菌16S rRNA 基因的V4~V5 区(Muyzer et al.,1933),用FITS1/FITS2引物对真菌rRNA基因的ITS1 区域进行扩增(Zhou et al.,2017)。PCR 扩增产物使用1%琼脂糖凝胶电泳鉴定和分离条带,使用DNA 胶纯化试剂盒(Agarose Gel DNA Purificaion Kit,TakaRa)对PCR 产物进行纯化。将纯化后的产物送上海美吉生物医药科技有限公司进行测序。
1.7 数据分析
原始试验数据采用Microsoft Word、Excel 2016软件进行整理;使用IBM SPSS Statistics 21.0 软件进行数据分析;采用Tukey’s HSD 进行方差分析,使用GraphPad Prism 5 软件作图。
高通量数据分析:alpha 多样性分析使用QIIME 计算香浓指数,使用“edgeR”包的负二项式广义对数线性模型的方法筛选与PGPR 处理的样品间的差异OTU(Robinson et al.,2010)。使用R 软件的“vegan”包基于Bray-Curtis 距离矩阵进行主坐标分析(PCoA)(Jin et al.,2019)。并采用PERMANOVA(也称Adonis)分析PGPR 处理、辣椒品种以及交互作用对微生物群落组成的影响。所有序列均以生物项目登录号PRJNA675151 收录在NCBI-Sequence Read Archive 中。
2 结果与分析
2.1 不同PGPR 菌株对辣椒生长的影响
不同PGPR 菌株悬浮液浇灌20 d 后,除P8 菌株处理的辣妹子株高和P23 菌株处理的辣妹子干质量与对照不显著外,各菌株均较对照显著提高了2个辣椒品种的株高和干质量,其中P1 菌株的促进作用最强(图1)。
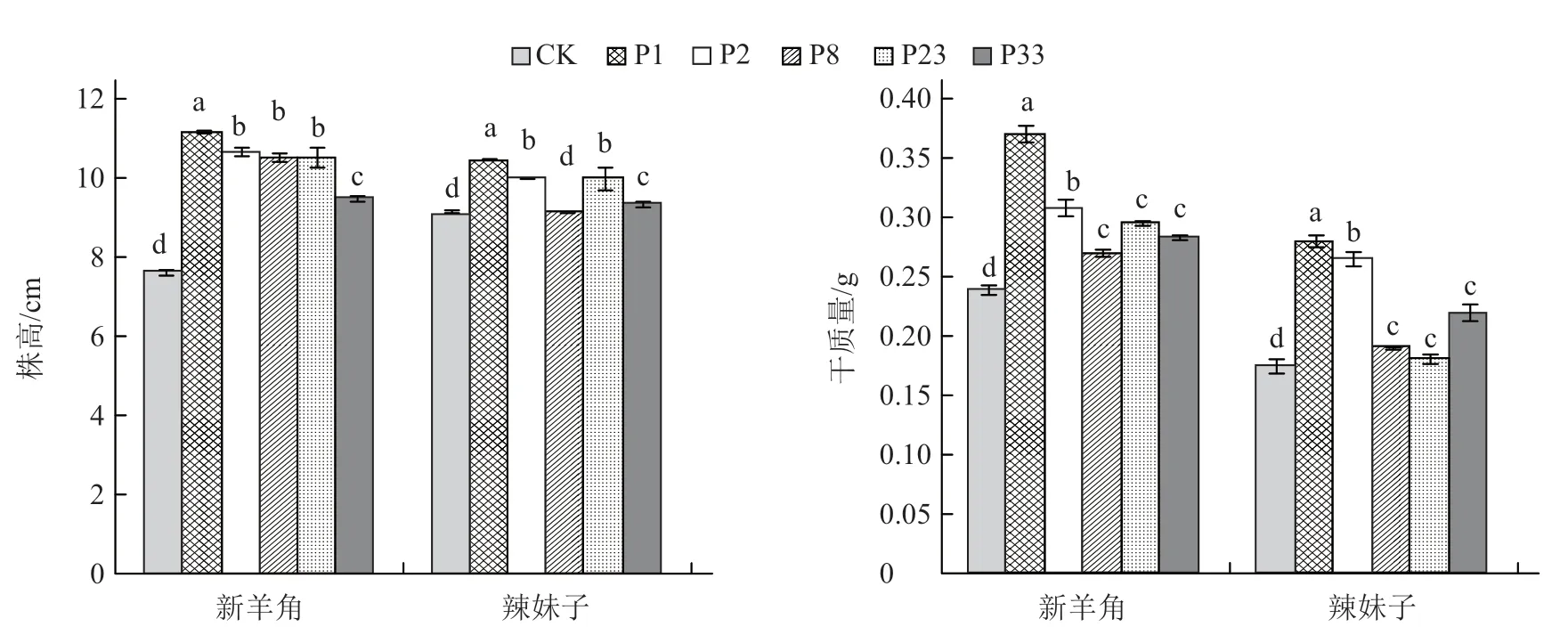
图1 不同促生菌对辣椒株高和干质量的影响
与对照相比,各菌株处理均显著提高了2 个辣椒品种的叶片叶绿素含量和植株全氮、全磷含量。其中,P1 菌株处理显著高于其他4 种菌株处理,促进作用最强(图2)。因此,本试验后续将针对P1 菌株对辣椒根际微生物的影响进行研究。
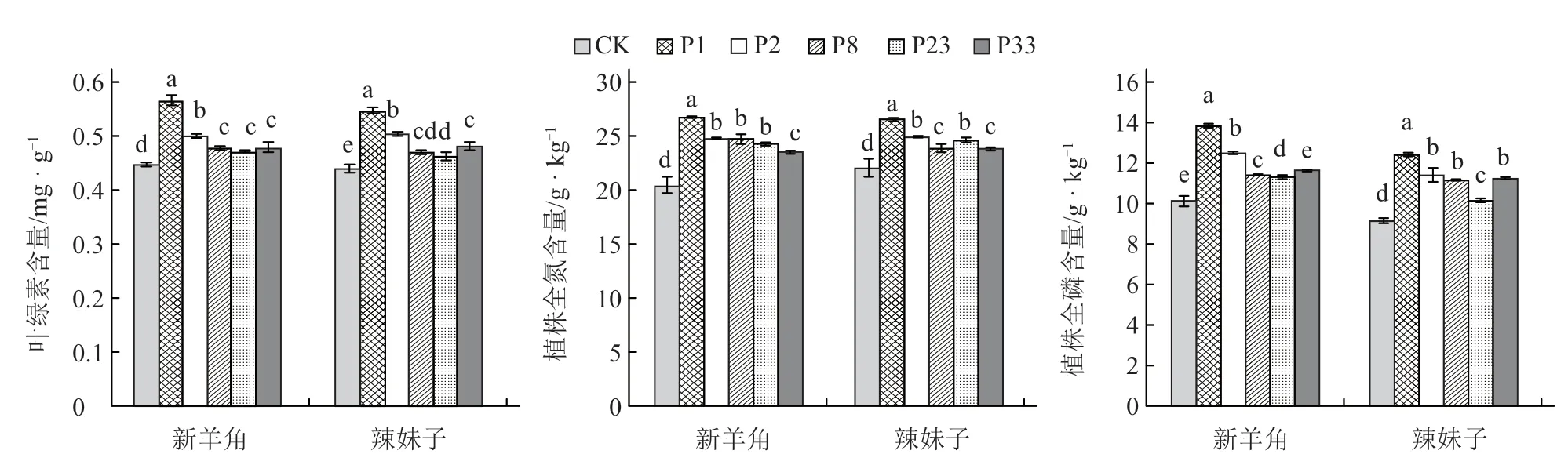
图2 不同PGPR 对辣椒叶片叶绿素含量和植株全氮、全磷含量的影响
2.2 P1 菌株对辣椒生长及根际微生物的影响
2.2.1 P1 菌株对辣椒生长的影响 P1 菌株接种20 d 后,与对照相比,P1 菌株除了对辣妹子的株高无显著影响外,均显著或极显著提高了两种辣椒的株高和干质量(图3)。

图3 P1 菌株对辣椒株高和干质量的影响
2.2.2 P1 菌株对辣椒根际微生物群落多样性的影响 P1 菌株处理对2 个辣椒品种根际细菌和真菌群落alpha 多样性指数(OTU 数量和香浓指数)无显著影响(图4)。辣椒根际细菌PCoA 显示,接菌与未接菌样本均被分开。经Adonis 分析表明,P1 菌株对辣椒细菌群落结构有显著影响(PERMANOVA,=0.311,=0.001),辣椒品种及其与促生菌处理的交互作用对细菌群落结构无显著影响(PERMANOVA,Variety,=0.108,=0.091;Trt × Variety,=0.056,=0.55);而P1 菌株、辣椒品种及其交互作用对根际真菌结构有显著影响(PERMANOVA,Trt,=0.149,=0.001,Variety,=0.109,=0.034;Trt ×Variety,=0.116,=0.022)(图5)。

图4 P1 菌株对辣椒根际细菌和真菌OTU 数量和香浓指数的影响

图5 P1 菌株对辣椒根际细菌和真菌多样性的影响
2.2.3 P1 菌株对辣椒根际微生物群落细菌门和真菌纲水平相对丰度的影响 与对照相比,P1 菌株处理使2 个辣椒品种根际土壤细菌厚壁菌门和硝化螺旋菌门的相对丰度显著提高;新羊角根际土壤细菌酸杆菌门和浮霉菌门的相对丰度显著降低(图6-a)。与对照相比,P1 菌株处理使新羊角根际土壤真菌中的散囊菌纲的相对丰度显著提高,伞菌纲的相对丰度显著降低(图6-b)。
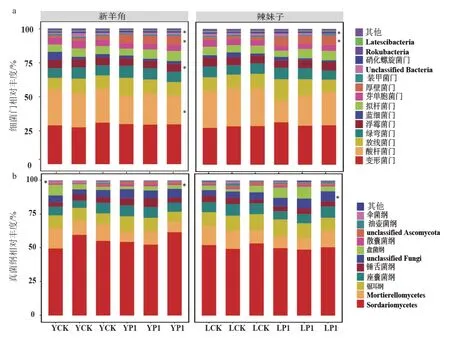
图6 P1 菌株对辣椒根际土壤主要细菌门和真菌纲相对丰度的影响
2.2.4 P1 菌株对辣椒根际微生物OTU 水平相对丰度的影响 P1 菌株处理提高了新羊角辣椒根际16 个细菌OTU 的相对丰度(图7-a),其所在的门分别为拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)(图7-b),主要为芽孢杆菌属()、溶杆菌属()、黄杆菌属()、军团菌属();降低了4 个细菌OTU 的相对丰度(图7-a),其所在的门分别为变形菌门(Proteobacteria)和蓝细菌门(Cyanobacteria)(图7-b),主要为甲基娇美杆菌属(Methylotenera)、鞘脂菌属()、新鞘脂菌属()。
P1 菌株处理提高了辣妹子辣椒根际20 个细菌OTU 的相对丰度(图7-c),其所在的门分别为拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)和变形菌门(Proteobacteria)(图7-d),主要为芽孢杆菌属()、溶杆菌属()、黄杆菌属()、硝化螺旋菌属()、原囊菌属()、假黄色单胞菌属()、假单胞菌属();降低了10 个细菌OTU 相对丰度(图7-c),其所在的门分别为酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)(图7-b),所在的属分别为拟孢囊菌属()、芽孢杆菌属()。
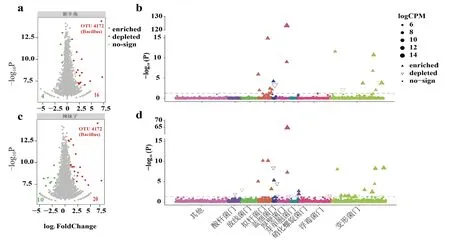
图7 P1 菌株对辣椒根际细菌OTU 相对丰度的影响
P1 菌株处理提高了新羊角辣椒根际的3 个真菌OTU 的相对丰度(图8-a),其所在的门分别为子囊菌门(Ascomycota)和未分类真菌(图8-b);降低了10 个真菌OTU 的相对丰度(图8-a),其所在的门分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、被孢霉门(Mortierellomycota)、油壶菌门(Olpidiomycota)和未分类真菌(图8-b),主要为柄孢壳属()、被孢霉属()、枝鼻菌属()、镰刀菌属()、小壶菌属()。P1 菌株处理提高了辣妹子辣椒根际4 个真菌OTU 的相对丰度(图8-c),其所在的门分别为子囊菌门(Ascomycota)和未分类真菌(图8-d);降低了5 个真菌OTU 的相对丰度(图8-c),其所在的门分别为子囊菌门(Ascomycota)、被孢菌门(Mortierellomycota)和未分类真菌(图8-d),主要为被孢霉属()和。
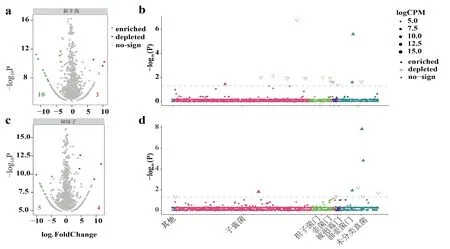
图8 P1 菌株对辣椒根际真菌OTU 相对丰度的影响
3 结论与讨论
不同PGPR 菌株的促生作用不同,它们可以通过直接和间接机制促进植物生长,并对植物生长发育、叶片光合性能和养分利用效率等生理功能有积极的影响(聂鑫和王伟,2017)。前人研究表明,PGPR 可以显著提高辣椒植株的株高、干质量和叶绿素含量(Mandyal et al.,2012;Zhao et al.,2019);PGPR 菌剂灌根后辣椒的株高、干质量均显著高于未接种的对照植株(Wang et al.,2018;Abbaszadeh et al.,2019);PGPR 菌株还可以显著增加辣椒叶片的叶绿素含量(吕雅悠 等,2015)。本试验中,5 种PGPR 菌株均显著提高了新羊角和辣妹子的叶片叶绿素含量,而且P1、P2、P33 菌株显著提高了2 个辣椒品种的株高和干质量,与前人研究结果一致。PGPR 可以使花生植株全氮、全磷含量显著提高(韩丽珍 等,2019),本试验中5种PGPR 菌株均显著提高了2 个辣椒品种的植株全氮、全磷含量,这可能是因为PGPR 可以通过溶磷、固氮和解钾的方式,促进植物对养分的吸收(Hahm et al.,2012;Sabnis &Nagraj,2015),进而增加了营养物质在叶片中的吸收和转运,促进叶绿素合成和光合作用,进一步促进植株生长。有研究表明5种PGPR 菌株具有产生吲哚乙酸(IAA)、ACC 脱氨酶活性、铁载体、固氮、解磷等功能,能积极促进植物吸收养分(Meng et al.,2016;聂鑫和王伟,2017;林志楷和林文珍,2019)。
作物品种也是影响PGPR 发挥有益功能的主要因素(Javed &Arshad,1997;Meyer et al.,2010)。例如,玉米杂交种能够选择其亲本不能选择的特定菌株,从而促进植株生长(Christine &Marco,2005);不同小麦品种对PGPR 的响应效果也存在差异(Akbari et al.,2020)。本试验结果表明,同一菌株对不同辣椒品种的促生效果也不同。这可能是由于不同品种根系分泌物的种类和含量存在差异,而这些根际分泌物又可以吸引不同的根际微生物并定殖到植物根际(Maria et al.,2005;Hao et al.,2010)。根际促生菌在植株根际的高效定殖,是发挥各种对植物有益功能的重要前提与否还需进一步研究验证。
土壤微生物群落组成的变化会影响植物的生长与健康(Mendes et al.,2014)。根际细菌作为生物菌剂可以在植物根际存活增殖,也可以诱导植物根际微生物群落发生变化(Thokchom et al.,2017)。本试验结果表明,P1 菌株处理显著改变了辣椒根际细菌和真菌群落结构,这与Ke 等(2019)将接种在玉米根际后显著改变土壤细菌群落结构的研究结果一致。植物根际可以通过增加有益微生物的相对丰度或减少植物病原体的相对丰度,从而促进植物生长(Bever et al.,2012)。本试验经高通量测序分析表明,接种P1 菌株使辣椒根际拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)的相对丰度显著提高,这4 种细菌门的多数成员通常表现出促进植物生长的特性(Zhang et al.,2019)。其中拟杆菌门(Bacteroidetes)种群数量是土壤健康的重要指标之一,具有潜在的生物防治能力(Zheng et al.,2020);蓝细菌门(Cyanobacteria)的多数成员能够通过增加可溶性磷酸盐在土壤中的积累、提高生物固氮作用的效率、增加根际可溶性铁和锌等物质的含量进而促进植物生长(Elkoca et al.,2007);厚壁菌门(Firmicutes)的成员,如芽孢杆菌能够分泌抗生素或抗菌蛋白,是众所周知的生物防治剂(Ahimou et al.,2000)。P1 菌株还可使辣椒根际土壤子囊菌门(Ascomycota)显著富集,其中子囊菌是土壤微生物群落结构中最重要的真菌(Hibbett et al.,2007)。
本试验中,P1 菌株对新羊角和辣妹子的植株生长、叶片叶绿素含量、氮和磷吸收的促进效果较好,并且改变了辣椒根际细菌和真菌群落结构,提高了辣椒根际某些有益菌群的相对丰度。本试验主要采用盆栽方式,还需进一步研究P1 菌株在田间对植株的促生效果。
