基于SSR 标记和表型性状构建苦瓜核心种质的研究
2022-03-10崔竣杰程蛟文胡开林
崔竣杰 程蛟文 曹 毅 胡开林*
(1 佛山科学技术学院食品科学与工程学院,广东佛山 528225;2 华南农业大学园艺学院,广东广州510642)
种质资源的收集与保存一直以来受到世界各国的高度重视。据估计,全球大约有1 300 个基因库,已保存大约600 万份种质材料(Ortiz Ríos,2015)。然而,对种质资源的有效评价与利用仍然相对落后,目前仅有小部分用于了遗传改良(Glaszmann et al.,2010)。对此,建立核心种质库并优先对其进行评价和利用将会提高种质资源的利用效率和管理水平(徐海明 等,2000)。
随着分子生物学研究的进步,利用分子标记结合表型性状构建核心种质已经取得较好成效。核心种质的抽样通常采用M 策略(maximization strategy)、随机抽样法或R策略(random strategy)、遗传距离法等。采用M 策略能够最大限度地保留等位基因数量(Cipriani et al.,2010;郭大龙 等,2012),利用这一方法已经构建了黄瓜(Lv et al.,2012)、葡萄(郭大龙 等,2012)、橄榄(Muzzalupo et al.,2014)、杜仲(李洪果 等,2018)、平菇(Li et al.,2019)等的核心种质;采用随机抽样法或R 策略有利于保持原始种质的遗传多样性结构(Hu et al.,2000),并在番茄核心种质构建中显示对原始种质的表型代表性最好(邓学斌等,2015);采用遗传距离法能抽取出具有最大遗传距离的种质材料(Wang et al.,2007),利用这一方法已经构建了棉花(徐海明 等,2004)、苎麻(栾明宝 等,2010)、苹果(刘遵春 等,2010)等的核心种质。
苦瓜(L.)是我国普遍种植和消费的重要瓜类蔬菜。然而由于苦瓜起源于非洲(Schaefer &Renner,2010),种质资源主要分布在非洲及亚洲的热带地区,因此我国的苦瓜种质资源相对贫乏且遗传背景狭窄(赵秀娟 等,2013;Cui et al.,2020)。为了拓宽苦瓜遗传背景,最近数年笔者及研究团队先后从非洲、美洲及亚洲等16个国家广泛收集了逾200 份苦瓜种质资源,经过研究发现收集于中国的苦瓜种质资源和南亚诸国如印度、巴基斯坦、孟加拉国等存在明显的地理多样性,来自于东南亚的苦瓜种质资源的遗传多样性介于上述两者之间(Cui et al.,2017,2020)。
有关苦瓜核心种质的构建,仅见刘子记等(2017)基于5 个表型性状从中国、日本、泰国、斯里兰卡和印度5 个国家收集的154 份苦瓜种质资源中抽取出46 份核心种质;而且利用分子标记结合表型性状构建苦瓜核心种质还鲜见报道。因此本试验以地理来源多样的184 份苦瓜种质资源为材料,利用苦瓜21 对SSR 标记和9 个表型性状数据构建苦瓜核心种质,并对核心种质与原始种质进行差异比较评价,以期为苦瓜种质资源保存和利用提供参考。
1 材料与方法
1.1 试验材料
以收集于13 个国家、世界蔬菜研究中心(WorldVeg)和种子公司的184 份苦瓜种质为供试材料(表1),其中来自中国的种质64 份、印度的21 份、越南的16 份、孟加拉国的11 份、菲律宾的10 份、尼泊尔的9 份、泰国的8 份、柬埔寨的6 份、坦桑尼亚的5 份、马来西亚的4 份、印度尼西亚的3 份、斯里兰卡的3 份、巴基斯坦的2 份、WorldVeg 的12 份和种子公司的10 份。

表1 184 份苦瓜种质材料的地理来源(Cui et al.,2017)
2014 年秋季和2015 年春季在华南农业大学增城教学基地分别对苦瓜9 个表型性状进行调查,其中包括第1 雄花节位(first male flower node,FMFN)、第1雄花开花天数(days to first male flower opening,DFMO)、第1雌花节位(first female flower node,FFFN)、第1雌花开花天数(days to first female flower opening,DFFO)、子房长度(ovary length,OL)、子房直径(ovary diameter,OD)、果长(fruit length,FL)、果径(fruit diameter,FD)和棱宽(width of ridge,WR)。
1.2 分子标记及基本数据分析
基于Cui 等(2017)的苦瓜SSR 标记(表2)及基因型数据,2021 年对184 份苦瓜种质资源的遗传多样性参数进行计算,利用PopGen 32 软件计算观测等位基因数(observed number of alleles,N)、有效等位基因数(effective number of alleles,N)和Shannon 指数(shannon’s information index,I);利用PowerMarker V3.25软件计算杂合性(heterozygosity,H)、基因多样性(gene diversity,GD)和多态性信息含量(polymorphic information content,PIC);利用NTsys 2.10 软件进行主坐标分析。
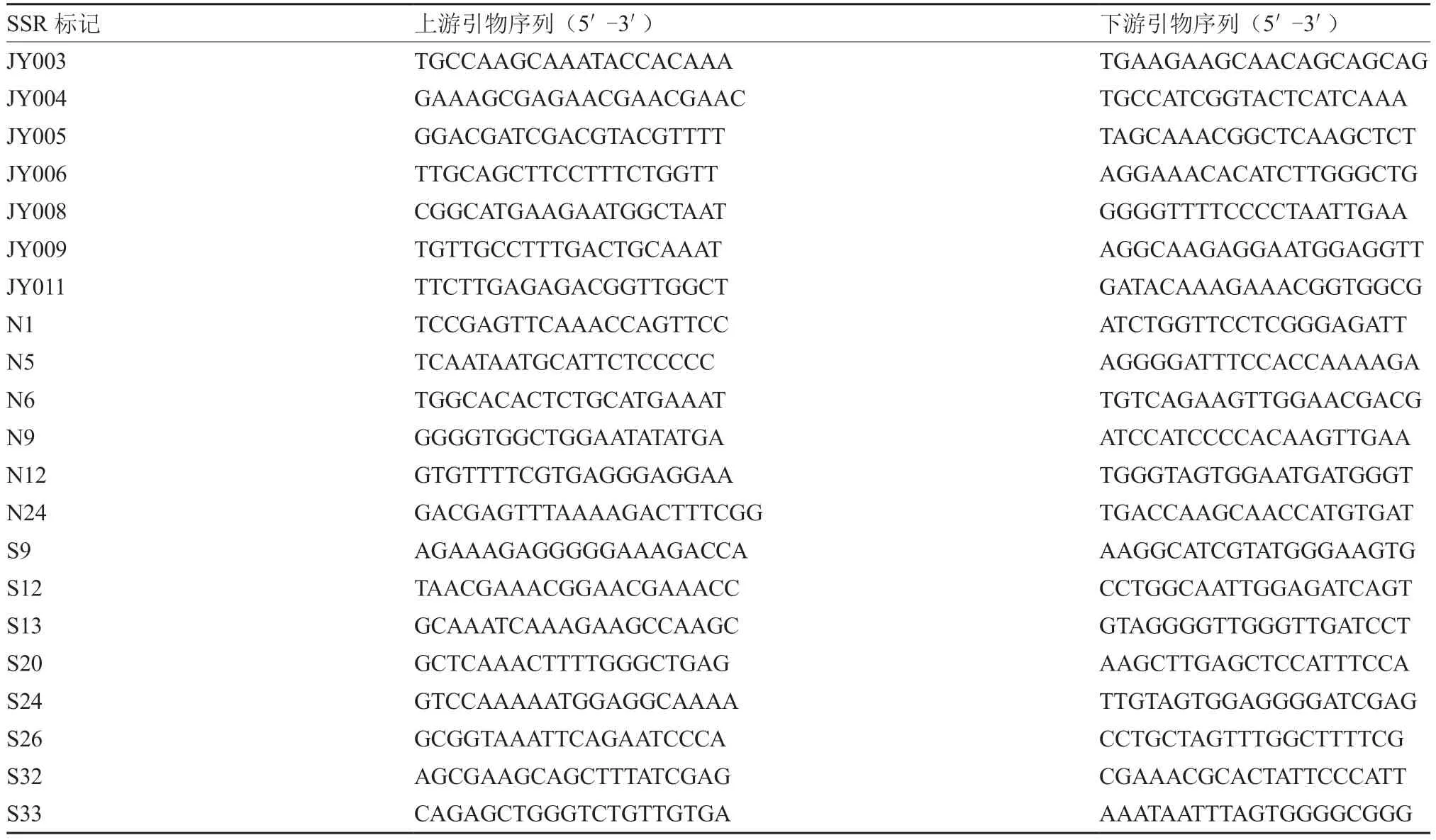
表2 21 对苦瓜SSR 标记引物序列(Cui et al.,2017)
1.3 核心种质构建
以等位基因数目最大化(M 策略)为原则,利用Core Finder 软件对SSR 数据进行分析,抽取核心种质,参数interations 和random seed 分别设置为100 和1 000 000。按照多次聚类随机取样法,利用QGAStation 软件对表型数据进行分析,按Core Finder 的抽取结果抽取相当比例的样本。然后,合并Core Finder 和QGAStation 抽取的样本作为核心种质,剩余的种质作为保留种质。
1.4 核心种质评价及分子身份信息构建
对核心种质和原始种质的遗传多样性参数(N、N、I、H、GD、PIC)进行检验来评价核心种质的基因型代表性。再根据Hu 等(2000)的评价方法,对核心种质和原始种质表型数据的均值进行检测,对二者的方差进行检测,通过计算均值差异百分率(mean difference percentage,MD%)、方差差异百分率(variance difference percentage,VD%)、极差符合率(coincidence rate,CR%)和变异系数变化率(variable rate,VR%)来评价核心种质的表型代表性。4 个参数的计算公式如下:
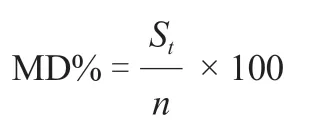
S为核心种质和原始种质中均值存在显著差异(α=0.05)的性状数量,为性状总数。
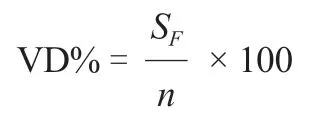
S为核心种质和原始种质中方差存在显著差异(α=0.05)的性状数量,为性状总数。
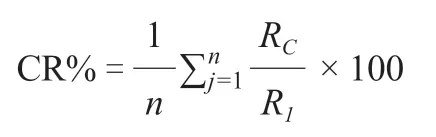
R表示核心种质的极差,R表示原始种质的极差,为性状总数。
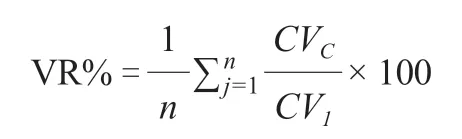
CV表示核心种质的变异系数,CV 表示原始种质的变异系数,为性状总数。
按多态性产物由小到大的顺序进行编号,将SSR 电泳谱带转化为数字指纹图谱并以此构建苦瓜核心种质的分子身份信息。根据公式=1/2计算指纹图谱出现的概率,为等位基因的数目(吴渝生等,2003)。
2 结果与分析
2.1 苦瓜原始种质的表型变异及遗传多样性
对184 份苦瓜原始种质的9 个表型性状数据进行统计,结果表明(表3),棱宽的变异系数最高,为50.90%,第1 雌花开花天数的变异系数最低,为12.61%,其余7 个表型性状的变异系数介于两者之间。
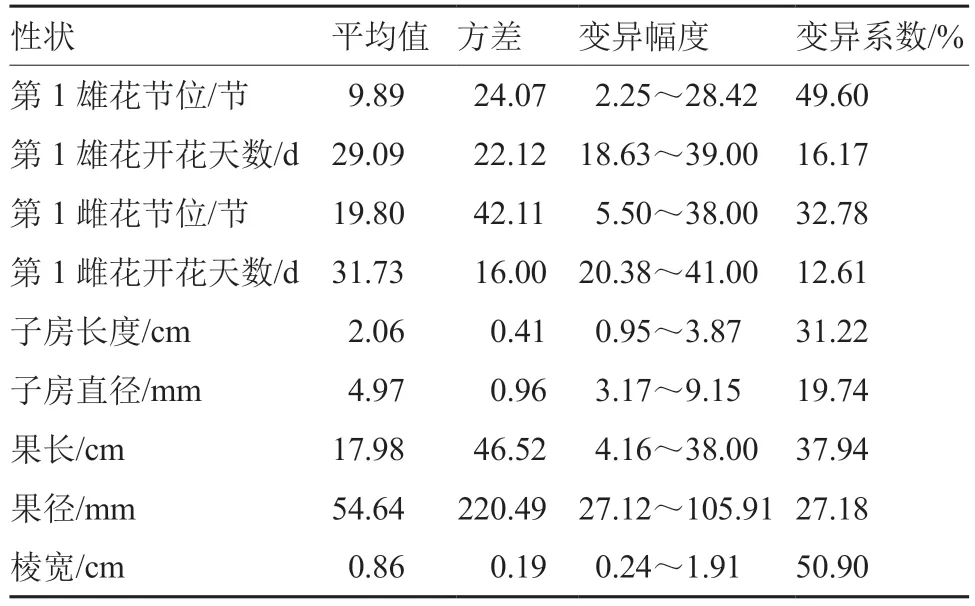
表3 184 份苦瓜原始种质材料的表型变异
利用21 对苦瓜SSR 标记对184 份苦瓜原始种质进行遗传多样性分析,结果表明(表4),SSR标记在原始种质中平均观测的等位基因数为5.10,平均有效等位基因数为2.49,平均Shannon 指数为1.02,平均杂合性为0.03,平均基因多样性为0.55,平均多态性信息含量为0.48。
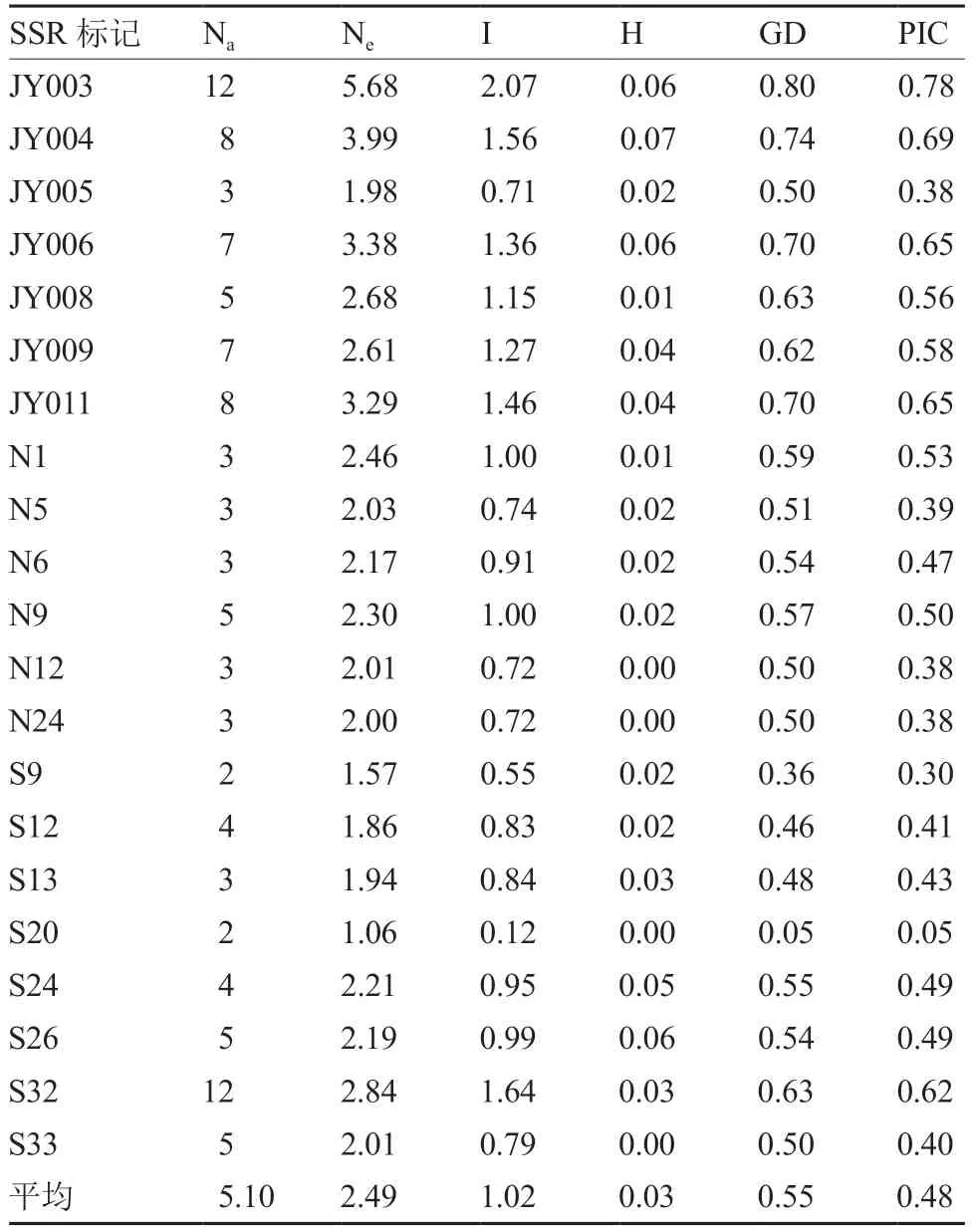
表4 184 份苦瓜原始种质材料的遗传多样性
2.2 苦瓜核心种质的抽取
利用Core Finder 软件,采用M 策略进行抽样,图1 显示当抽取样品数量为19 份时,等位基因保留比例已接近100%。因此,通过SSR 基因型数据从184 份苦瓜原始种质中抽取出19 份核心种质(表5),抽样比例为10.33%。然后,再利用QGAStation 软件,采用随机抽样法通过9 个表型数据抽取相似比例的样本,共抽取出18 份核心种质(表5)。在两种抽样方式中有3 份种质资源(编号20、58、60)重叠。综合两种抽样的结果,最终获得34 份核心种质(抽样比例为18.48%),其中来自10 个国家的有31 份,来自WorldVeg 的有2 份,来自种子公司的有1 份(表5)。图2 的主坐标分析结果显示,苦瓜34 份核心种质较为均匀地分布在184 份原始种质中。
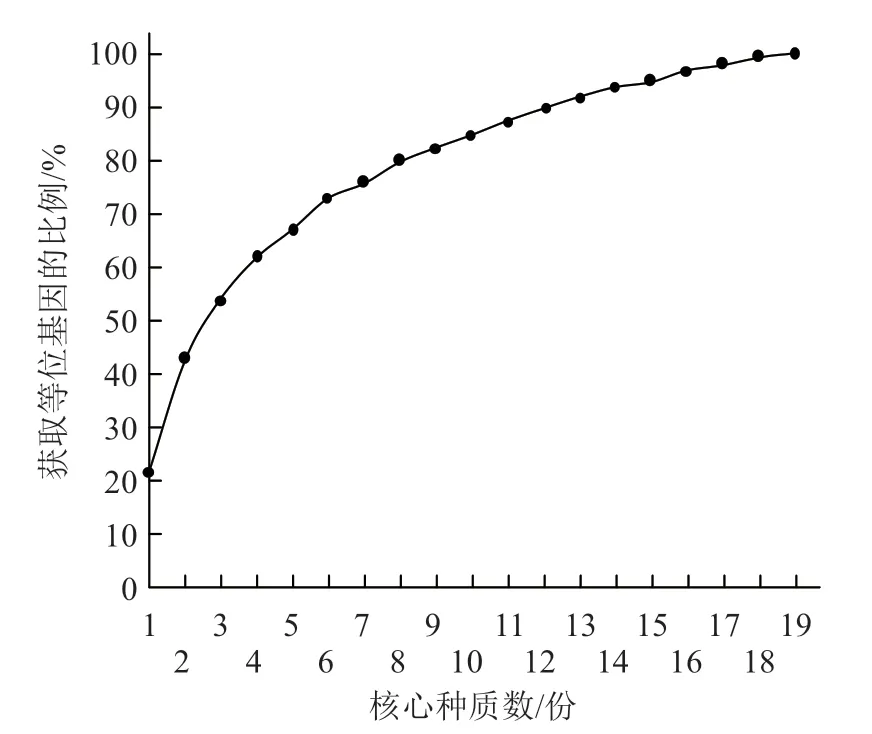
图1 Core Finder 抽取苦瓜核心种质数与等位基因保留比例的变化关系
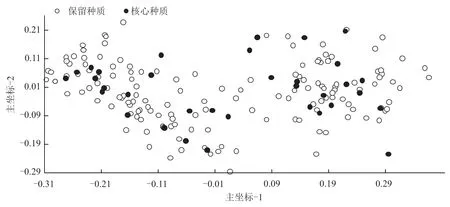
图2 苦瓜核心种质和保留种质的主坐标分布
表5 34 份苦瓜核心种质材料的基本信息
2.3 苦瓜核心种质的评价与分析
对构建的苦瓜34 份核心种质的基因型代表性进行评价,结果表明(表6),该核心种质保留了原始种质93.46%的等位基因。测验结果显示,利用21 个SSR 位点对34 份核心种质进行分析所获得的6 个遗传多样性参数与184 份原始种质均没有显著性差异。初步认为,34 份核心种质能够代表184 份原始种质的遗传多样性。
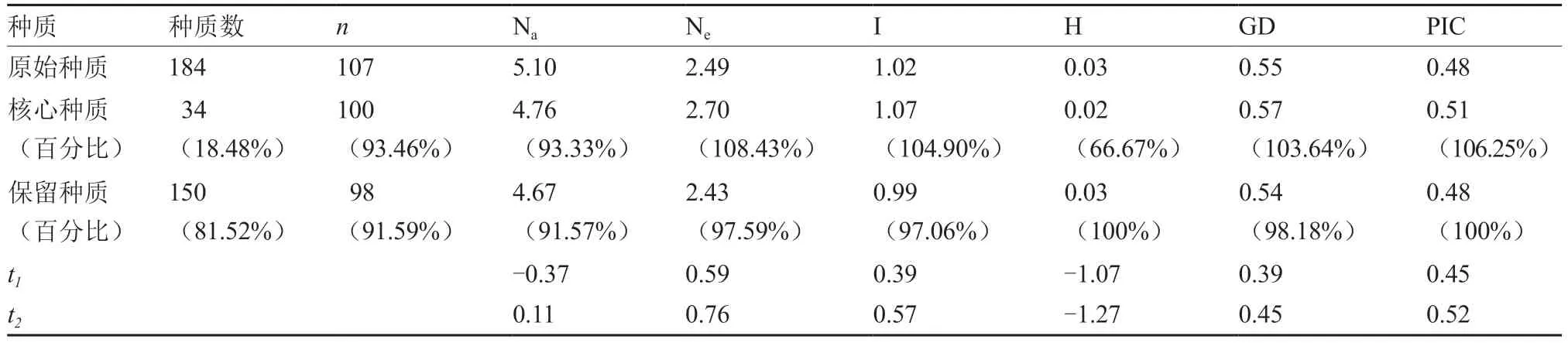
表6 苦瓜核心种质、原始种质与保留种质的遗传多样性对比
然后,基于苦瓜9 个表型性状的调查结果,对构建的34 份核心种质、184 份原始种质以及150份保留种质进行差异比较分析,结果如图3 所示,9 个表型值在核心种质、原始种质和保留种质中均没有显著性差异。说明构建的苦瓜34 份核心种质在表型上不仅能够代表184 份原始种质,也对150份保留种质具有代表性。
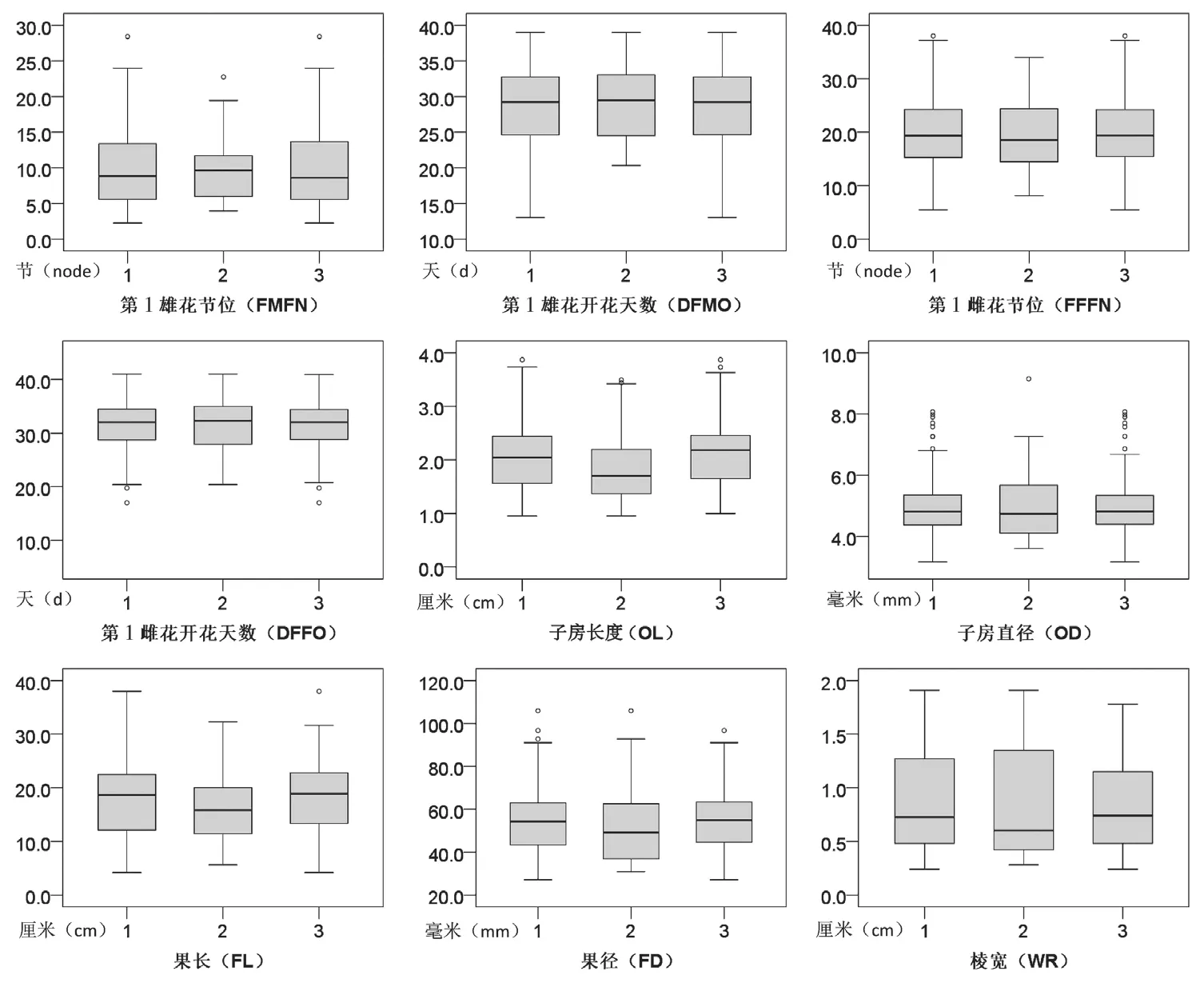
图3 苦瓜核心种质、原始种质和保留种质的9 个表型性状分布
进一步分析苦瓜34 份核心种质和184 份原始种质间的性状差异百分率,34 份核心种质的MD%为0、CR% 为88.30%、VD% 为11.11%、VR% 为115.71%。按照Hu 等(2000)的方法,当MD% ≤20%,CR% ≥ 80%时,可认为核心种质能够代表原始种质的遗传多样性;并且,MD%越小,VD%、CR%和VR%越大,则核心种质越能代表原始种质的遗传多样性。因此,认为本试验所构建的34 份苦瓜核心种质能够代表184 份原始种质的遗传多样性和表型多样性。
基于苦瓜21 对SSR 标记的PCR 电泳谱带获得了34 份核心种质的分子身份信息(图4),不同种质间带型完全相同的概率为7.8910,说明每一份核心种质几乎都有唯一的分子身份信息。

图4 34 份苦瓜核心种质的SSR 分子身份信息
3 讨论与结论
植物种质资源是进行植物遗传改良和新品种培育的物质基础,通过构建核心种质,育种家可以提高种质资源的利用效率。例如,Lv 等(2012)从3 342 份黄瓜材料中抽取出115 份核心种质资源,随后,Qi 等(2013)利用这115 份黄瓜核心种质进行全基因组遗传变异分析,揭示了黄瓜的驯化和多样性。Wang 等(2018)从1 234 份黄瓜材料中抽取出395 份核心种质资源用于黄瓜分子标记开发和许多重要性状的全基因组关联分析(GWAS)。
虽然构建核心种质的方法较多,但对核心种质确立的评价标准基本相似,即多样性是否能代表原始种质。Brown(1989)认为核心种质保留原始种质的等位基因比例需大于70%。张春雨等(2009)通过对各遗传多样性参数进行检验来评价核心种质的代表性,如果各遗传参数在核心种质和原始种质之间都没有显著性差异,则说明核心种质保留了原始种质的全部遗传多样性。Hu 等(2000)提出在均值差异百分率小于20%,极差符合率大于80%的情况下,并且均值差异百分率越小,方差差异百分率、极差符合率和变异系数变化率越大,则核心种质越能代表原始种质的遗传多样性。刘子记等(2017)采用遗传距离法,按照固定30%比例进行抽样,通过5 个表型性状从154 份苦瓜材料中抽取出46 份核心种质;经过表型参数评价,该46 份苦瓜核心种质保持了原始种质的表型多样性。
本试验中的184 份苦瓜原始种质分别收集于13 个国家、WorldVeg 和种子公司,是迄今为止公开报道的最具多样性的一组苦瓜种质资源(Cui et al.,2017,2020)。从基因型和表型数据构建核心种质,一方面是因为采用M 策略抽取出19 份核心种质样本,虽然能够最大程度地代表原始种质的等位基因数量,但是样本以来自国外的种质资源为主,不能完全代表来自国内种质资源的表型多样性。另一方面,通过QGAStation 以表型数据进行抽样弥补了对原始种质表型的代表性,同时也增加了国内种质的核心种质数量,可以更好地利用国内种质资源。从抽样比例来看,据统计大多数园艺作物构建核心种质的取样比例为10%~30%(缪黎明等,2016),本试验对苦瓜核心种质的抽样比例为18.48%,符合此范围的抽样比例。从所构建的34份苦瓜核心种质资源的地理来源代表性来看,核心种质保留了原始种质(来自13 个国家)中大多数国家(10 个国家)的来源,仅有柬埔寨、巴基斯坦和印度尼西亚3 个国家的种质资源没有入选核心种质,可能的原因是这3 个国家的原始种质样本数量较少或缺乏多样性。
当然,在评价并确立核心种质后,对核心种质的实用性尚需进一步检验。一方面,本试验构建了苦瓜34 份核心种质的SSR 分子身份信息,每一份种质都具有唯一的分子身份信息;另一方面,还需进一步对核心种质的性状如抗性、品质、产量以及配合力等进行鉴定和利用评价。
