盐渍海带盐中可培养嗜盐古菌多样性、胞外酶活及拮抗作用探究
2022-03-09苏亦鸣陈飞龙张申奥陈绍兴
苏亦鸣, 陈飞龙, 张申奥, 陈绍兴
(安徽师范大学 生命科学学院,安徽 芜湖 241000)
嗜盐古菌是一类需要高盐维持生长的古菌,是古菌的一个重要类群,属于古菌域(Archaea)的广古菌门(Euryarchaeota)嗜盐菌纲(Halobacteria)[1]。嗜盐古菌的分布广泛,主要生活在盐湖、盐碱地、盐矿、海水、晒盐池、盐井和高盐食品等高盐环境中[2-3]。作为极端微生物,嗜盐古菌在生命适应极限条件的理论研究和特殊生物活性物质应用领域具有重要的研究价值。1880 年,Farlow 在研究腌制鳕鱼夏季变红现象时,发现变红部位有球状微生物生长,将其命名为红色Halococcus(嗜盐球菌)[4]。自18世纪以来,学者们不断从高盐食品中分离出嗜盐菌类群[5]。2007年,Namwong 等从泰国的泰式鱼露中分离到Halococcus(盐球菌属) 的嗜盐古菌,随后又在2011年从泰国鱼露中分离到Haloacular和Haloarcula(盐盒菌属) 的嗜盐古菌;2010年,Roh 等从韩国的发酵贝类中分离到Haladaptatus(适盐菌属)的嗜盐古菌;2011年,Nagaoka 等从日本的商品岩盐中分离到Halostagnicola(盐湖菌属)的嗜盐古菌[6]。研究发现,嗜盐古菌在高盐食品形成独特风味方面起了重要作用。2014年,高瑞昌等[7]发现不同嗜盐古菌对鱼露的发酵效果不同,设计使用不同嗜盐古菌发酵,生产不同风味的鱼露产品。由此可见,高盐食品中嗜盐古菌资源丰富。盐渍海带是一种常见的高盐食品。韩冬[8]从大连盐渍海带中分离到来自Halobacterium(盐杆菌属)、Haloarcula(盐盒菌属)、Halolamina(盐薄片形菌属)、Haloterrigena(盐土生古菌属)和Halorubrum(盐红菌属)等5个属的嗜盐古菌菌株。嗜盐古菌的胞外酶能在高盐条件下保持高稳定性和高活性[9]。 2007年,顾晓颖等[10]在巴里坤湖和玛纳斯湖分离到多株来自Halobacteriaceae (盐杆菌科)且具有胞外酯酶和淀粉酶活性的嗜盐古菌菌株;2011年,刘冰冰等[1]在新疆罗布泊地区分离到产胞外淀粉酶、明胶酶、蛋白酶和酯酶活性的嗜盐古菌菌株;2018年,Karray 等[11]从突尼斯南部的杰里德大盐湖(Chott el-Jerid)中分离到具有分泌纤维素酶、木聚糖酶、淀粉酶、果胶酶和脂肪酶活性的嗜盐古菌菌株。从以上研究结果可以看出,胞外酶的特性在嗜盐古菌中较为普遍。嗜盐古菌的拮抗作用也有不少报道[12-14],但是少有对嗜盐古菌抑菌活性物质的理化性质的研究。本研究将以盐渍海带盐为研究对象,采用高盐培养基进行纯培养分离,经16S rRNA基因测序,对所分离的菌株进行分类学鉴定,并对所分离菌株的物种多样性组成进行分析。按种属不同,选出代表菌株,对菌株的胞外酶活性以及菌株间拮抗活性进行筛查,并对其中拮抗活性较强的抑菌活性物质进行初步的理化性质研究。本研究为进一步认识盐渍海带这一高盐食品中所生存的嗜盐古菌的物种多样性提供依据;为嗜盐古菌的资源开发与利用提供参考,并为嗜盐古菌在高盐食品的防腐抑菌等方面的应用积累前期数据。
1 材料与方法
1.1 材料
1.1.1 样品采集 盐渍海带购自安徽省芜湖市镜湖区世纪联华超市,产自山东烟台。
1.1.2 培养基 NOM培养基(g/L)[15]:酵母粉 0.05,鱼蛋白胨 0.25,丙酮酸钠 1.0,KCl 5.4,NH4Cl 0.27,CaCl20.29,MgSO4·7H2O 26.8,MgCl2·6H2O 23.0,NaCl 184.0,K2HPO42.0。用1 mol/L NaOH调节pH至7.5,100 000 Pa灭菌20 min。固体培养基在灭菌前加入琼脂粉12.0 g,用于培养海带盐中的嗜盐古菌。
1.1.3 主要仪器与设备 恒温培养箱(GHP9080,上海一恒科学仪器有限公司);电泳仪电源(DYY-2C,北京六一仪器厂);PCR(MixMT201,北京博迈德基因技术有限公司)。
1.2 方法
1.2.1 样品处理 称取5.0 g的海带盐样品于100 mL 20%的灭菌盐水中,利用漩涡混合器将其完全混合溶解,以此作为原液(100)。吸取100 μL的原液与900 μL 20%的灭菌盐水于1.5 mL无菌EP管内,利用漩涡混合器将其充分振荡混匀,稀释成10-1的样品稀释液。用同样的方法进行梯度稀释,依次稀释获得浓度为10-1、10-2、10-3、10-4、10-5、10-6和10-7的样品稀释液。
1.2.2 菌株分离纯化 取不同浓度的样品稀释液各200 μL涂布到NOM固体平板,密封后于37 ℃恒温培养3周。选取菌落形态不同且生长分布较合适的平板(10-2),挑取所有单菌落于NOM平板进行划线分离,于37 ℃培养。待菌落形成后,再在平板上进行单菌落划线纯化。最后,将菌株单菌落再次挑取至NOM平板,37 ℃培养3周,获得菌株的纯培养。
1.2.3 基于16S rRNA基因的初步分子鉴定 ①模板DNA的提取:在超净台内用灭菌牙签蘸取少量菌苔,悬于20 μL无菌水中,充分混匀使细胞均匀分布,随后细胞吸水涨破裂解,细胞内容物释放到无菌水中,得到的细胞裂解物即作为嗜盐古菌模板DNA。②PCR技术扩增16S rRNA基因:以上述制备的嗜盐古菌模板DNA作为PCR扩增模板,以嗜盐古菌引物F8/R1462为16S rRNA基因PCR扩增引物,序列如下:F8:5′-TTGATCCTGCCGGAGGCCATTG-3′;R1462:5′-ATCCAGCCGCAGATTCCCCTAC-3′[16]。PCR反应体系(50.0 μL):2×PCR Mix 25.0 μL,引物F8 2.5 μL,引物R1462 2.5 μL,DNA模板2.0 μL,无菌水18.0 μL。PCR产物交由通用生物系统(安徽)有限公司进行正向测序。③测序结果比对:利用BioEdit[17]软件查看测序峰图,选取可信度较高的区域,将其对应的序列在EzBioCloud[18]网站上进行基于16S rRNA基因的在线鉴定工具分析测序结果,对菌株进行种属鉴定。分别以97%和95%的序列一致性作为种和属的界定标准,从而确定各个分离菌株的分类地位。④构建系统发育树:使用邻接法推断进化历史[19],显示分支长度之和为1.670 538 62的最优树。在引导测试中相关分类群聚集在一起的复制树的百分比(500个复制)显示在分支旁边[20]。该树按比例绘制,分支长度与用于推断系统发育树的进化距离的单位相同。使用Kimura 2参数方法[21]计算进化距离,并以每个位点的碱基替换数为单位,利用伽马分布(形状参数=1)对不同地点之间的速率变化进行建模,分析涉及103个核苷酸序列。删除每个序列所有不明确位置,最终数据集中共有1 526个位置。在MEGA7[22]中进行进化分析,构建系统发育树。在所分离的菌株中,有不同种属的菌株,按菌株种的不同,在相同种的菌株中随机挑选一株菌株作为代表菌株,进行后续胞外酶活性和菌间拮抗作用实验的研究。
1.2.4 菌株的胞外酶活性检测 ①蛋白酶:在NOM培养基中添加1%(质量分数)的脱脂奶粉,制作牛奶平板。菌种划线,长出明显菌落后,观察菌落周围是否产生蛋白水解圈[23]。②酯酶:在NOM培养基中添加1%(质量分数)的吐温-20、吐温-40、吐温-60和吐温-80,制作吐温平板。划线,待平板上长出明显菌落,观察菌落周围是否有晕圈产生[23]。③明胶酶:在NOM培养基中添加1%(质量分数)的明胶,制作明胶平板。划线长出明显菌落后,将 Frazier试剂铺满平板表面,观察菌落周围是否出现透明圈[23]。④淀粉酶:在NOM培养基中添加1%(质量分数)的可溶性淀粉,制作淀粉平板。菌种划线接种在平板上,待有明显菌落长出后,将碘液铺满平板表面,观察菌落周围是否有透明圈出现[23]。⑤触酶:用5%(体积分数)的 H2O2溶液覆盖新鲜菌落,观察有气泡产生的菌株,以此检测触酶活性[23]。⑥氧化酶:用1% (体积分数) 对-氨基二甲基苯胺盐酸盐水溶液和1%α-萘酚乙醇溶液的混合溶液,浸润滤纸,将新鲜菌落划在滤纸上,菌落30 s内出现蓝色,即有氧化酶活性[23]。
1.2.5 菌株的抑菌活性检测 将所选的18个代表菌株分别接种于NOM液体培养基中,180 r/min,37 ℃培养。待OD600=1.0时,取10 mL菌悬液与在55 ℃保温的100 mL的NOM固体培养基混合均匀,倒平板,即混菌平板。将20 μL各菌的菌悬液滴于不同的混菌平板上。37 ℃培养10 d,观察是否产生抑菌圈,并记录结果。
1.2.6 含拮抗活性物质溶液制备 选择较短时间内抑菌活性最明显的菌株ZSA68(测试菌)及其抑制的敏感菌ZSA28(底板菌)进行拮抗活性物质溶液制备。在混菌平板(平板中含ZSA28菌悬液)和空白NOM平板(平板中不含任何菌悬液)上的相同位置滴20 μL的ZSA68菌悬液,培养7 d,观察混菌平板上抑菌圈的位置,在空白的NOM平板上,抠出相对应位置的琼脂块,采用离心固液分离的方法,12 000 r/min离心5 min,提取琼脂块中的具有拮抗活性物质溶液。
1.2.7 拮抗活性物质理化性质测定 ①分子量测定:用孔径约 6 mm的无菌打孔器在混菌平板上打孔,制作带孔的混菌平板(ZSA28平板)。在截留分子量大小为3、10、30、50 kDa的超滤管中分别加入500 μL的上述拮抗活性物质溶液,于4 ℃,4 000 r/min开始离心,待截留液(上部)为250 μL时,停止离心,收集不同规格超滤离心管内的截留液和流出液(下部)。分别将200 μL的截留液和流出液滴入带孔的混菌平板孔内,于37 ℃静置培养1 d,观察并测量抑菌圈直径。②热稳定性测定:取8个1.5 mL的无菌离心管,各加入200 μL上述制备的拮抗活性物质溶液,分别在室温、40、50、60、70、80、90和100 ℃条件下处理30 min,待冷却后分别加入混菌平板孔内,37 ℃培养1 d,观察现象。用ZSA28的混菌平板检测其热稳定性。③低盐活性测定:拮抗活性物质溶液中NaCl的浓度为20%(质量分数,下同)。根据需要在200 μL 拮抗活性物质溶液中加入无菌水,调整NaCl的浓度至2%、4%、6%、8%、10%和15%等6个浓度。用截留分子量大小为3 kDa的超滤管,4 ℃,4 000 r/min开始离心,待截留液溶液体积降到200 μL时,停止离心,用移液枪吹打超滤管的含膜的内壁,收集截留液。用ZSA28的混菌平板检测其在低盐条件下的拮抗活性。
2 结果与分析
2.1 分离菌株16S rRNA基因序列登录号
将分离到的131株嗜盐古菌的16S rRNA序列提交GenBank,获得以下序列登录号:MZ496691~MZ496693(3株菌株)、MZ619011~MZ619025(15株菌株)和MZ622035~MZ622147(113株菌株)。
2.2 海带盐中可培养嗜盐古菌物种组成分析
因仅用了嗜盐古菌引物进行PCR技术,故经纯培养分离后,从海带盐样品中只分离到嗜盐古菌,共131株。经16S rRNA 基因测序和序列同源性分析,建立可培养嗜盐古菌分子鉴定表(表1),并用邻接法构建系统发育树(图1)。分析表1和图1,发现所分离到的嗜盐古菌分布于Haloarcula、Halorubrum、Halarchaeum、Halobacterium、Halococcus、Halolamina和Haloplanus等7个属,分别隶属于盐杆菌纲(Halobacteria)的Haloferacales 和Halobacteriales 2个目;分布于Halorubraceae、Halobacteriaceae、Haloarculaceae、Halococcaceae 和Haloferacaceae 5个科,未发现嗜盐古菌的新属。
由图2可知,在分离出的嗜盐古菌中,Halobacterium为该环境下的优势物种,共51株,占所分离嗜盐古菌的39.0%。其次为Halorubrum、Halolamina、Halarchaeum、Haloarcula、Halococcus和Haloplanus的菌株,分别有38、29、7、3、2和1株,分别占所分离菌株的29.0%、22.1%、5.3%、2.3%、1.5%和0.8%。


图1 根据16S rRNA序列构建的代表菌株的系统发育树Fig.1 Phylogenetic tree of representative strains constructed according to 16S rRNA sequence括号内为菌株的16S rRNA基因序列在GenBank中的登录号,分支点上的数值为1 000次Bootstrap分析所得值,标尺0.020为进化距离The numbers in parentheses represent the accession numbers in the GenBank for the 16S rRNA gene sequences of those reference strains and screened strains. The value on the branch point is the value obtained by 1 000 bootstrap analysis, and the scale 0.020 is the evolutionary distance

图2 海带盐中嗜盐古菌组成(属水平)Fig.2 Composition of halophilic archaea in salted kelp (genus level)
2.3 胞外酶活性检测
根据测序结果,从不同的种属中选取18株嗜盐古菌进行胞外酶活性检测。其中产胞外蛋白酶1株,酯酶2株,明胶酶7株,氧化酶1株,触酶 5 株(表2)。产胞外蛋白酶菌株仅1株为ZSA80(图3A),在胞外蛋白酶检测中,由于脱脂奶粉含80%的酪蛋白,还有一些其他蛋白质,而且配置牛奶培养基较简单, 故使用脱脂奶粉来作为水解底物[1]。酯酶检测实验中,吐温-20、-40、-60、-80代表具有不同类型的酯类,只要有一种酯酶有活性均记作具有酯酶活性,其中有2个菌株具有酯酶活性,分别为ZSA1和ZSA12。菌株ZSA36、ZSA80、ZSA32、ZSA10、ZSA25、ZSA28和ZSA183具有明胶酶活性(图3B)。 菌株ZSA3具有氧化酶活性,菌株ZSA22、ZSA12、ZSA1、ZSA93和ZSA80具有触酶活性。可见菌株的胞外酶活性存在种属差异,Haloarcula和Halolamina产胞外酶的菌株较多,且存在一种菌株含多种胞外酶活性,如菌株ZSA1具有酯酶和触酶双阳性,菌株ZSA80具有明胶酶、蛋白酶和触酶三阳性。
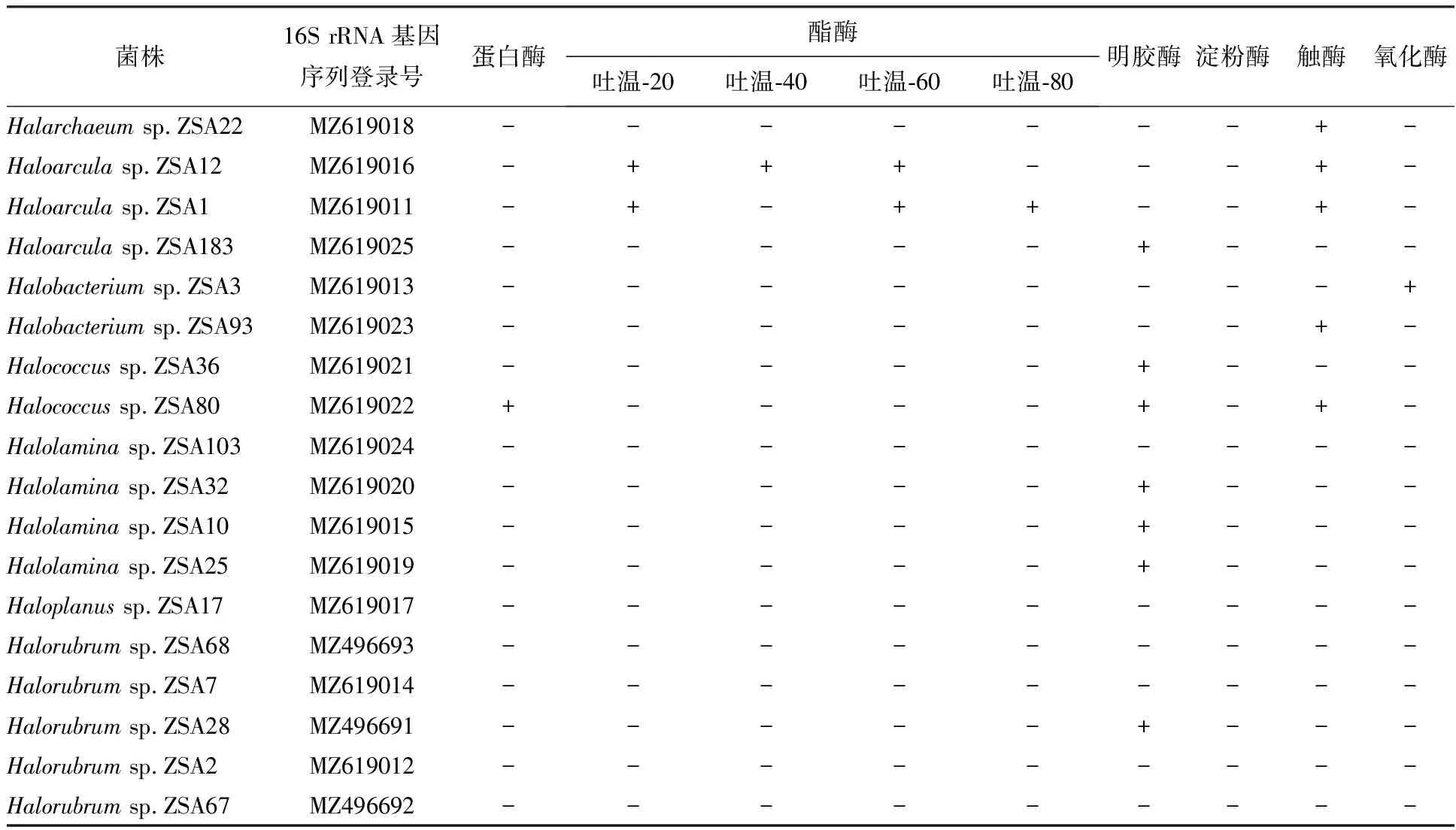
表2 代表菌株的胞外酶筛查鉴定表

图3 胞外酶活和拮抗作用检测Fig.3 Detection of extracellular enzyme activity and antibacterial effectA:菌株ZSA80胞外蛋白酶活性; B:菌株ZSA10和ZSA36胞外明胶酶活性; C:菌株拮抗作用。菌株ZSA28、ZSA32、ZSA67和ZSA68作为测试菌, 滴在菌株ZSA28的混菌平板上; 菌株ZSA28作为指示菌A:Extracellular protease activity of ZSA80; B:Extracellular gelatinase activity of ZSA10 and ZSA36; C:Antagonism of strains. ZSA28, ZSA32, ZSA67 and ZSA68 were taken as the test strains; ZSA28 was taken as indicating strain
2.4 抑菌活性筛选
采用抑菌圈法对18个代表菌株进行菌株之间拮抗作用的检测,菌株的抑菌活性通过抑菌圈大小来表示(表3)。实验结果表明,在测试的18个菌株中,菌株ZSA1、ZSA93、ZSA32、ZSA68、ZSA28和ZSA67表现出拮抗活性,占测试菌株的33.3%,除菌株ZSA32外,其余5个菌株的生长速度均较快,一周之内即可看到明显的菌落形态,而菌株ZSA32则需2周。拮抗菌株中ZSA68、ZSA28和ZSA67均来自Halorubrum,且Haloru-brum是本研究分离嗜盐古菌中的第二大优势物种,占比29.0%。菌株ZSA32、ZSA68和ZSA67能对较多的菌株产生拮抗活性,而菌株ZSA28能被较多菌株抑制(图3C);菌株ZSA32和ZSA67对菌株的拮抗活性较为相似,可能这两株菌株间具有较近的亲缘关系;菌株ZSA3、ZSA25、ZSA68和ZSA67被抑制的现象均需培养10 d以上才能观察到;菌株ZSA1和ZSA93也均需培养10 d以上才能观察到明显的抑菌作用;另外,特别有趣的是菌株ZSA67和ZSA68能发生互相抑制的现象。
由表3可以看出,菌株ZSA22和ZSA28均能被较多菌株抑制,并且较短时间内能观察到明显的抑菌现象,但菌株ZSA22(14 d)较ZSA28(7 d)生长速度缓慢,故选择菌株ZSA28作为底板菌株。在ZSA28作底板菌时,菌株ZSA93、ZSA32、ZSA68和ZSA67均能对菌株ZSA28产生抑制作用,其中菌株ZSA68的抑菌活性最好,且菌株ZSA68生长速度较快,易培养。由此可见菌株ZSA68具有较强的抑菌活性和较广的抑菌谱,故选择菌株ZSA68作为拮抗活性测试菌株进行后续的实验。

表3 代表菌株的抑菌活性检测
2.5 拮抗菌株抑菌物质理化性质
拮抗菌株ZSA68抑菌物质的分子量较大,由图4A可以看出,抑菌物质溶液经4种不同规格的超滤管离心处理后,取不同规格离心管的截留液和流出液,加入到菌株ZSA28混菌平板孔内。结果发现,除了50 kDa的截留液,3、10和30 kDa的截留液均有抑菌活性,但流出液仅50 kDa有抑菌活性,3、10和30 kDa的流出液均未出现抑菌活性,故判断抑菌物质分子量大小为30~50 kDa(图4A)。
由图4B可知,抑菌物质的热稳定性较差,抑菌物质溶液在室温、40、50、60、70、80、90和100 ℃等不同温度下处理30 min后,仅室温、40和50 ℃处理后的抑菌物质溶液出现了明显的抑菌圈,从抑菌圈的大小可以看出活性相当,而60、70、80、90和100 ℃处理后,基本未见明显的抑菌现象。这表明室温、40和50 ℃处理后,抑菌活性基本没有变化,但在60、70、80、90和100 ℃处理30 min 后,抑菌活性均消失,因此判断抑菌物质在50~60 ℃范围内失活(图4B)。
观察抑菌物质所产抑菌圈大小(图4C)可知,抑菌物质在6%、8%、10%和15%NaCl浓度时,抑菌圈大小非常接近,抑菌活性基本未变;当NaCl浓度降到4%时,抑菌圈明显缩小,活性明显降低;当降到2%时,已无抑菌圈出现,活性消失。因此,该抑菌物质最低耐低盐活性范围在2%~4%的NaCl浓度(图4C)。
综上可知,在以菌株ZSA28作为敏感菌时,拮抗菌株ZSA68抑菌物质的分子量为30~50 kDa,抑菌物质在50~60 ℃范围内失活,在盐度2%~4%范围内失去活性。

图4 ZSA68所产胞外拮抗活性物质理化性质Fig.4 Physicochemical properties of ZSA68 antibacterial substance拮抗活性测定均以ZSA28作为底板指示菌, 产生抑菌圈即代表有抑菌活性;A: 抑菌活性物质分子量测定, a: 3 kDa截留液, b: 3 kDa流出液, c: 10 kDa截留液, d: 10 kDa流出液, e: 30 kDa截留液, f: 30 kDa流出液, g: 50 kDa截留液, h: 50 kDa流出液; B: 抑菌活性物质热稳定性, i: 室温, j: 40 ℃, k: 50 ℃, l: 60 ℃, m: 70 ℃, n: 80 ℃, o: 90 ℃, p: 100 ℃;C: 抑菌活性物质耐盐性, 0.02、0.04、0.06、0.08、0.10和0.15表示抑菌物质溶液中NaCl浓度分别为2%、 4%、 6%、 8%、10%和15% (质量分数) ZSA28 was taken as the indicating strain, inhibition zone represented the antagonistic activity;A: Molecular weight of antibacterial substance, a: 3 kDa retained solution, b: 3 kDa efflux, c: 10 kDa retained solution, d: 10 kDa efflux, e: 30 kDa retained solution, f: 30 kDa efflux, g: 50 kDa retained solution, h: 50 kDa efflux; B: Thermal stability of antibacterial substance, i: Room temperature, j: 40 ℃, k: 50 ℃, l: 60 ℃, m: 70 ℃, n: 80 ℃, o: 90 ℃, p: 100 ℃; C: Salt tolerance of antibacterial substance, 0.02, 0.04, 0.06, 0.08, 0.10 and 0.15 indicate that the NaCl concentration in the antibacterial substance solution is 2%、 4%、 6%、 8%、 10% and 15% (mass fraction) respectively
3 讨 论
目前,国内对高盐食品中嗜盐细菌的研究较多。如周煜华[24]在进口咸鱼中分离到溶藻性弧菌(嗜盐菌的一种);梁恒宇等[25]在自然发酵的黄豆酱样品中分离出28株嗜盐细菌;董玲等[26]在四川冬菜中分离到了中度嗜盐菌。但对嗜盐古菌的研究却相对较少,对高盐食品中嗜盐古菌的研究大多数是国外的。如Roh等[27]在虾、贝类、乌贼、牡蛎等发酵海鲜样品中分离到了Halorubrum、Natrinema、Halococcus、Halobiforma、Halobacterium和Halalkalicoccus等属的嗜盐古菌。
本研究从烟台海带盐中分离到来自Haloarcula、Halorubrum、Halarchaeum、Halobacterium、Halococcus、Halolamina和Haloplanus等7个属的嗜盐古菌菌株。其中Halococcus和Haloplanus嗜盐古菌菌株在大连海带盐、荣成海带盐、连云港海带盐中较少见,Halolamina和Haloplanus嗜盐古菌菌株在霞浦海带盐中较少见。而在上述4种海带盐中发现的Haloterrigena、Haloarchaeobius、Halovivax、Natrialba、Haloferax、Salinigranum等多种属菌株未在本实验中分离到[8]。本研究的海带盐中优势物种为Halobacterium物种,占比39.0%,这与大连海带盐中的优势物种一致,而连云港海带盐的优势物种为Halarchaeum,荣成和霞浦海带盐的优势物种为Haloarcula。这表明虽然不同地方的海带盐中所含的嗜盐古菌种类存在很大差异,但优势物种存在相似之处,如Halobacterium、Halarchaeum、Haloarcula等属嗜盐古菌在大部分海带盐中均处于优势地位[8]。据此可以猜测,由于地理环境的不同,海带盐中嗜盐古菌的生存环境也随之改变。长期以来,能适应生存环境的菌株就会存活下来,并不断地进化来适应环境的改变;而不能适应的菌株则会不断地被淘汰,从而导致不同地方的海带盐中嗜盐古菌的优势物种比较统一,物种多样性产生较大差异。
嗜盐古菌生活在独特的高盐环境中,因此其胞外酶具有独特的理化性质,表现出极高的耐盐性,较好的热稳定性,以及较强的催化活性[28]。本研究从18个代表菌株中筛选到了产胞外蛋白酶1株,酯酶2株,明胶酶7株,氧化酶1株,触酶5株。这与巴里坤湖与玛纳斯湖[10]和新疆罗布泊地区[1]所分离到的菌株产胞外酶的情况存在较大差异。海带盐来源的嗜盐古菌菌株中具有胞外酯酶和淀粉酶活性菌株比例低于从巴里坤湖、玛纳斯湖和新疆罗布泊地区分离的嗜盐古菌菌株,但具有胞外明胶酶和触酶活性的菌株占比较高。本研究代表菌株具有较丰富的胞外酶特性,部分菌株的酶活性较高,表现出双阳性甚至三阳性,说明嗜盐古菌在酶活特性应用方面有很大潜力。
嗜盐古菌能产生丰富的抑制或杀死相近种属菌株的功能抑菌活性物质[29-33],如嗜盐菌素等。本研究对18个代表菌株进行了嗜盐古菌之间拮抗活性筛查,从中获得了6株具有拮抗活性的嗜盐古菌菌株,分别为菌株ZSA1、ZSA28、ZSA32、ZSA67、ZSA68和ZSA93,除菌株ZSA68和ZSA67,其余4株菌株均具有嗜盐古菌胞外酶活性。拮抗菌株分别来自Haloarcula、Halobacterium、Halolamina和Halorubrum等4个属,其中菌株ZSA28、ZSA67和ZSA68均来自Halorubrum,Halorubrum的菌株ZSA68表现出较好的抑菌活性和较广的抑菌谱。由于菌株ZSA68所产生的抑菌活性物质在60 ℃以上的温度条件下即失去抑菌活性,因此初步推测该抑菌活性物质为多肽或蛋白类抑菌活性物质。对菌株ZSA68中抑菌活性物质进行了初步的理化性质研究,发现菌株ZSA68抑菌活性物质的分子量为30~50 kDa,且在温度达60 ℃以上或盐浓度低于2%时失去抑菌活性。菌株ZSA68所产抑菌活性物质的分子量较大,热稳定性较低,耐盐性较强,且对其他菌株有较好的抑菌特性,这对高盐食品防腐抑菌具有较高的参考价值。
综上所述,海带盐中分布有丰富的嗜盐古菌,其胞外功能酶活性在高盐食品发酵、高盐废水处理和制革工业等领域发挥重要的作用。在抑菌方面具有很大的开发潜力和商业价值,高盐食品中较高的盐浓度可以抑制多数细菌的生长,但仍会腐败变质[34-36],故嗜盐古菌的拮抗活性在高盐食品的防腐方面具有重要应用前景。
