基于噬菌体展示技术和新型冠状病毒的抗体检测方法构建及验证
2022-03-09李申陈汉祎余卓营胡克平王建勋
李申,陈汉祎,余卓营,胡克平,王建勋
1 北京中医药大学生命科学学院,北京102400;2 中国医学科学院北京协和医学院药用植物研究所
噬菌体展示技术是一种通过将外源基因插入至噬菌体特定蛋白的基因中,从而实现在噬菌体表面表达具有活性的外源多肽或蛋白质的技术[1]。噬菌体展示系统主要有丝状噬菌体、T7噬菌体、λ噬菌体与T4噬菌体等,其中丝状噬菌体M13的外壳蛋白pⅢ被广泛应用于展示外源蛋白[2]。M13KO7是M13噬菌体的突变体,含有M13mp1的基因Ⅱ并插入有p15A复制起点及卡那霉素(KANA)抗性基因,通常在以噬菌粒为载体的展示系统中被用作辅助噬菌体[3]。新型冠状病毒肺炎(COVID-19)由新型冠状病毒(SARS-CoV-2)引起,其疫情席卷全球,至今仍在延续。SARS-CoV-2的基因组由29 903个碱基构成,其基因组编码的结构蛋白中,刺突糖蛋白(S protein)介导了SARS-CoV-2进入细胞,是病毒得以传播与流行的关键蛋白[4]。SARS-CoV-2的入侵通过S protein中S1亚基的SARS-CoV-2受体结合域(RBD)与人类细胞的受体血管紧张素转化酶2(ACE2)结合[5]。因此,SARS-CoV-2 RBD与ACE2的结合作用是疫苗以及抗体开发所聚焦的热点[6]。随着COVID-19疫情蔓延,多个SARS-CoV-2突变株被报道,其中突变株B.1.351在南非肆虐,其RBD的关键位点有3个突变(K417N、E484K及N501Y),E484K和N501Y位于受体结合基序(RBM)中,而RBM正是与ACE2结合的主要功能基序[7]。研究显示,该突变对恢复期血浆及接种疫苗者血清的中和作用有更强的抗性[8]。2021年7月—9月,本研究通过噬菌体展示技术和SARS-CoV-2构建了一种抗体检测方法,并观察了其应用的效果。
1 材料与方法
1.1 主要材料 经RBD免疫后分离的羊驼血清及PHEN1噬菌粒由安第斯抗体生物技术衡水有限公司惠赠;大肠杆菌TG1感受态细胞购自北京博迈德基因技术有限公司;大肠杆菌DH5α感受态细胞购自北京康为世纪生物科技有限公司;M13KO7辅助噬菌体购自美国NEB公司;SARS-CoV-2 Spike抗体购自北京义翘神州科技股份有限公司,Human c-myc抗体购自美国R&D Systems公司;Pyrobest DNA聚合酶购自宝日医生物技术(北京)有限公司;qPCR 2x SYBR mix购自北京兰博利德商贸有限公司。引物由生工生物工程(上海)股份有限公司合成;质粒小提试剂盒及EasyGeno快速重组克隆试剂盒购自天根生化科技(北京)有限公司;QuikChange Lightning定点突变试剂盒购自美国安捷伦公司;胶回收试剂盒购自德国Qiagen公司;NuPAGE4-12% Bis-Tris蛋白预制胶、NuPAGE SDS running buffer及WB显色液均购自赛默飞世尔科技(中国)有限公司;ELISA包被液购自北京索莱宝科技有限公司;酵母提取物及蛋白胨购自OXDID公司;NaCl购自阿法埃莎(中国)化学有限公司;甘油购自上海麦克林生化科技有限公司;琼脂糖购自于Sigma-Aldrich(上海)贸易有限公司;琼脂购自北京华奥正生科技有限公司;SDS-PAGE loading buffer与marker、DNA loading buffer及marker、PEG-8000、PBS速溶颗粒、PBST速溶颗粒、湿转缓冲液、脱脂奶粉均购自北京兰博利德商贸有限公司;BSA购自北京拜尔迪生物技术有限公司;其余试剂均为国产分析纯。NC膜购自北京普利莱基因技术有限公司;高吸附96孔ELISA板购自美国Corning公司;PCR仪、转膜槽、凝胶成像系统均购自美国伯乐公司;实时荧光定量PCR仪购自美国Life Technologies公司;SDS-PAGE凝胶电泳槽、山羊抗鼠二抗购自赛默飞世尔科技(中国)有限公司;电泳仪电源及琼脂糖凝胶电泳槽均购自北京六一生物科技有限公司;数控翘板摇床购自大龙兴创实验仪器(北京)股份公司;恒温摇床购自上海智城分析仪器制造有限公司;恒温培养箱购自上海一恒科学仪器有限公司;恒温离心机购自德国Eppendorf公司。
1.2 基于噬菌体展示技术和SARS-CoV-2的抗体检测方法构建
1.2.1 含有SARS-CoV-2 RBD及突变RBD片段的重组噬菌体菌液制备 取大肠杆菌TG1感受态细胞50 μL加至10 mL 2xYT培养基中,37 ℃、250 r/min摇匀培养至光密度(OD)=0.5,加入100 μL M13KO7辅助噬菌体及10 μL质量为50 mg/mL的KANA过夜培养。取过夜培养的菌液,使用质粒小提试剂盒提取MI3KO7辅助噬菌体基因组。以M13KO7辅助噬菌体基因组作为模板,设计引物MI3KO7-1、M13KO7-2,引物序列见表1。PCR扩增MI3KO7-1、M13KO7-2两条载体片段,扩增条件:95 ℃、3 min变性,95 ℃、30 s,65 ℃、30 s,72 ℃、5 min,共35个循环;72 ℃、10 min延伸。以购自安第斯抗体公司的重组有c-myc标签及RBD序列的PHEN1-RBD噬菌粒作为模板,使用定点突变试剂盒,构建含E484K、N501Y突变的PHEN1-RBD噬菌粒,引物序列见表1。分别以PHEN1-RBD噬菌粒及含E484K、N501Y突变的PHEN1-RBD噬菌粒作为模板,设计引物,引物序列见表1。PCR扩增含c-myc标签的RBD及含c-myc标签且E484K、N501Y突变的RBD目的片段,扩增条件为:95 ℃、3 min变性,95 ℃、30 s,65 ℃、30 s,72 ℃、45 s,共35个循环;72 ℃、10 min延伸。将目的片段与载体的PCR产物进行琼脂糖凝胶电泳,使用凝胶回收试剂盒,回收大小正确的片段。将两条载体片段分别与RBD及突变RBD片段使用快速重组试剂盒进行同源重组,获得PⅢ蛋白信号肽与结构区之间插入外源片段的连接产物,质粒图谱见图1。吸取5 μL连接产物加入50 μL大肠杆菌DH5α感受态细胞进行转化,复苏后涂布于含50 μg/mL KANA的固体培养基平板上,37 ℃过夜培养后挑取单克隆菌落加入含有50 μg/mL KANA的2xYT培养基中,37 ℃、250 r/min培养12 h,取经培养的菌液使用质粒小提试剂盒提取重组噬菌体基因组,设计引物进行PCR,引物序列见表1。扩增条件:95 ℃、3 min变性,95 ℃、30 s,55 ℃、30 s,72 ℃、45 s,共35个循环;72 ℃、10 min延伸。对目的条带大小符合预期的重组噬菌体基因组进行Sanger法测序,将测序正确的菌液加入200 μL/mL甘油,放置于-80 ℃保存。

表1 基因扩增引物序列
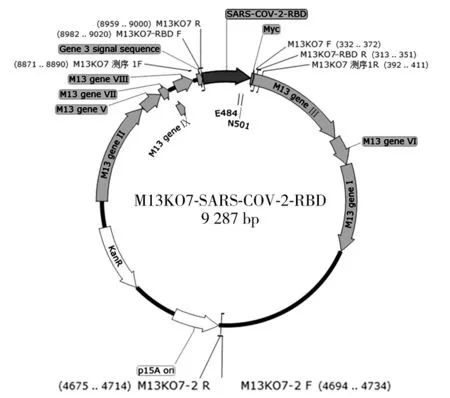
图1 重组M13KO7噬菌体基因图谱
1.2.2 重组噬菌体提取 将20 μL测序正确的菌液加入含50 μg/mL KANA的10 mL 2xYT培养基中,37 ℃、250 r/min隔夜培养。将隔夜培养至浑浊的菌液用8 000 r/min、4 ℃离心15 min,小心吸取上清,弃置沉淀。将上清液转移至新的离心管中,加入PEG/NaCl溶液(146.1 g NaCl、200 g PEG,由超轻水定容至1 L)2 mL,充分颠倒混匀,冰浴1 h。将冰浴后的上清液用10 000 r/min、4 ℃离心30 min,小心弃去上清,并使用1 mL PBS缓冲液重悬沉淀,得到含有RBD片段的重组噬菌体(M13KO7-RBD)及含有突变RBD片段的重组噬菌体(M13KO7-mutant RBD),将重悬后的噬菌体置于4 ℃保存。
1.2.3 重组噬菌体展示效果验证 采用Western blotting法。取M13KO7-RBD、M13KO7-mutant RBD各20 μL,加入5 μL SDS-PAGE loading buffer,95 ℃加热变性裂解15 min,制得样品。将样品加样至预制胶胶孔中,进行SDS-PAGE并湿转至NC膜。以c-myc抗体为一抗(稀释比例1∶1 250),4 ℃孵育过夜;以羊抗鼠多抗为二抗(稀释比例1∶5 000),37 ℃孵育1 h,洗膜,显色,使用成像系统曝光蛋白条带,与标准蛋白条带进行对比。
1.3 基于噬菌体展示技术和SARS-CoV-2的抗体检测方法验证
1.3.1 重组噬菌体与RBD抗体结合能力观察 采用qPCR法。取1 μL浓度为1 mg/mL的RBD抗体以包被液稀释至50 μL,将抗体稀释液包被至高吸附96孔板中作为实验组,另取50 μL包被液包被至96孔板中作为对照组,将实验组与对照组4 ℃包被过夜。次日弃去包被液,使用PBST溶液洗板5次,加入封闭液(含20 mg/mL BSA的PBS-T)300 μL,37 ℃封闭1 h,弃去封闭液,使用PBST溶液洗板5次。实验组与对照组孔中分别加入50 μL待验证的M13KO7-RBD、M13KO7-mutant RBD稀释液(10 μL重组噬菌体加入至40 μL含5 mg/mL BSA的PBS-T溶液中),37 ℃孵育1 h,弃去重组噬菌体稀释液,以PBST洗板10次。每孔加入100 μL超轻水,95 ℃加热洗脱15 min,吸取实验组与对照组孔中洗脱液作为样品。设计噬菌体基因扩增引物,引物序列的上游引物5′-GCTTCGTGATTCGTGGCG-3′、下游引物5′-CGGTTTCAGGTTGCTCTT-3′,同时梯度稀释阳性质粒,绘制标准曲线。进行qPCR反应,采用20 μL反应体系,体系包括10 μL qPCR 2x SYBR mix预混液、上游下游引物各1 μL(10 μmol/L)、样品1 μL、无酶水7 μL。进行两步法扩增噬菌体的基因片段,扩增条件为95 ℃、30 s,95 ℃、10 s,60 ℃、30 s,共40个循环。采集熔解曲线,获得qPCR扩增曲线并记录Ct值,根据样品Ct值通过标准曲线的回归方程计算其每微升扩增片段的拷贝数。实验重复3次,取平均值进行分析。
1.3.2 M13KO7-RBD与羊驼血清抗体结合能力观察 采用qPCR法。取衡水安第斯抗体公司提供的经RBD抗原免疫后采血并分离保存的羊驼血清样本,将2 μL血清以包被液稀释至50 μL并封闭,方法同“1.4.2”。取10 μL M13KO7-RBD及10 μL不含重组片段的野生型M13KO7噬菌体,均以含5 mg/mL BSA的PBST溶液稀释至50 μL,分别以50 μL M13KO7-RBD及野生型噬菌体稀释液处理封闭后的孔板,洗板、热裂解后进行qPCR检测,方法同“1.4.2”。获得qPCR扩增曲线,记录Ct值,计算扩增片段的拷贝数。实验重复3次,取平均值进行分析。
1.3.3 RBD点突变对其与抗体结合能力的影响观察 采用qPCR法。取RBD抗体稀释液(1 μL RBD抗体以包被液稀释至50 μL)包被高吸附96孔板,方法同“1.4.2”。取10 μL M13KO7-RBD和2.5 μL M13KO7-mutant RBD(经热裂解、qPCR测量其拷贝数后调节至加入拷贝数一致),均以含5 mg/mL BSA的PBST溶液稀释至50 μL,将稀释后的重组噬菌体加入孔中,孵育、洗板、热裂解、进行qPCR检测,获得qPCR扩增曲线并记录Ct值,计算扩增片段的拷贝数。实验重复3次,取平均值进行分析。
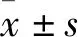
2 结果
2.1 基于噬菌体展示技术和SARS-CoV-2的抗体检测方法构建结果 可以检测到清晰的M13KO7-RBD、M13KO7-mutant RBD条带,其pⅢ融合蛋白大小略小于75 kDa,与理论大小相符。见OSID码图1。
2.2 基于噬菌体展示技术和SARS-CoV-2的抗体检测方法验证结果
2.2.1 实验组、对照组与重组噬菌体结合能力比较 加入M13KO7-RBD的实验组扩增片段拷贝数为(1.26×106±1.28×105)copies/μL,其对照组扩增片段拷贝数为(3.30×104±5.40×103)copies/μL;加入M13KO7-mutant RBD的实验组扩增片段拷贝数为(1.01×106±7.58×104)copies/μL,其对照组扩增片段拷贝数为(1.47×105±8.62×103)copies/μL,实验组扩增片段拷贝数均高于对照组(P均<0.01)。
2.2.2 M13KO7-RBD、无外源片段噬菌体与羊驼血清抗体结合能力比较 加入M13KO7-RBD的羊驼血清扩增片段拷贝数为(1.37×107±1.25×106)copies/μL,加入无外源片段M13KO7噬菌体处理的羊驼血清扩增片段拷贝数为(2.51×106±1.92×105)copies/μL,加入M13KO7-RBD的羊驼血清扩增片段拷贝数高于加入无外源片段M13KO7噬菌体的扩增片段拷贝数(P<0.01)。
2.2.3 M13KO7-RBD、M13KO7-mutant RBD与RBD抗体结合能力比较 加入M13KO7-RBD的RBD抗体扩增片段拷贝数为(2.82×106±1.90×105)copies/μL,加入M13KO7-mutant RBD的RBD抗体扩增片段拷贝数为(8.37×105±2.39×105)copies/μL,加入M13KO7-RBD的RBD抗体扩增片段拷贝数高于加入M13KO7-mutant RBD的扩增片段拷贝数(P<0.01)。
3 讨论
噬菌体展示技术可以在缺乏对蛋白结构及序列的了解的情况下,展示不同大小或性质的蛋白质,通过表型筛选获得其编码基因。随着噬菌体展示技术的发展,噬菌体展示已广泛应用于筛选具有高亲和力和强特异性的新型治疗性抗体、研究抗原表位、开发多肽类药物、研究蛋白间相互作用等领域[1,9]。本研究通过改造M13KO7基因组,构建了基于噬菌体展示的抗体检测方法,并观察了其在SARS-CoV-2抗体检测中的应用效果。将制备出的M13KO7-RBD、M13KO7-mutant RBD通过Western blotting法验证其蛋白展示效果,结果显示融合蛋白展示RBD及突变RBD片段的效果良好,大小符合预期。进一步使用高吸附ELISA板包被RBD抗体,加入M13KO7-RBD、M13KO7-mutant RBD以结合抗体,使用qPCR扩增噬菌体的基因片段以间接地反映抗体与重组噬菌体的特异性结合,发现与对照组比较,用M13KO7-RBD、M13KO7-mutant RBD处理的实验组与RBD抗体的结合能力均较好。
相较于抗体筛选中常用的单价展示系统,本方法采用多价展示,理论上可以更多的降低非特异性结合,有助于提高展示水平以放大检测信号,达成良好检测效果。HARVE等[11]提出使用噬菌体免疫共沉淀测序技术展示寡核苷酸片段以鉴定血清抗体,该方法采用T7噬菌体展示系统,通过对病原微生物基因组进行生物信息学设计,将其改造为符合噬菌体展示要求的多肽片段并完成展示。通过免疫沉淀联合高通量测序,可以对患者体内不同表位的抗体谱进行分析,从而在疾病发生机制及交叉免疫等方向提供更为精细化、个性化的数据支持。但由于T7噬菌体所能展示的最大抗原片段仅为30个氨基酸左右,不足以形成与病原微生物相似的蛋白构象,因此该方法仅能对靶向线性表位的抗体实现检测。STODDARD等[10]的研究使用了T7噬菌体展示系统对SARS-CoV-2进行抗体检测,发现在19例SARS-CoV-2感染患者血液样本中均未检测到任何对RBD片段的免疫应答,这也进一步提示了该方法的局限性。在病毒侵染过程中,靶向RBD等病毒原有构象的抗体往往具有更大的意义和价值,本研究采用M13噬菌体展示系统,pⅢ蛋白可容纳长达300个氨基酸的外源片段,且插入片段仍将保留原有的空间结构。本研究在观察了重组噬菌体与商业化RBD抗体的结合效果后,进一步采用羊驼血清验证本方法在生物样品上的应用效果。在SARS-CoV-2 S protein免疫后的羊驼血样中,相比于对照组,重组噬菌体可以产生5倍以上的富集,提示本研究提供的方法可以对靶向复杂空间表位的抗体进行检测。随着疫苗接种的普及,SARS-CoV-2突变带来的免疫逃逸对疫苗的效力及恢复期血清的中和作用也逐渐引起重视,突变株B.1.351中RBD的突变E484K、N501Y已经多次被报道与免疫逃逸相关[11]。本研究使用M13KO7-mutant RBD检测突变后抗体与RBD结合能力的变化,发现展示有E484K、N501Y突变的噬菌体相较于野生型RBD的富集效果出现显著下降,在进一步印证了展示蛋白与SARS-CoV-2的原有结构类似的同时,也说明本方法在研究由病原突变导致的免疫逃逸方面具有潜在价值。
综上所述,本研究基于噬菌体展示技术,构建了一种适用范围广且具有高通量检测潜力的抗体检测方法,并观察了其在SARS-CoV-2中的应用效果。就方法本身而言,相较于高吸附ELISA板,抗体偶联磁珠、Protein A/G偶联磁珠亦可用于此方法,理论上可降低非特异性结合,提高灵敏度。除此之外,可利用噬菌体展示技术高通量的特点,构建重组有突变株抗原片段的噬菌体或重组有病毒其他蛋白片段的噬菌体,设计组建重组噬菌体文库,结合高通量测序技术进行检测。以上这些都将成为我们日后研究的方向,以期进一步了解病原感染及免疫过程中的相关机制,为疾病的治疗提供帮助。
