基于氧化三甲胺的稳定性冠心病低强度他汀类药物敏感性预测模型建立与验证
2022-03-09李杰晁鹏刘军刘永
李杰,晁鹏,刘军,刘永
新疆维吾尔自治区人民医院心血管内科,乌鲁木齐830001
随着我国人口老龄化加重,冠心病(CHD)的发病率与日俱增[1]。他汀类药物是治疗CHD的基础药物之一,主要作用为降低血脂及稳定斑块,而血脂的控制在CHD的治疗中起到关键作用[2]。欧洲心脏病学会(ESC)2019年血脂指南建议,CHD极高危患者低密度脂蛋白胆固醇(LDL-C)应维持在1.4 mmol/L以下,CHD高危患者应维持在1.8 mmol/L以下[3]。作为重要的降脂类药物之一,他汀类药物对于某些CHD患者的疗效不佳[4]。既往研究对影响他汀类药物疗效的因素大多集中在影响药物代谢的基因突变方面,目前SLCO1B1、ABCB1、ABCG2、ApoE基因突变已明确为他汀类药物敏感性的影响因素[5-7]。肠道微生物菌群是近年来的研究热点,有研究发现肠道代谢产物氧化三甲胺(TMAO)是引起CHD发病的关键因素之一[8]。但TMAO在血脂代谢过程中是否起到作用,其水平是否对他汀类药物敏感性有影响,目前缺乏相关报道。基于此,本团队设计了一项前瞻性队列研究,观察TMAO对稳定性CHD患者他汀类药物敏感性的影响,构建基于TMAO的他汀类药物敏感性预测模型,并进一步验证该模型的预测价值,以期为CHD的临床治疗提供理论依据。
1 资料与方法
1.1 临床资料 本研究为前瞻性设计,经新疆维吾尔自治区人民医院医学伦理委员批准(批准文号:KY2019011604)。收集2019年1月—12月就诊于我院的稳定性CHD且接受低强度他汀类药物治疗的患者资料,并对其进行为期1年的随访。入组标准:①性别不限,年龄≥18岁;②由3名有经验的心内科专科医师行冠状动脉造影检查确诊为稳定性CHD;③接受低强度他汀类药物治疗(阿托伐他汀20 mg/d或瑞舒伐他汀10 mg/d);④患者签署知情同意书。排除标准:①伴有严重精神疾病;②不能配合随访。最终完成随访计划63例,其中男42例、女21例,年龄(60.92±11.09)岁,BMI(29.12±6.54)kg/m2,有SLCO1B1基因突变15例、ABCB1基因突变21例、ABCG2基因突变17例、ApoE基因突变22例。
1.2 肠道菌群代谢产物TMAO水平检测方法 采用超高效液相色谱—三重四极杆质谱(UHPLC-QQQ/MS)法检测患者在接受他汀类药物之前血浆肠道菌群代谢产物TMAO的水平,并使用代表性同位素作为内标校正以提高检测准确性。
1.3 稳定性CHD患者对低强度他汀类药物的敏感性判断 对入组患者进行随访,统计患者对低强度他汀类药物的敏感性。判断患者对他汀类药物不敏感的标准为LCL-C≥1.8 mmol/L,判断患者对他汀类药物敏感的标准为患者LCL-C<1.8 mmol/L。
1.4 低强度他汀类药物敏感性预测模型的建立与验证 以TMAO水平中位数为界限,将TMAO<中位数者划分为TMAO低水平者,≥中位数者划分为TMAO高水平者,比较TMAO高、低水平者对低强度他汀类药物的敏感性。运用R软件将TMAO高水平及SLCO1B1基因突变、ABCB1基因突变、ABCG2基因突变、ApoE基因突变进行单因素及多因素Cox回归分析,观察这些因素与低强度他汀类药物敏感性的相关性。运用R软件中的nomogram算法建立预测低强度他汀类药物敏感性的列线图模型;基于多因素Cox回归分析中的β值计算各因素的风险评分,建立预测低强度他汀类药物敏感性的风险评分模型。根据评分模型绘制受试者工作特征(ROC)曲线,同时计算曲线下面积(AUC)、赤池信息准则(AIC)值及一致性指数(C指数),绘制一致性检验曲线检验模型的预测曲线与实际曲线的一致程度。运用内部验证,将纳入患者按照7∶5的比例随机分配为建模组、验证组,绘制ROC曲线,对比两组AUC对预测模型进行稳定性验证。
2 结果
2.1 不同TMAO水平者对低强度他汀类药物的敏感性比较 根据TMAO水平中位数将TMAO<4.76 μmol/L者划分为TMAO低水平者,共32例;TMAO≥4.76 μmol/L者划分为TMAO高水平者,共31例。低TMAO水平者中对低强度他汀类药物不敏感3例,不敏感率为9.38%;高TMAO水平者中对低强度他汀类药物不敏感15例,不敏感率为48.39%;高TMAO水平者对低强度他汀类药物不敏感率高于低TMAO水平者(P<0.01)。
2.2 影响他汀类药物敏感性的危险因素分析结果 单因素Cox回归分析发现,TMAO高水平(HR=1.213,95%CI为1.105~1.217,P<0.001)、ApoE突变(HR=3.324,95%CI为2.309~4.938,P<0.001)、ABCB1突变(HR=1.621,95%CI为1.911~3.654,P<0.001)、ABCG2突变(HR=2.111,95%CI为1.506~3.019,P<0.001)、SLCO1B1突变(HR=1.877,95%CI为1.105~2.476,P<0.001)为影响他汀类药物敏感性的危险因素。对上述5个危险因素进一步使用多因素Cox回归模型分析,结果显示TMAO高水平、SLCO1B1突变、ABCB1突变、ABCG2突变、ApoE突变仍是影响他汀类药物敏感性的危险因素。见表1。
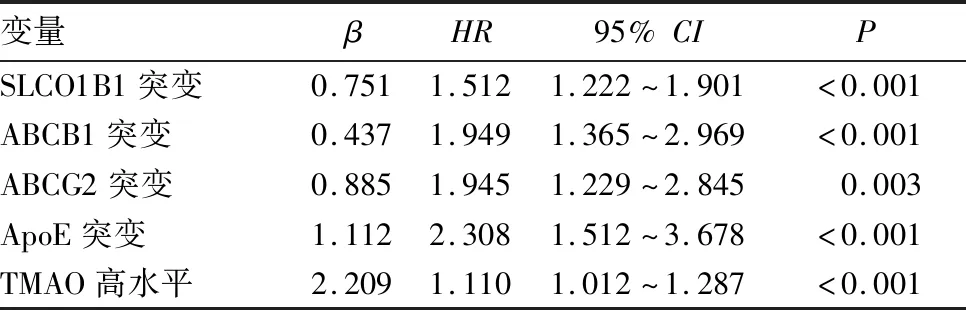
表1 影响他汀类药物敏感性的多因素Cox回归分析结果
2.3 预测他汀类药物敏感性的列线图及评分模型建立结果 根据获得的5个独立危险因素建立预测他汀类药物敏感性的列线图,结果显示TMAO在7.22~157.37 μmol/L时得分为100分,在4.76~7.20 μmol/L时得分为32分,在3.25~4.75 μmol/L时得分为28分,ApoE突变得分为76分,ABCB1突变得分为60分,SLCO1B1突变得分为30分,ABCG2突变得分为6分。见图1。进一步建立预测他汀类药物敏感性的评分模型,根据多因素Cox回归分析中的β值取整数得到各项因素的具体的分值。见表2。绘制ROC曲线显示,此评分模型中评分≥截断值(2分)时血脂不达标的可能性较大。
2.4 预测他汀类药物敏感性的准确性验证结果 ROC曲线分析显示,该评分模型预测他汀类药物敏感性的AUC=0.762,R软件计算得到该评分模型预测他汀类药物敏感性的C指数为0.781、AIC值为569.428,均提示该评分模型的准确性较佳。绘制一致性检验曲线显示,评分模型预测他汀类药物敏感性的预测曲线与实际曲线基本一致。见图2。内部验证显示,建模组、验证组AUC分别为0.770、0.755,两组比较差异无统计学意义。

图1 预测他汀类敏感性的列线图模型

表2 预测他汀类药物敏感性的评分模型

图2 预测他汀类药物敏感性评分模型的一致性检验曲线
3 讨论
CHD作为心血管疾病的高发病症,是全球病死率最高的疾病之一[9]。目前对于CHD患者血脂的维持标准也更加严格,心肌梗死患者血脂维持标准从1.8 mmol/L降到1.4 mmol/L,稳定性CHD患者血脂维持标准也从2.2 mmol/L降到1.8 mmol/L[10]。他汀类药物是市场上最常见的降脂药物,但常见患者服用他汀类药物之后血脂不达标的情况。既往研究发现,这种对他汀类药物的不敏感有可能来源于一些有关于药物代谢的基因突变[11-12]。近年来,已有关于他汀类药物敏感基因(SLCO1B1、ApoE基因)的相关检测问世,旨在预测患者对他汀类药物的敏感性。但仅靠基因突变检测来完成的药物敏感性预测,可能会带来假阴性和假阳性结果。
肠道微生物菌群代谢产物TMAO被发现与CHD的发生发展具有密切联系,而CHD的发病机制与脂质代谢密切相关[13-14]。因此,我们推测TMAO影响CHD的发生发展是否可能是通过改变脂质代谢介导的,而血浆TMAO水平与他汀类药物的敏感性可能也密切相关。基于此,我们设计了一项前瞻性队列研究,首先验证了血浆TMAO水平与他汀类药物敏感性是否相关,而后建立了包括TMAO在内的预测模型来预测稳定性CHD患者他汀类药物的敏感性,这一预测模型理论上可优于仅通过他汀类药物敏感基因突变检测所预测到的结果。
本研究结果显示,TMAO高水平者发生血脂不达标的概率高于低TMAO水平者,也就是说血浆TMAO水平是他汀类药物发生耐药的一个危险因素。进行单因素及多因素Cox回归分析也得出相同的结论,即TMAO为服用他汀类药物后血脂仍不达标的危险因素。我们进一步建立了预测他汀类药物敏感性的预测模型,这其中除了血浆TMAO水平,还包括SLCO1B1、ABCB1、ABCG2、ApoE基因的突变,这些均为既往研究明确与他汀类药物敏感性有关的指标。将这些指标与TMAO联合建立列线图及评分模型,运用ROC曲线及内部验证分析预测模型的准确性均发现其准确性较好。因此,本研究所建立模型是切实可用的。
大量摄入红肉、牛奶、禽蛋类食物时,在肠道菌群和体内器官作用下会产生大量TMAO[15]。本研究结果显示,高TMAO水平与他汀类药物耐药性密切相关。因此,CHD患者服用他汀类药物时应尽量避免摄入红肉、牛奶、禽蛋类食物。预测模型中所涉及到的基因突变均为已被发现与他汀类药物耐药性密切相关的基因,其中SLCO1B1基因的突变与他汀类药物带来的不良反应如肌溶解密切相关[7]。运用我们的评分模型对患者他汀类药物敏感性进行预测,评分模型中评分≥2分的患者不适用于使用他汀类药物进行降脂治疗,可以选择PCSK9抑制剂等新型药物进行替代治疗。
本研究也存在诸多限制性,首先本研究为前瞻性队列研究,其研究类型等级不高,说服力不如随机临床试验,因此期待更多随机临床实验去研究此话题。其次,本研究只关注了LDL-C的达标率,而其他的如高密度脂蛋白胆固醇、总胆固醇等血脂指标并未关注。虽然LDL-C是CHD发生发展最重要的因素之一,但高密度脂蛋白胆固醇、总胆固醇等指标依然是CHD的保护因素及危险因素,因此这也是本研究团队下一步的研究方向。最后,本研究的样本量过少也是本研究的限制,小的样本量代表性较差,无法代表群体,因此期待大样本的临床试验。
