热应激下大鼠Hspa2 基因启动子区CpG 岛甲基化状态变化研究*
2022-03-09陈雪丹张庆华
李 锐 陈雪丹 张庆华**
1.陆军军医大学大坪医院生殖医学中心(重庆 400042)2.陆军军医大学基础医学院医学遗传学教研室(重庆 400038)
前 言
热休克蛋白A2 (heat shock protein A2,HSPA2)是一种在睾丸内部组成型高表达的蛋白, 其在精子发育中的关键作用已为大量研究所证实[1]。 本课题组前期研究显示,热应激条件下大鼠睾丸中HSPA2 的表达显著下调[2],与Krawczyk 等[3]的研究结果一致,这很可能成为回答热应激致精子发育功能损伤机制的一个关键突破口,但直到目前热应激导致HSPA2 表达水平降低的内在机制不明。
表观遗传是指在DNA 序列不变的条件下,生物表型或基因表达发生稳定的可遗传变化, 其涉及到多种不同的分子机制,包括DNA 甲基化、组蛋白共价修饰、染色质重塑及非编码RNA 调控等, 其中DNA 甲基化是发现最早、研究最多的一种表观遗传修饰方式。 从整个生物界来说,DNA 甲基化可发生于胞嘧啶C-5 位、腺嘌呤N-6 位及鸟嘌呤N-7 位等点位,但发生在CpG 二核苷酸中胞嘧啶C-5 位的甲基化,则是动、植物等真核生物DNA 甲基化的主要形式,也是迄今为止发现的哺乳动物DNA 甲基化的唯一形式。CpG 二核苷酸在基因组中分布不均, 其中某些区段的CpG 二核苷酸保持或高于正常概率,形成所谓的CpG 岛,其主要位于基因启动子及第一外显子区, 并在基因表达调控和染色质结构重塑等方面扮演重要角色。
既往研究[4]显示,表观遗传机制可能是调控HSPA2表达的首要因素,而大量证据表明DNA 甲基化是调节人类细胞中HSPA2 表达最重要的表观遗传机制之一,在众多乳腺癌、宫颈癌、膀胱癌和肾癌细胞系中均可检测到HSPA2 基因甲基化[5,6]。 以DNA 甲基化抑制剂处理细胞系后,可观察到HSPA2 基因转录水平升高,但过度甲基化则导致其表达水平降低[7]。这似乎表明,HSPA2基因的作用被过度甲基化所抑制, 但这一点目前尚存有争议。 有研究认为, 原发性膀胱肿瘤中HSPA2 基因的抑制作用与过度甲基化相关[8],但另有研究发现HSPA2基因在膀胱癌细胞系和原发性尿路上皮肿瘤中均呈现高表达[9]。总之,DNA 甲基化在HSPA2 基因表达中发挥关键作用。
通过在线查询UCSC 数据库, 可见大鼠Hspa2 基因启动子区也存在一个CpG 岛, 热应激是否可能通过此CpG 岛区域的DNA 甲基化来介导Hspa2 基因的表达下调,这是一个极有意思的问题。 本课题组通过构建大鼠生殖系统的热应激模型, 并运用甲基化特异性PCR(methylation specific PCR,MSP)和重亚硫酸盐测序PCR(bisu-lfite sequencing PCR,BSP)检测大鼠睾丸组织中Hspa2 基因启动子区CpG 岛的甲基化状况, 试图揭示热应激条件下HSPA2 表达下调的内在机制。
材料与方法
一、样品采集
动物模型建立、分组与高温模型(热应激组)建立,大鼠睾丸组织取材及保存方法参见本课题组前期研究[2]。
二、主要仪器与试剂
HOPE-MED 8150E 型特定环境智能型模拟实验舱(天津合普公司),基因扩增仪(北京东胜创新生物科技有限公司),Gel Doc XR+凝胶成像系统(美国Bio-Rad公司),EPS 301 Power Supply 电源(美国GE 公司),多功能水平电泳槽HM-I 型 (大连竞迈生物科技有限公司),组织基因组DNA 小量提取试剂盒(北京天漠科技开 发 有 限 公 司,TD325-50),EZ DNA 甲 基 化 试 剂 盒-GOLD (北京天漠科技开发有限公司,D5005),EpiTaq酶(日本Takara 公司,R110Q),OMEGA 胶回收试剂盒(美国Omega Biotek 公司,D2500-01),pMD 19-T Vector Cloning Kit(日本Takara 公司,6013),DH5α 感受态细胞(生工,B528413-0020),X-gal(美国Thermo Fisher Scientific 公司,R0404),IPTG (异丙基-β-D- 硫代半乳糖苷)(生工,A600168-0050)。
三、生物信息学分析
在线查询UCSC 数据库(http://genome-asia.ucsc.edu/cgi-bin/hgGateway?hgsid=1172038731_2dobyI1s0Y9jp I6aHMZWeFcAtRIO&redirect=manual&source=genome.ucsc.edu), 可见大鼠Hspa2 基因启动子区有一个CpG岛(如图1 所示),其总长2670 bp(chr6:99,432,862-99,435,531),内含CpG 总数为217。

图1 CpG 岛在Hspa2基因启动子区位置
四、大鼠睾丸组织基因组DNA 的提取
从热应激组(含8 份睾丸组织样本)和对照组(含8份睾丸组织样本)各随机选出5 份睾丸组织样本,提取大鼠睾丸组织基因组DNA, 并运用紫外吸收法测定所提取的基因组DNA 溶液浓度。
五、大鼠睾丸组织基因组DNA 的C-U 转换
热应激组和对照组每个DNA 样品取200 ng,体积不足20ul 的,用双蒸水补平,具体见表1。使用EZ DNA甲基化试剂盒-GOLD 法得到经重亚硫酸盐处理 (即C-U 转换)并纯化的基因组DNA 溶液。

表1 各DNA 样品浓度、200ng DNA所取体积及双蒸水体积
六、MSP 法检测大鼠睾丸组织中Hspa2 基因启动子区CpG 岛的甲基化
以大鼠Hspa2 基因启动子区CpG 岛的序列为模板,运用Methyl Primer Express v1.0 软件设计针对甲基化和非甲基化序列的引物,如表2 所示,所有引物均由擎科新业生物技术有限公司合成。 以经重亚硫酸盐处理(即C-U 转换)并纯化的基因组DNA 为模板,根据EpiTaq 酶法进行普通PCR(反应体系50 ul,反应条件:94℃预变性20 秒;94℃20 秒,53℃30 秒每完成一轮循环降低0.5℃,72℃60 秒,共10 个循环;94℃20 秒,48℃30 秒,72℃60 秒,共25 个循环)。 PCR 结束后,对反应终产物进行琼脂糖凝胶电泳, 之后将凝胶自电泳糟取出,置于Gel Doc XR+凝胶成像系统照相。
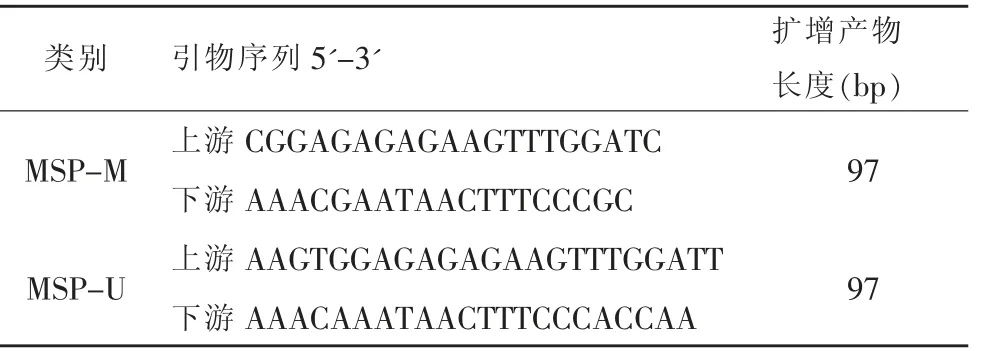
表2 MSP 引物序列及扩增产物长度
七、BSP 法检测大鼠睾丸组织中Hspa2 基因启动子区CpG 岛的甲基化
与MSP 相类似, 运用Methyl Primer Express v1.0软件设计针对BSP 的引物, 如表3 所示, 除引物与MSP 不同外,BSP 其余反应体系及热反应程序设置与MSP 完全一致。PCR 结束之后,将反应液进行琼脂糖凝胶电泳。 根据Marker 指示,运用OMEGA 胶回收试剂盒法割胶提取目的DNA 扩增产物,随后将回收的目的DNA 片段连接至pMD 19-T Vector,并以连接产物转化DH5α 感受态细胞。将转化后的DH5α 感受态细胞置入无抗生素的LB 培养基,37℃振荡培养60 分钟进行扩增,取适量菌液接种至含X-gal 及IPTG 的氨苄平板,用玻璃棒涂抹均匀,37℃放置14h。待菌落长出后,每个平板挑选10 个白色菌落,以37℃振荡培养过夜,最后菌液送擎科新业生物技术有限公司进行测序(一代测序)。

表3 MSP 引物序列及扩增产物长度
八、数据分析
使用Vector NTI Advance 11.5.1 对BSP 测序结果进行比对分析,并将序列中的CpG 位点,根据其甲基化状态的不同,绘制成黑白圈点图(黑色代表甲基化,白色代表非甲基化)。 使用SPSS 20.0 对数据作统计分析。本研究涉及到热应激组和对照组,为两组独立样本,要比较的是两组甲基化率的差异, 可以整理为四格表资料,根据单元格理论频数的实际情况,采用Pearson χ2检验,连续性校正χ2检验或Fisher 确切概率法检验。检验结果的解读:P >0.05 为差异不显著, 结果无统计学意义;P <0.05 为差异显著,P <0.01 为差异极显著,此二者均具统计学意义。
结 果
一、MSP 法检测大鼠睾丸组织中Hspa2 基因启动子区CpG 岛的甲基化情况
从琼脂糖凝胶电泳的结果来分析, 无论是使用甲基化引物,还是非甲基化引物,热应激组和对照组,都能成功扩增出目的DNA 片段,从所拍的片子上均可以看到清晰明亮的条带,如图2A、图2B 所示。 这说明,对两组DNA 样本而言,甲基化引物(或非甲基化引物)所在区域的CpG 位点, 其甲基化与非甲基化状态是同时存在的,也就是都存在部分甲基化,但无从得知二者之间的分布比例。 因此,通过MSP 尚难以判断热应激是否会导致CpG 位点的甲基化状态发生显著改变。

图2 热应激组与对照组MSP 终产物凝胶电泳图
二、BSP 法检测大鼠睾丸组织中Hspa2 基因启动子区CpG 岛的甲基化情况
热应激组及对照组共10 个DNA 样本, 每个样本选择10 个阳性单克隆(依次编号为1-10)进行DNA 测序。从返回的数据来看,只有一个阳性单克隆(对照组4号样本的第2 个阳性单克隆) 测序失败, 测序成功99个。 使用Vector NTI Advance 11.5.1 软件对测序成功的数据进行比对分析后发现, 一部分单克隆并不含目的DNA 片段,另一部分单克隆可能仅含空载体,将这一部分数据予以剔除。
热应激组实际有效的单克隆为:1 号样本的(1-2、1-3、1-4、1-6、1-7、1-9、1-10)号单克隆;2 号样本的(2-3、2-5、2-6、2-8、2-9、2-10)号单克隆;3 号样本的(3-1、3-2、3-3、3-4、3-5、3-7、3-8) 号单克隆;4 号样本的(4-1、4-3、4-5、4-8、4-10)号单克隆;5 号样本的(5-1、5-2、5-7、5-8、5-9、5-10)号单克隆。
对照组实际有效的单克隆为:1 号样本的(1-1、1-3、1-5、1-7、1-8)号单克隆;2 号样本的(2-2、2-4、2-5、2-10)号单克隆;3 号样本的(3-1、3-2、3-3、3-4、3-5、3-6、3-10)号单克 隆;4 号 样 本 的(4-1、4-2、4-4、4-5、4-6、4-7、4-8、4-9、4-10)号单克隆;5 号样本的(5-1、5-3、5-4、5-10)号单克隆。
经BSP 扩增的目的DNA 片段长为259 bp,内含22个CpG 位点。根据Vector NTI Advance 11.5.1 软件比对结果,针对热应激组和对照组每一个样本的不同有效单克隆,绘制黑白圈点图(黑色代表甲基化,白色代表非甲基化),如图3A、图3B 所示。从比对的整体结果来看,热应激组和对照组发生甲基化的CpG 位点均较少, 且分布不规律,无法针对单个CpG 位点进行差异性分析。本课题组以22 个CpG 位点作为整体进行分析,比较热应激组和对照组在这22 个CpG 位点甲基化率的差异。由于热应激组和对照组各个样本有效单克隆的数目不尽相同,为提高数据分析质量,我们从有效单克隆在4 个以上的样本中随机抽取4 个,保证所有样本有效单克隆的数目一致,均为4 个。热应激组和对照组各含20 个有效单克隆,440 个CpG 位点, 其中热应激组发生甲基化的CpG 位点总数为6, 对照组发生甲基化的CpG 位点总数为7。在四格表卡方检验中,所有单元格理论频数均大于5,且样本例数大于40,可以直接读取Pearson χ2检验的结果,χ2=0.078,P=0.780,P >0.05,差异无统计学意义。 因此, 热应激组和对照组在BSP 所扩增的目标DNA 片段内,其甲基化率没有明显差异(P >0.05)。
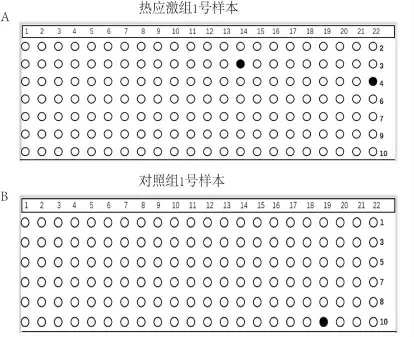
图3 热应激组与对照组各样本有效单克隆CpG 位点的黑白圈点图(黑色代表甲基化,白色代表非甲基化)
讨 论
大量证据显示,HSPA2 在精子发育过程中发挥重要作用, 其表达失调或功能障碍都会显著影响精子发生,并最终引发不育[1]。 既往研究表明,热应激下精子浓度显著降低,精子活性及运动能力受损[10],而精子头部的某些性状也可发生改变,并直接影响受精[11],但其内在机制不明。 有证据显示,热应激可通过一系列途径引发生精细胞凋亡[12-14],但这些研究仅能从一定角度说明精子数量减少的根本原因, 很难解释热应激所致的精子活性及运动能力损伤。
本课题组前期研究发现, 热应激可导致大鼠睾丸中HSPA2 表达水平降低[2],这是一个非常有意思的发现, 同时也为热应激致精子发育受损的内在原因提供了一个可能的解释。 但热应激条件下HSPA2 表达下调的本质原因却不清楚。 既往研究表明,表观遗传机制可能是调控HSPA2 表达的首要因素[4],而DNA 甲基化则是调节人类细胞中HSPA2 表达最重要的表观遗传机制之一[5,6]。 本研究试图通过已经构建的大鼠生殖系统的热应激模型,运用MSP 和BSP 技术去探索甲基化在热应激致HSPA2 表达下调过程中可能发挥的作用。
从本次实验MSP 的结果来看,热应激组和对照组的所有DNA 样本,在MSP 所研究的区域(即引物结合区域)都同时存在着甲基化和非甲基化两种状态。 由于MSP 的局限性, 还难以判断热应激是否引起甲基化状态的变化。 但可以推测,热应激组和对照组可能存在甲基化率的差异,这是BSP 要回答的问题。
从本实验BSP 的结果分析, 热应激组和对照组在BSP 目标扩增区域的甲基化率都很低, 且差异无统计学意义(P >0.05)。
综合MSP 和BSP 的结果来看,热应激在短时间内导致HSPA2 的表达下调, 可能不是通过DNA 的甲基化修饰来实现的, 尽管甲基化是由甲基转移酶来催化完成的(从理论上说,这个过程并不需要很长时间)。 但同时需要注意的是,本次BSP 实验涉及的259 bpDNA 片段只是全长2670bp 的CpG 岛中很小一段区域, 因此不能完全排除热应激通过甲基化修饰来下调HSPA2 表达的可能性。如前所述, 在众多肿瘤细胞系中检测到了HSPA2 基因甲基化,且多数研究显示,这种甲基化导致了HSPA2 表达水平降低。但甲基化在这些肿瘤细胞系中发生的内在原因是未知的。 尽管如此,我们可以推测,HSPA2 基因甲基化很可能与HSPA2 表达水平降低高度相关。
总而言之,热应激致HSPA2 表达下调的机制可能是多方面的, 甲基化修饰是可能的机制之一。 直到目前, 关于HSPA2 表达调控机制的研究还非常有限,究竟是转录调控为主,还是表观调控为主,都还具有极大的不确定性。
毫无疑问, 对HSPA2 表达调控机制的深入研究是有重大意义的,这对于解决诸多因HSPA2 表达或功能失常所致的不育问题大有裨益。同时,有助于我们更好地认识热应激致HSPA2 表达下调的深层原因,对于推动解决热应激致精子发育损伤的问题也是有重大帮助的。
