调强放疗联合小剂量阿帕替尼治疗老年食管癌的疗效观察
2022-03-08王玉芳刘美荣李明君
王玉芳 刘美荣 李明君
中国是全球食管癌风险最高的地区之一[1],病人就诊时,多数处于中晚期,失去手术机会。随着社会老龄化加剧,高龄食管癌病人所占的比重逐渐增多[2],≥75岁的病人在食管癌病人中约占20%,死亡率高达31.1%[3]。国内外指南均推荐:不能手术的局部晚期食管癌建议同步放化疗,不能耐受同步放化疗者建议根治性放疗。临床上很多高龄病人身体耐受性差,不能耐受同步放化疗,也有很多老年病人因对化疗的恐惧,直接拒绝全身化疗,但单纯放疗治疗晚期食管癌5年生存率有限。同时,老年病人往往合并症较多、一般行为评分较低,同步放化疗所带来的不良反应也需要足够重视。随着靶向治疗的发展,低毒高效的靶向治疗联合放疗能否成为一种治疗新选择,目前尚无定论。阿帕替尼是我国首个上市的小分子抗血管生成靶向药,能够有效改善微环境,退化/正常化肿瘤血管,达到有效的抗肿瘤治疗作用,且口服给药,服用方便,病人较容易接受。阿帕替尼在晚期食管癌二线治疗中已经有较多研究,多取得出色表现[4-5]。但目前阿帕替尼单药联合食管癌放疗研究很少,尤其针对老年食管癌病人更鲜有报道。本文以2017年1月至2019年7月在我院接受治疗的60 例老年食管鳞癌初治病人为研究对象,对比小剂量阿帕替尼联合放疗与单纯放疗治疗老年食管癌的临床疗效及不良反应,现报道如下。
1 资料与方法
1.1 病例选择 回顾性分析我院2017年1月至2019年7月收治的60例老年食管癌病人。纳入标准:(1)病理均为食管鳞癌;(2)拒绝手术和不能手术且不愿接受化疗;(3)卡氏功能状态评分(Karnofsky performance status,KPS)>70分;(4)年龄60~85岁,预计生存期>6个月;(5)血常规、尿常规、血生化及凝血功能检查基本正常。排除标准:(1)合并严重心、肺、肝功能障碍;(2)存在其他部位肿瘤、远处转移;(3)合并自身免疫性疾病;(4)患有高血压且经降压药物治疗无法降至正常范围(收缩压>140 mmHg,舒张压>90 mmHg);(5)食管有穿孔倾向或呕血。按治疗方案分为单纯放疗组和阿帕替尼联合放疗组,每组30例。2组病人基线特征比较,差异均无统计学意义(P>0.05),见表1。所有接受治疗的病人均自愿参与研究,并签署了知情同意书。

表1 2组食管癌病人临床资料比较(n, n=30)
1.2 治疗方法 2组病人均采用调强放射治疗。采取直线加速器6 MV X线进行调强放疗,肿瘤靶区(gross tumor volume,GTV):包括影像可见原发食管肿瘤灶和转移淋巴结区域;临床靶区(clinical target volume,CTV):GTV上下外扩3 cm,四周外扩0.6 cm,包括转移区域淋巴结的累积野照射,按解剖结构修改。并在CTV基础上勾画计划靶区(planning target volume,PTV),95%的等剂量线包PTV,照射总剂量为60~66 Gy,常规分割(5次/周,1.8~2 Gy/次)。脊髓最大剂量(Dmax)<45 Gy,心脏 V40<50%,两肺 V20<30% 。联合治疗组在放疗过程中给予阿帕替尼治疗:甲磺酸阿帕替尼片 (艾坦)(国药准字 H20140103)250 mg/d,口服,病人在结束放疗后,继续给予阿帕替尼维持治疗至疾病进展或出现不可耐受的不良反应。
1.3 观察指标及评价标准 临床完全缓解(complete responce, CR)指吞咽困难症状消失且食管X线片上肿瘤完全消失;部分缓解(partial responce, PR)指食管X线片上肿瘤长径缩短>30%,且吞咽困难症状改善[6]。根据CR+PR计算总缓解率(overall response rate, ORR)。肿瘤缓解深度(depth of response, DPR)即靶病灶从基线到肿瘤最大缩小的比例,根据肿瘤靶病灶较基线最大减少百分比将DPR分为4个级别:0~25%、26%~50%、51%~75%和76%~100%,无论是否出现新病灶。急性不良反应按照美国肿瘤放射治疗协助组(RTOG)急性放射损伤分级标准进行评价[7];并按照美国国立癌症研究院通用不良事件术语标准4.03版(CTCAE v4.03),记录药物不良反应等级、疾病进展时间及死亡时间、死亡原因,并进行生存分析。采用电话、门诊复诊方式回访,放疗后每3个月复查1次,2年后每半年复查1次。随访内容包括体格检查、血液学检查、胸部/上腹部 CT、食管钡餐透视、胃镜等检查。
1.4 统计学方法 采用SPSS 23.0统计软件进行数据分析。计数资料以百分比描述,组间比较采用χ2检验,生存率计算采用Kaplan-Meier法,比较采用log rank法,以P<0.05为差异有统计学意义。
2 结果
2.1 2组近期疗效分析 所有病人均能按计划完成放疗,单纯放疗组CR 3例(3/30),PR 18例(18/30),ORR为70%(21/30);联合组CR 3例(3/30),PR 20例(20/30),ORR为 76.67%(23/30),2组ORR差异无统计学意义(P>0.05)。联合组DPR 达76%~100% 4例(4/30),51%~75%18例(18/30),DPR≥50%占73.34%(22/30);单纯放疗组DPR达76%~100% 4例(4/30),51%~75%10例(10/30),DPR≥50%占46.67%(14/30),2组DPR差异有统计学意义(P=0.035)。
2.2 2组无进展生存期(PFS)比较 联合组病人中位PFS为16.0个月,95%CI为6.607~25.393个月,单纯放疗组病人中位PFS为11.0个月,95%CI为6.706~15.294个月 ,2组比较,差异有统计学意义(P=0.042)。
2.3 2组总生存期(OS)比较 2组OS曲线比较,差异无统计学意义(P=0.064),联合组病人2年生存率为49.00%,略高于单纯放疗组病人的40.00%。
2.4 2组不良反应 联合组放射性食管炎发生率为73.34%(22/30),单纯放疗组放射性食管炎发生率为76.67%(23/30),差异无统计学意义(P>0.05);联合组其他的主要不良反应有:蛋白尿(23.33%)、高血压(20.00%)、中性粒细胞减少(20.00%)、手足综合征(10.00%),均为Ⅰ~Ⅱ级不良反应。见表2。
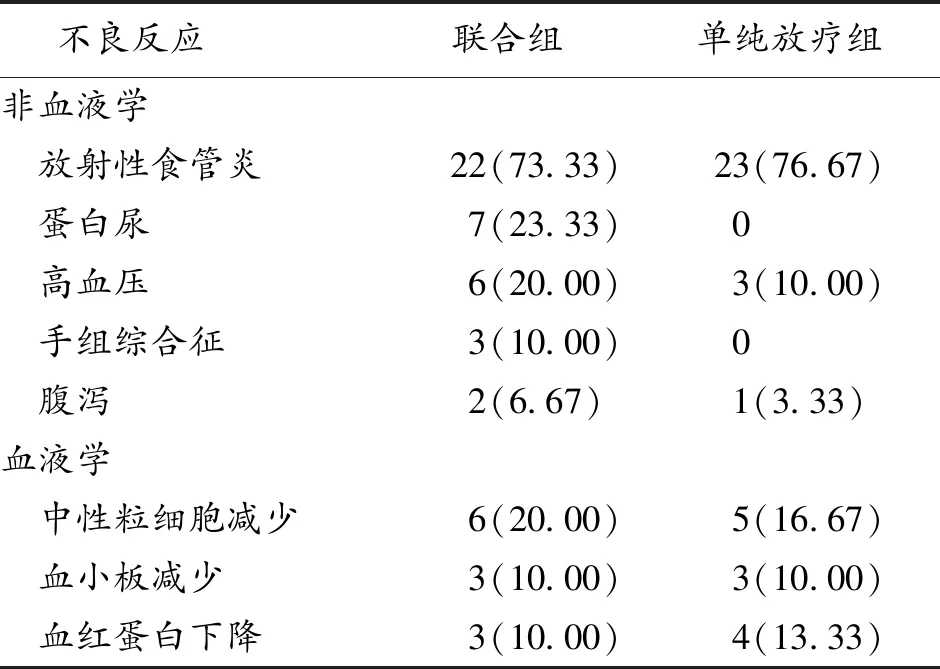
表2 2组病人的不良反应(n,%, n=30)
3 讨论
血管新生对实体肿瘤的生长非常重要,肿瘤组织通过新生成的血管获取氧气和营养物质,以实现持续生长和转移[8],目前抗血管生成药在食管癌治疗中的研究已经成为热点,有些已经取得了不错的结果。例如大分子的雷莫卢单抗及小分子的阿帕替尼和安罗替尼分别被美国国立综合癌症网络及中国临床肿瘤学会指南推荐作为晚期食管癌二线及后线治疗[9-10]。对于不能手术的局部晚期食管癌,放疗是最主要的治疗方式,但单纯放疗有效率有限,老年人同步放化疗耐受性差,给予抗血管生成的靶向药物联合放疗能否增加疗效,目前相关研究甚少。体外研究显示,阿帕替尼可以抑制食管癌肿瘤细胞的增殖,促进凋亡及诱导细胞周期再分布,增加食管癌Kyse-150细胞的放射敏感性[11]。肖宏卫等[12]回顾性分析60 例老年食管鳞癌病人,分为2组,A 组采用阿帕替尼(250 mg/d)+ 卡培他滨(40 mg/次,2次/d)+三维适形放疗,B组采用卡培他滨(1000 mg/m2,2次/d)+三维适形放疗,发现应用阿帕替尼+卡培他滨小剂量联合三维适形放疗方案治疗可提高治疗有效率,减少药物不良反应的发生率,提高病人生存质量,增加病人对治疗的耐受性和依从性。
本研究入组对象同样为老年人,为安全性考虑,联合组放疗同时给予的阿帕替尼也为小剂量,但治疗中未加入化疗。本研究发现,小剂量阿帕替尼联合放疗未能改善ORR,但是联合组的PFS显著提高。最近的研究表明,DPR与病人的生存相关,包括肺癌、结直肠癌等[13-15],本研究进一步分析对比了2组的肿瘤DPR,发现联合组DPR≥50%比例(73%)高于单纯放疗组(47%),这可能是联合组PFS显著延长的主要原因。DPR在食管癌治疗评估中的价值需要进一步研究验证。另外,本研究发现2组的OS差异无统计学意义,具体观察到2组病人出组后继续接受化疗治疗的比例显著不均衡(联合组40%比单纯放疗组70%,P=0.02),提示后线治疗比例不平衡可能一定程度影响OS,但需要进一步验证。
本研究中小剂量阿帕替尼联合放疗并未使得放射性食管炎发生率增加,且小剂量阿帕替尼联合放疗未出现Ⅲ级以上高血压、蛋白尿等不良反应,证明了小剂量阿帕替尼较为安全,老年病人依从性好。但是,本研究病例数较少,且阿帕替尼为小剂量给药,不同的给药剂量对结果的影响需进一步研究。
