外源赤霉素GA3施加对紫花苜蓿-根瘤菌共生体系的影响
2022-03-08何玉娟李东琴对山艾力卡布吐拉
何玉娟, 李东琴,2, 邓 波*, 杨 军, 对山艾力·卡布吐拉, 杨 超
(1.中国农业大学草业科学与技术学院, 北京 100193; 2.甘肃省酒泉市林果服务中心, 甘肃 酒泉 735000; 3.乌鲁木齐绿之园园林开发有限公司, 新疆 乌鲁木齐 830000; 4.特克斯县林业和草原局, 新疆 特克斯 8355005; 5.天山西部国有林管理局特克斯分局, 新疆 特克斯 835500)
在根瘤菌与植物的共生过程中,植株为了平衡碳水化合物的支出与氮素收入,会通过生长素、赤霉素、细胞分裂素、乙烯以及脱落酸等植物激素进行局部调控[1]。其中,赤霉酸(Gibberellins或Gibberellic acid,GA)是基于赤霉烷结构的一类植物激素,是典型的植物生长调节剂,参与细胞分裂和种子发芽等生理过程[2],根瘤菌的侵染、根瘤原基的建立和根瘤结构的成熟都需要GA[3]。有研究发现植物形成根瘤的不同阶段合成GA基因上调,表明结瘤期间GA作用于植物根毛卷曲、侵染线和根瘤原基的形成[4-5]。大豆(Glycinemax)接种根瘤菌12 h后,参与GA合成的基因显著上调,增加早期结瘤过程中活性GA的水平[3,6],而田菁(Sesbaniarostrata)和百脉根(Lotusccorniculatus)根瘤中结瘤的后期阶段GA的合成基因上调[4-5]。接种根瘤菌之前,用GA生物合成抑制剂作用于芸扁豆(PhaseoluslunatusL.)和田菁(Sesbaniarostrata)可抑制或完全阻断根瘤的形成[4,7]。Dobert等和Lievens等分别发现赤霉素和G420氧化酶基因在芸扁豆(PhaseoluslunatusL.)和田菁的根瘤、细菌侵染线和前感染区中有较强表达力[7]。此外,外源施加GA可弥补内源GA的不足或缺失,即在合适的条件下,外源GA可发挥与内源GA同样的作用,外源施加GA能够促进结瘤[8],现在已鉴定出赤霉素的形式有130多种,但是仅仅只有几种具有生物活性,如真菌产物赤霉素GA3或赤霉酸。Ferguson发现赤霉素GA生物合成变异株形成根瘤数显著少于野生型,当赤霉素信号途径受损时,豌豆(Pisumsativum)突变株的根部结瘤过程受到抑制,外源加入GA时,结瘤数目又恢复正常[9]。但也有研究结果显示,在百脉根结瘤过程中,赤霉素信号途径的正调控因子LjSLEEPYl基因的过表达显著减少了百脉根的结瘤数;外源施加GA抑制了在表皮发生的根毛卷曲现象,并且抑制了NSP2和NIN的表达[5]。引起这种差异的原因可能是豆科植物种类、植株生长条件、应用技术以及赤霉素的形态和浓度等[3],过高或过低浓度的赤霉素都会抑制根瘤的形成。
目前,赤霉素在结瘤过程中的作用主要集中在大豆、田菁等一年生植物上,对于外源施加不同浓度梯度赤霉素对紫花苜蓿结瘤过程的影响鲜见报道。本研究通过外源添加赤霉素于苜蓿-根瘤菌共生体系中,研究其对苜蓿-根瘤菌结瘤效果的影响,并进一步探究外源赤霉素对苜蓿结瘤过程中具体的作用阶段。
1 材料与方法
1.1 供试材料
本文所用苜蓿品种为‘中苜1号’(MedicagosativaL. ‘Zhongmu No. 1’),由中国农业科学院北京畜牧兽医研究提供。苜蓿中华根瘤菌gfp-Sm1021(抗400 mg·L-1硫酸链霉素(str)及80 mg·L-1壮观霉素)由中国农业大学生命科学学院国家农业生物技术国家重点实验室提供,赤霉素GA3购于西格玛奥德里奇(上海)贸易有限公司Sigma官网。
1.2 试验设计与方法
1.2.1外源赤霉素对苜蓿-根瘤菌共生体系结瘤效果的影响试验 采取试管培养的方式,将发芽的种子以无菌操作方式播于装有滤纸条的试管,在幼苗根尖施加20 μL浓度梯度为10-2,10-3,10-4,10-5,10-6,10-7,10-8,10-9,10-10mol·L-1的GA3,以不施GA3为对照,共10个浓度,每种浓度3个重复,每个重复5株,共150株。随后接种处理好的苜蓿根瘤菌50 μL(根瘤菌采用YEM液体培养基,温度28℃,180 r·min-1振荡培养,根瘤菌培养至48 h对数生长稳定期),并加灭菌的Fahraeus无氮营养液15 mL,置于22~28℃温室中培养,每天光照16 h。接种后第10 d开始记录根瘤数量,每隔5 d记录一次,直至第35 d天,培养至第20 d记录植株茎长和根长。
1.2.2外源赤霉素对根毛卷曲和根瘤原基的影响试验 选取长势一致的幼苗转移到带滤纸的方形培养皿,每个培养皿放置4株幼苗,幼苗根系施用 0(对照)、10-5和10-9mol·L-1的GA3溶液20 μL,随后接苜蓿根瘤菌50 μL,以开始接种起记为0 h,每个处理10个重复,共计30株幼苗。接种48 h后,利用体式显微镜(OLYMPUS SZX18)观测根毛卷曲的整体趋势,随后放于光学显微镜(OLYMPUS BX53)10倍镜下,随机选取10个连续不重复的视野,数出总根毛数以及卷曲根毛数,用Camon DS126 271拍照开始观察根毛卷曲情况;接种72 h后,开始观察根瘤原基发育情况。依次进行取材、脱水、包埋后将修整好的蜡块置于石蜡切片机上切片,片厚4 μm。切片漂浮于摊片机40℃温水上将组织展平,用载玻片将组织捞起,放进60℃烘箱内烤片,待水烤干蜡烤化后经HE染色、脱水封片将切片从二甲苯溶液中取出稍晾干,中性树胶封片。置于Nikon Eclipse ci显微镜镜检,图像分析用Nikon DS-U3采集。染色结果为:细胞核蓝色,细胞质红色。
1.2.3外源赤霉素对根系分泌木犀草素的影响试验 选取幼苗根系长至2~3 cm左右的苜蓿,转移到大搪瓷盘,根系施用0(对照)、10-5和10-9mol·L-1的GA3溶液20 μL,随后接苜蓿根瘤菌50 μL,以开始接种起记为0 h,在接种后12 h,24 h,36 h,48 h进行取样,剪去苜蓿幼苗根称取0.75 g鲜样,在液氮中迅速将材料充分研磨成粉末状,把粉末转移至2.5 mL离心管中,加入2 mL 80%的乙醇提取液,超声提取4 h,13 400 r·min-1离心15 min,将上清液转入2 mL离心管中,用0.45 μm滤膜过滤样品,利用高效液相色谱检测木樨草素含量。每个处理10个重复,共计30株幼苗。
1.2.4外源赤霉素对根瘤菌生长的影响试验 在浓度为10-5mol·L-1和10-9mol·L-1的YMA液体培养基中接入苜蓿根瘤菌种子液5 mL,以未添加GA3处理为对照,每隔6 h测定各处理菌液吸光度值(Optical density)和pH值,测量时间为6 h,12 h,18 h,24 h,30 h,36 h,42 h,48 h,54 h,60 h,66 h,72 h,每个处理3个重复,共108瓶。用分光光度计(UH5300)在600 nm处测量各处理菌液OD值,pH值采用pH计(PB-10)测定;采用乙烯还原法测定根瘤菌的固氮酶活性,在浓度为10-5mol·L-1和10-9mol·L-1的LNB5液体培养液中按1%接种量接种苜蓿根瘤菌,随后用橡胶瓶塞密封,再用封口膜密封一次,用注射器吸出1 mL空气,然后注入等体积的乙炔,再次用封口膜密封一次,培养24 h后,利用岛津GC-2010气相色谱仪测定乙烯生成速率。
1.2.5外源赤霉素对苜蓿根瘤菌相关基因的影响试验 用浓度为10-5mol·L-1和10-9mol·L-1GA3处理苜蓿根瘤菌后,采用TriZol法进行总RNA提取;并采用定量检测(仪器:BioTek-Epoch)和琼脂糖荧光定量检测对苜蓿根瘤菌提取的RNA进行质量鉴定;对苜蓿根瘤菌反转录制备cDNA稀释30倍后作为模板,采用ABI 7 500 Real Time PCR仪(美国Applied Biosystem公司)进行Real-Time PCR扩增(表1,表2)。
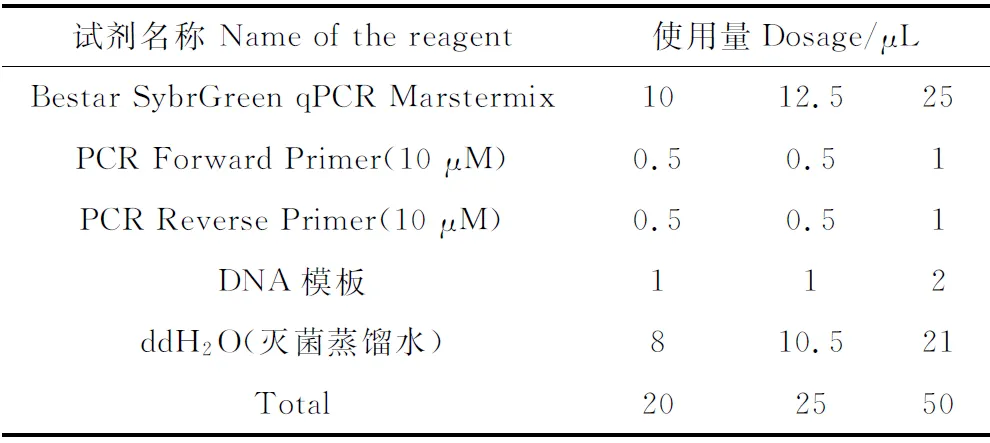
表1 Real-Time PCR反应体系Table 1 The reaction system of Real-Time PCR

表2 荧光定量PCR引物Table 2 Primers developed in this study
1.3 数据分析
运用Excel整理数据,制作相关图表;采用SPSS 19.0 软件对所测数据进行统计和分析;苜蓿根瘤菌cDNA进行Real-Time PCR扩增数据分析采用SDS2.3(美国Applied Biosystem公司)分析。
2 结果与分析
2.1 外源赤霉素对苜蓿-根瘤菌共生体系结瘤效果的影响
2.1.1根瘤数的变化 植株根瘤数随着生长时间的增加均呈现增加的趋势,在同一时间(天)内,随着赤霉素浓度的降低,植株结瘤数呈现出先增大后降低的变化趋势(P<0.05,表3)。当外源赤霉素的稀释浓度为10-9mol·L-1时,苜蓿根瘤数最多,显著大于对照根瘤数(P<0.05);稀释浓度为10-10mol·L-1时,苜蓿根瘤数降低,与对照无显著性差异;外源赤霉素浓度为10-6~10-2mol·L-1时的根瘤数显著少于对照(P<0.05)。稀释浓度10-7mol·L-1和10-8mol·L-1时,植株结瘤数与对照无显著性差异。

表3 不同浓度GA3对根瘤数的影响Tabel 3 Effects of different concentrations of GA3 on nodule number
2.1.2干鲜重的变化 植物的生长与氮素的吸收和利用密切相关,干鲜重是描述苜蓿产量的重要指标。图1显示,随着外源赤霉素稀释浓度的降低,植株干重和鲜重的变化趋势一致,都呈现出先增大后降低的变化趋势(P<0.05)。当外源赤霉素的浓度为10-9mol·L-1时,植株干重和鲜重最大,显著大于对照(P<0.05);当外源赤霉素的稀释浓度增大到10-10mol·L-1时,植株干重和鲜重降低,与对照无显著性差异,显著小于10-9mol·L-1(P<0.05)。外源赤霉素浓度为10-6~10-2mol·L-1时,植株干重与鲜重显著小于对照(P<0.05)。10-7mol·L-1和10-8mol·L-1赤霉素处理的植株干鲜重与对照无显著差异。
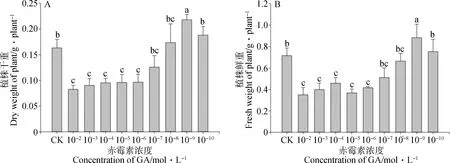
图1 不同浓度GA3处理对幼苗干重(A)、鲜重(B)的影响Fig.1 Effects of different concentrations of GA3 on plant dry (A) and fresh weight(B)
2.1.3外源赤霉素对苜蓿-根瘤菌共生体系幼苗根长和茎长的影响 赤霉素可以刺激茎的节间伸长,促进细胞分裂和细胞伸长。随着外源赤霉素浓度的逐渐降低,植株根长(图2 A)表现为先升高后降低的变化趋势(P<0.05),茎长(图2 B)表现为逐渐降低的变化趋势。外源赤霉素的稀释浓度为10-2mol·L-1和10-3mol·L-1时,苜蓿-根瘤菌共生体系茎长显著大于对照(P<0.05),浓度10-2mol·L-1和10-3mol·L-1间无显著性差异;当外源赤霉素的浓度为10-9mol·L-1时,苜蓿-根瘤菌共生体系根长显著大于10-2mol·L-1和10-3mol·L-1时的根长(P<0.05),但与对照无显著性差异。
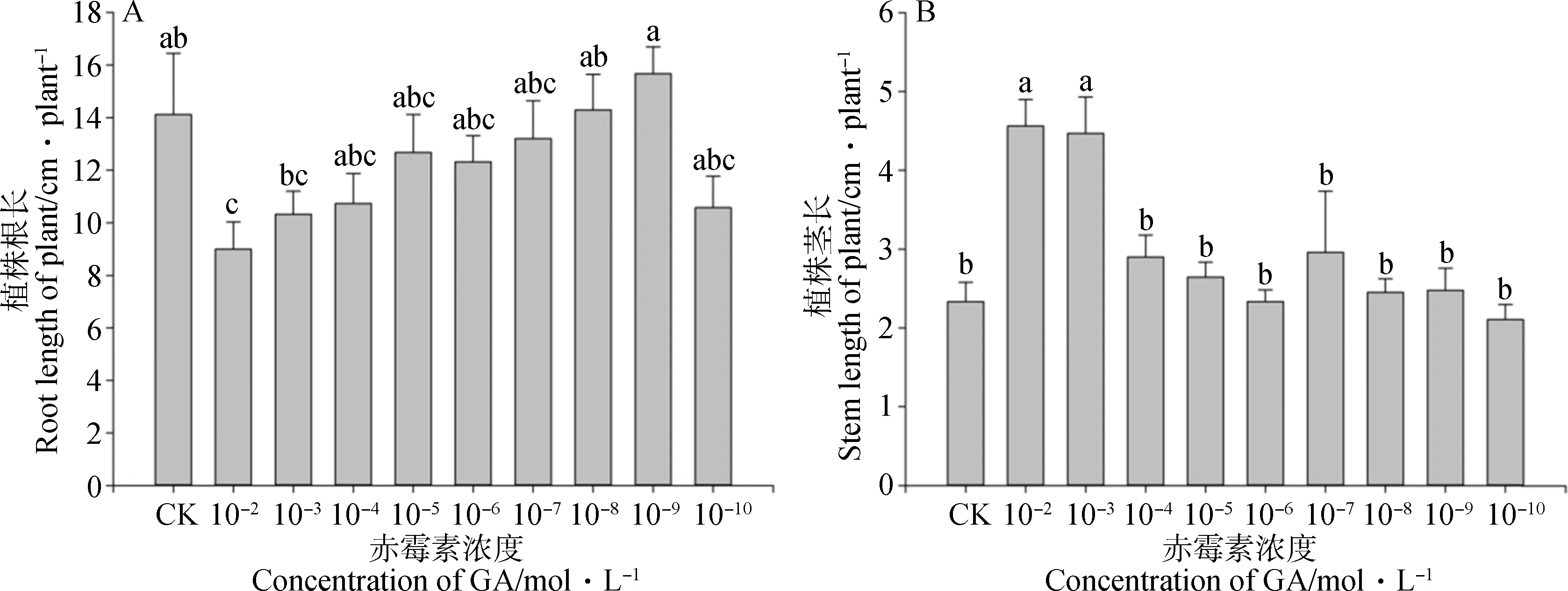
图2 不同浓度GA3处理对幼苗根长(A)、茎长(B)的影响Fig.2 Effects of different concentrations of GA3 on plant shoot(A) and root length(B)
2.2 外源赤霉素对根瘤原基和根毛卷曲的影响
根瘤原基数量随着赤霉素浓度发生变化(图3),10-9mol·L-1GA3处理下,根瘤原基数量显著多于对照(P<0.05),10-5mol·L-1GA3处理下根瘤原基数量虽然减少,但是与对照相比差异不显著。

图3 不同浓度的GA3对根瘤原基的影响Fig.3 The effect of different concentrations of GA3on nodule primordium
由染色切片结果可以看出,接种72 h后,10-9mol·L-1GA3处理下,根部皮层位置区域有蓝色细胞核的聚集,细胞分裂活跃,且聚集数量较多(图4);10-5mol·L-1GA3处理下,并无明显的蓝色细胞核聚集,细胞分裂不活跃。

图4 用10-5与10-9 mol·L-1 GA3处理根瘤原基情况(接种后72 h)Fig.4 Root hairs treated with 10-5,10-9 mol·L-1 GA3(Analysis was preformed 72 h after inoculation)
与对照相比,10-5mol·L-1的GA3处理植株根系后,根毛卷曲率显著降低(P<0.01),10-9mol·L-1GA3处理后,与对照差异性不显著。10-5mol·L-1的GA3处理植株根毛卷曲率与对照相比下降93.47%,10-9mol·L-1GA3处理根毛卷曲率下降14.71%(图5,图6)。

图5 不同浓度的GA3对根毛卷曲的影响Fig.5 The effect of different concentrations of GA3on root hair deformation

图6 用10-5和10-9 mol·L-1 GA3处理后根毛卷曲情况(接种后48 h后分析显微镜20倍镜下观察结果)Fig.6 Root hairs treated with 10-5,10-9 mol·L-1 GA3(Analysis was preformed 48 h after inoculation)
2.3 外源赤霉素对根系分泌木犀草素的影响
在接种根瘤菌后,随着时间的增加,植株根系分泌木犀草素的含量呈现先增加后减少的趋势,在第36 h左右达到最大。与对照相比,10-9mol·L-1GA3处理下木犀草素含量显著增高(P<0.05),10-5mol·L-1GA3处理下木犀草素含量与对照相比差异不显著(表4)。

表4 不同浓度GA3处理对苜蓿根部木犀草素含量的影响Table 4 Effect of shoot-applied GA3 on the component of luteolin in afalfa roots 单位:μg·g-1
2.4 外源赤霉素对苜蓿根瘤菌生长的影响
2.4.1根瘤菌数量的变化 如图7所示,培养24 h后,当培养基中添加10-9mol·L-1GA3时,苜蓿根瘤菌的数量与对照相比无显著差异,然而10-5mol·L-1GA3处理的苜蓿根瘤菌的数量显著下降(P<0.05)。培养72 h后,外源添加GA3处理的苜蓿根瘤菌数量均高于对照(P<0.05),10-5mol·L-1GA3处理下的苜蓿根瘤菌OD值达到0.96,而10-9mol·L-1GA3处理下的苜蓿根瘤菌OD值为1.16。

图7 不同浓度的GA3对苜蓿根瘤菌OD值的影响Fig.7 Effects of different concentrations of GA3 on the OD value of rhizobium alfalfa
2.4.2根瘤菌pH的变化 如图8所示,在培养的72 h内,经GA3处理的苜蓿根瘤菌pH始终低于对照。然而,10-5mol·L-1GA3处理下,虽然在培养过程中的pH维持在6~7之间,但是该处理的pH下降速度也快于低浓度10-9mol·L-1GA3处理下的pH降低速度,且两种处理下在第36 h下降的最快。

图8 不同浓度的GA3对苜蓿根瘤菌pH值的影响Fig.8 Changes in pH value during the process of sinorhizobium meliloti culturing in different concentration of GA3
2.4.3根瘤菌固氮酶活的变化 未经GA3处理的苜蓿根瘤菌固氮酶活性平均值为0.21 μL·mL-1·d-1。而在培养基中添加10-9mol·L-1GA3处理的苜蓿根瘤菌固氮酶活性平均值上升至0.24 μL·mL-1·d-1,上升了14.3%,达到显著水平(P<0.05),而10-5mol·L-1GA3处理下与对照相比差异不显著(图9)。

图9 不同浓度的GA3对苜蓿根瘤菌固氮酶活性的调控Fig.9 Effect of GA3 on nitrogenase activity of alfalfa rhizobium
2.5 外源赤霉素对苜蓿根瘤菌相关基因的影响
经10-9mol·L-1GA3处理的苜蓿根瘤菌的nodA,nodD,nifA,nifH,fixA,fixK基因相对表达量均上调,且与对照相比有显著性差异(P<0.05),而经10-5M GA3处理的苜蓿根瘤菌的nodA,nodD,nifA,nifH,fixA,fixK基因相对表达量与对照相比无显著性差异,说明适当浓度的GA3可以刺激根瘤菌基因的表达(图10)。
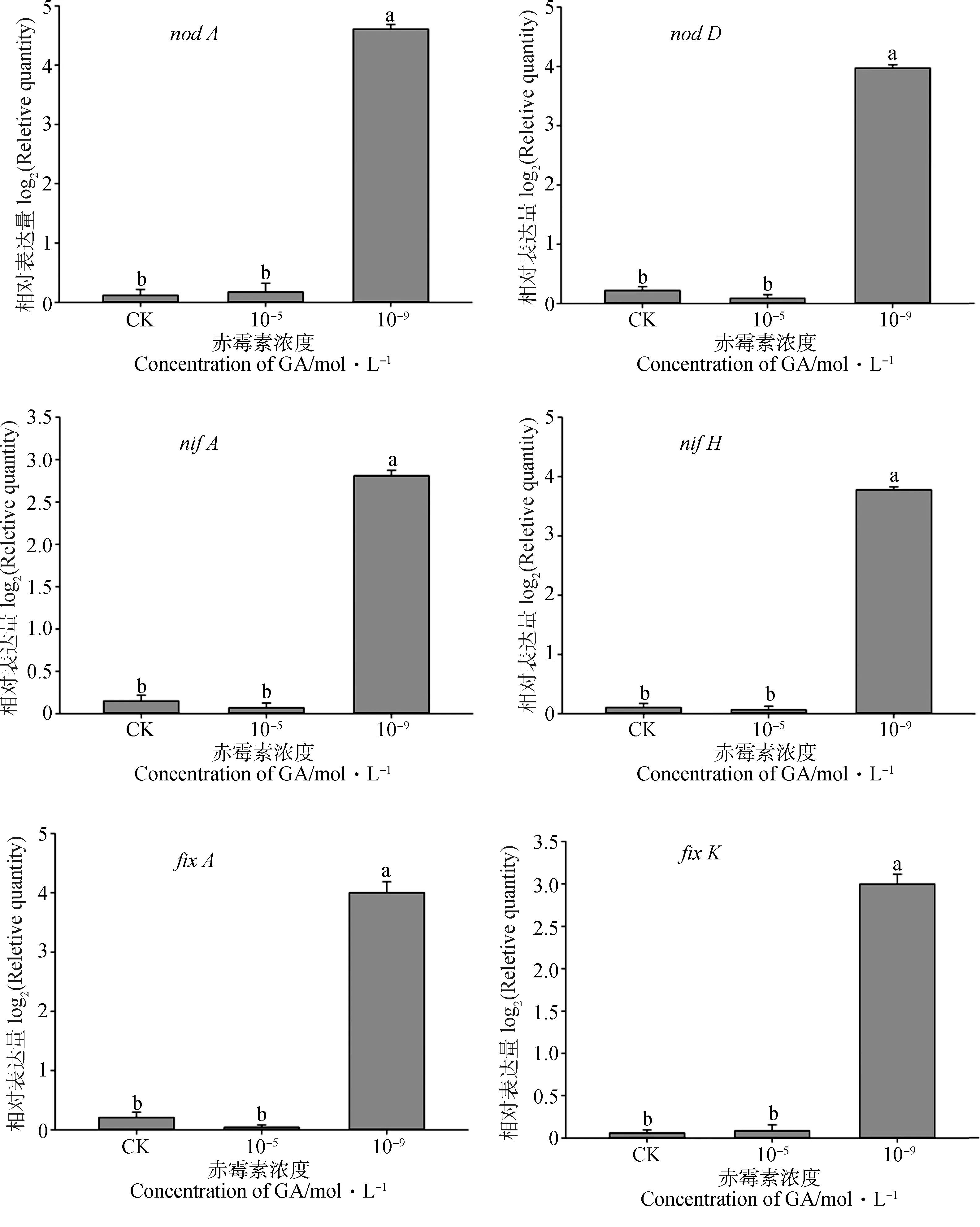
图10 苜蓿根瘤菌nod A,nod D,nif A,nif H,fix A,fix K基因荧光定量PCR相对表达量Fig.10 Relative expression of quantitive-time PCR for nod A,nod D,nif A,nif H,fix A,fix K from Sinorhizobium meliloti
3 讨论
3.1 外源赤霉素添加对紫花苜蓿结瘤过程的影响
根毛是根系特异表皮细胞外伸形成的管状突出物,位于根尖且具有结瘤活性的植物根毛可以识别根瘤菌分泌的nod因子,引发钙离子振荡,使细胞骨架发生改变,最终引起根毛卷曲[10],本研究发现10-5mol·L-1GA3的赤霉素能够抑制根毛卷曲,这与Maekawa研究结果一致[5],但10-9mol·L-1GA3的赤霉素并没有促进根毛卷曲的发生。植物根毛识别结瘤因子后,位于G0/G1期的内皮层细胞随即开始分裂,形成根瘤的起始原基,随后,植株根系中皮层细胞分裂分化,形成根瘤原基[11-12]。本研究结果表现为10-9mol·L-1GA3促进根瘤原基的形成,10-5mol·L-1GA3对根瘤原基的形成并无影响,Maekawa研究发现高浓度10-6mol·L-1GA3处理抑制百脉根根瘤原基的形成[5]。这可能是因为不同根瘤类型对不同浓度的GA3响应不一样,苜蓿形成的为无限根瘤,而百脉根形成有限根瘤,赤霉素在两种类型根瘤形成中扮演着相反的作用。
类黄酮物质是诱导根瘤菌结瘤因子表达的主要物质,其含量的增加能在一定程度上促进根瘤菌结瘤因子的表达,进而引起一系列结瘤相关的生理生化反应,促进结瘤发生[13-14]。当固氮调控基因与寄主分泌的诱导物质类黄酮化合物木犀草素反应结合后,结瘤基因才能表达,结瘤基因的表达产物能够合成一种称为结瘤因子的物质,它能诱导植物根毛发生一系列的形态和生理方面的变化,最终促进根瘤的形成[15-16]。本研究结果表明在10-9mol·L-1GA3处理下,木犀草素含量显著性增加,然而10-5mol·L-1GA3处理下,能够抑制木犀草素的分泌。随着GA3处理时间的增加,10-9mol·L-1GA3处理组的木犀草素合成量逐渐增加,而且比对照组高,这与冯思琼研究结果一致[17],表明10-9mol·L-1GA3处理能促进植物根部次级代谢物异黄酮的分泌。
影响和决定根瘤菌共生固氮效率的因素来自土壤生态环境、宿主植物和根瘤菌三个方面。在本研究中,我们发现外源添加10-9mol·L-1GA3可提高根瘤菌的固氮酶活性,对苜蓿根瘤固氮酶活性产生直接影响。10-5mol·L-1GA3处理下的苜蓿根瘤菌在其培养过程中伴随着pH的迅速下降,根瘤菌的生长速率表现出下降和减慢的趋势,我们分析这可能是GA3培养基pH动态下降导致生长速率下降,而且根瘤菌的发育受到添加到培养基中的GA3浓度的直接调控,这与周圣骄等的研究结果一致[18],他发现适宜浓度GA3可使大豆根瘤菌在培养基的生长速率和数量显著提高。豆科牧草的结瘤数量是决定固氮效率的关键因子,也是涉及到牧草产量和品质的重要农艺性状,本试验研究结果表明,从接种第10 d到第35 d的苜蓿根瘤数整体变化都呈现出先增大后降低的变化趋势。接种第35 d后,10-9mol·L-1GA3处理显著增加苜蓿根瘤数,10-5mol·L-1GA3处理根瘤数显著减少,说明通过外源添加10-9mol·L-1GA3可促进根瘤的形成。
3.2 外源赤霉素添加对苜蓿根瘤菌相关基因表达的影响

4 结论
10-9mol·L-1的外源赤霉素的添加可促进nod基因的表达,增加植株根系黄酮类物质的分泌量,诱导形成更多且活性更强的根瘤原基,提高苜蓿根瘤结瘤数。
