植物根毛发育调控机制的研究进展
2023-05-21裘喻平王益川郭红卫
裘喻平 王益川 郭红卫*
(1.南方科技大学-北京大学植物与食品联合研究所,广东省普通高校植物工厂分子设计重点实验室,深圳 518055;2.南方科技大学生命科学学院,深圳 518055)
根毛是植物根表皮特化形成的附属结构,具有多种重要的生理功能[1]。早在100 多年前,人们就注意到初级的维管植物如石松(Lycopodium japonicum)和卷柏(Selaginella tamariscina)等,也具有根毛结构[2]。随着近年来分子生物学研究的深入,人们发现作为地球现存最古老的陆生植物——地钱(Marchantia polymorpha),其毛状假根的发育模式和高等植物根毛的发育模式类似,并且受到同一基因家族的调控[3]。这说明,根毛的发育是植物应对环境变化所采取的一种普遍选择。
植物的根毛只会在特定的根表皮细胞中发育出来,能发育出根毛的表皮细胞称为根毛细胞(root hair cells),不能发育出根毛的表皮细胞,称为非根毛细胞(non-root hair cells)[1]。然而,植物根毛发育的历程并不是固定不变的,多种植物激素和环境因素都可以影响根毛的发育历程,这体现出根毛发育的可塑性[4]。正是由于这种可塑性的存在,使得植物在面对土壤微环境不断变化的情况下能迅速做出相应的反应。例如,当土壤中营养元素缺乏时,植物根表皮会产生大量的根毛以扩大根和土壤的接触面积,从而协助植物对土壤中营养物质的吸收;而当固氮菌附着在固氮植物的根毛时,固氮植物的根毛会通过形态变化,帮助固氮菌定植于植物体内等[5]。
在植物根毛的研究中,拟南芥(Arabidopsis thaliana)根毛发育的分子机制研究最为深入,其他物种的根毛发育机制研究多是参照拟南芥根毛发育的分子框架进行类比研究的。在这篇综述中,笔者将以拟南芥根毛发育的研究成果为主,从根毛发育概述、植物激素调控根毛发育、环境因素调控根毛发育和根毛发育研究展望四部分进行梳理和总结。
1 根毛发育概述
根据根毛细胞和非根毛细胞排列模式的差异,自然界中的植物可以被分成3 类:第1 类如水稻(Oryza sativa)、番茄(Lycopersicon esculentum)等,其根毛和非根毛细胞排列方式没有特定规律可循;第2 类如二穗短柄草(Brachypodium distachyon)等,其根表皮是由纵向对称生长的一大一小2种细胞组成,其中小细胞能发育出根毛,而大细胞不能发育出根毛;第3 类如拟南芥等,其根表皮由根毛细胞列和非根毛细胞列纵向间隔排列组成。拟南芥的主根自根尖而上可分为分生区、伸长区和成熟区3个区域,由于成熟区有根毛发生因而也被称为根毛区[1]。根据拟南芥根表皮细胞和皮层细胞的相对位置,拟南芥根表皮细胞可以分成2类:和2个皮层细胞接触的表皮细胞具有发育出根毛的潜力,因而被称为根毛细胞,该细胞所处位置被称为H 位置;相对地,只和1 个皮层细胞接触的表皮细胞不会发育出根毛,因而被称为非根毛细胞,其所处的细胞位置被称为N 位置[1](见图1)。拟南芥根表皮的H 位置细胞会依次经历根毛细胞命运分化、根毛起始和根毛伸长3 个过程,最终发育出成熟的根毛[1]。
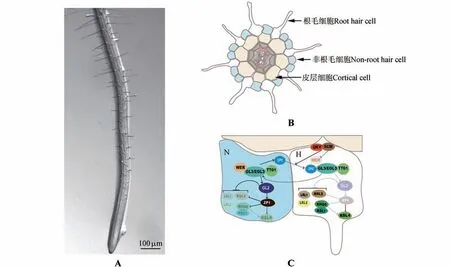
图1 拟南芥主根根毛表型及表皮细胞分化调控A.6天龄野生型拟南芥主根根毛生长表型;B.拟南芥根部横切示意图;C.拟南芥根表皮细胞分化分子调控网络示意图Fig.1 Regulation of root hair phenotype and epidermis cells differentiation in primary roots of A. thalianaA.Primary root hair growth phenotype of 6-day-old wild-type A. thaliana;B.Schematic diagram of A.thaliana root transection;C.Schematic diagram of molecular regulatory network for differentiation of A.thaliana root epidermis cells
1.1 根毛细胞的命运分化
在拟南芥H 位置细胞和N 位置细胞中存在着2种不同的转录复合体,根据其转录功能不同被分别命名为转录激活复合体和转录抑制复合体[1]。N 位置细胞中,由MYB(v-myb avian myeloblastosis viral oncogene homolog)转录因子家族R2-R3 型蛋白WER(WEREWOLF),bHLH(basic Helix-Loop-Helix)转录因子家族的GL3(GLABRA 3)和EGL3(ENHANCER OF GLABRA 3),以及WD40 重复蛋白TTG1(TRANSPARENT TESTA GLABRA 1)通过蛋白之间的相互作用,形成WER-GL3/EGL3-TTG1转录激活复合体[1]。在N 位置细胞中WER-GL3/EGL3-TTG1 转录激活复合体主要负责转录Homeodomain 家 族 转 录 因 子GL2(GLABRA 2)[6]和 小MYB 类转录因子CPC(CAPRICE)及其同源基因的表达[7]。CPC 及其同源蛋白在N 位置细胞中合成后会通过胞间连丝移动到根毛细胞中发挥功能[8-10]。在H 位置细胞中的CPC 蛋白会和转录激活复合体中的WER 蛋白竞争结合GL3/EGL3-TTG1 复合体从而形成CPC-GL3/EGL3-TTG1 转录抑制复合体[1,9]。由于CPC 蛋白缺少转录激活结构域,因而CPC-GL3/EGL3-TTG1 不能促进下游GL2和CPC等基因的转录[1,7]。此外,H 位置细胞中特异表达的GL3/EGL3,其编码产物可以移动到N 位置细胞中,参与N 细胞中转录激活复合体WER-GL3/EGL3-TTG1 的组成从而维持N 位置细胞非根毛细胞命运[11]。拟南芥根表皮细胞命运分化受到1 个编码富亮氨酸受体激酶SCM(SCRAMBLED)调控[12]。根表皮细胞发育早期,SCM 蛋白定位在所有的表皮细胞的细胞膜上,并不区分是H 细胞还是N 细胞。随着根表皮细胞发育过程的进行,SCM 蛋白在H 细胞的细胞膜上积累并且通过某种未知的方式抑制WER的转录表达,从而促进H 位置细胞进入根毛细胞命运[4,12]。近期研究发现,1 个名为QKY(QUIRKY)的膜蛋白会稳定SCM 蛋白,并且和SCM 蛋白一起调控CPC 在根表皮细胞间的正确移动,从而维持拟南芥根表皮细胞的正常分化[13]。此外,组蛋白组装和核糖体合成也被报道参与到拟南芥根毛命运分化,然而这些过程参与根毛细胞命运调控的具体分子、生化机制尚不清楚[14-15]。
拟南芥N 位置细胞中特异表达的GL2 蛋白会抑制一系列根毛发生基因的表达从而维持N 位置细胞的非根毛细胞命运[16-18]。在GL2 负调控的众多根毛发生因子中研究最为广泛的是RHD6(ROOT HAIR DEFECTIVE 6)[3]。RHD6 属于植物bHLH 类转录因子家族的VIIIc 亚家族。在这个亚家族中还存RSL1~RSL5 成员。这类家族蛋白的C端有1 段由14 个氨基酸组成的特殊结构域,称为RSL 结构域[19]。值得注意的是,在不同物种中,RHD6的同源基因都具有调控根毛或者根毛状结构发生的功能,体现出RSL家族基因功能的保守性[20]。此外,研究人员发现在番茄中也存在类似于拟南芥根毛分化的转录因子,可能会调控番茄的根表皮细胞命运分化[21]。而禾本科(Poaceae)等其他高等植物根表皮细胞分化的研究较少[20]。
1.2 根毛的起始和伸长
拟南芥根表皮细胞命运分化决定后,根毛细胞就将进入根毛形成阶段。拟南芥根毛形成阶段一般可以分为根毛起始和根毛伸长2 个阶段[1]。在拟南芥根毛起始阶段,根毛细胞靠近根尖方向处会形成直径大约22 µm的圆盘状突起[1]。随后,根毛会在该突起结构上伸长形成圆柱形的结构。该过程伴随着ROPs(RHO-RELATED PROTEIN FROM PLANTS)聚集,细胞外pH 下降和内质网聚集以及微丝蛋白积累等现象的发生[22]。该过程的分子调控机制研究相对较少,主要是细胞生物学的观察。
当根毛的起始过程完成后,根毛就进入伸长阶段。传统观点认为根毛的伸长过程属于典型的顶端生长(tip growth)过程[1]。在该过程中,RHD6下游调控的RSL4及其同源基因RSL2起到关键作用[1]。拟南芥rsl4 rsl2双重突变体在已知的所有促进拟南芥根毛生长的条件下都不能发育出根毛,因此人们普遍认为RSL4和RSL2是拟南芥根毛伸长过程中最关键因子[23]。rsl4 rsl2双重突变体中H位置的细胞依旧保留有根毛起始过程,这显示RSL4和RSL2并不参与调控拟南芥根毛起始过程而只是参与根毛伸长过程[24]。
在根毛顶端生长过程中,根毛细胞中钾离子和氯离子的浓度会增加进而增加根毛细胞中的膨压,为根毛伸长提供持续的动力[1]。在根毛伸长过程中,根毛顶端细胞壁会因为pH 的下降和活性氧的增加而软化从而膨大;pH 下降和活性氧的增加又会激活钙信号的增强,从而加固膨大的细胞壁以免细胞爆裂[1]。在根毛伸长过程中pH、活性氧和钙信号三者处于周期性变化中。此外,在根毛伸长过程中ROPs 蛋白会聚集在根毛顶端来指导根毛的伸长方向[4]。近期,有研究表明根毛的伸长过程不仅包括根毛细胞顶端生长,也包括根毛细胞的侧壁生长,但其生物学意义和机理还有待研究[25]。相对于研究较为丰富的根毛细胞分化过程,根毛伸长研究中还有很多基础性问题没有得到解决,例如根毛细胞伸长过程中钾离子和氯离子浓度是如何增加的,pH 和活性氧是如何激活钙信号的,ROPs 蛋白是如何准确定位在根毛顶端的等。除此之外,根毛如何停止生长也是一个十分有趣的问题,然而至今关于这方面的研究只是停留在细胞学观察层面,其内在机制研究十分有限[1]。
2 植物激素调控根毛发育
植物响应外界环境改变自身生长发育过程,通常会以调节植物激素信号转导过程得以实现。近年来,多种植物激素被发现在调控根毛发育过程中起到重要作用(见图2)。
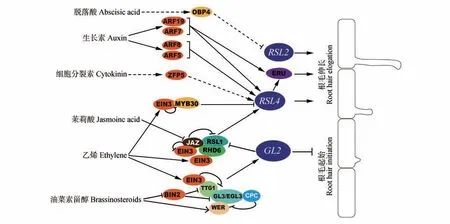
图2 多种植物激素整合调控拟南芥根毛发育的分子网络Fig.2 A molecular network integrating multiple plant hormones to regulate root hair development of A. thaliana
2.1 乙烯
乙烯是一种经典的植物激素,具有正调控根毛发育的作用[26]。在20 世纪90 年代,人们发现外源施加乙烯合成前体ACC(1-Aminocyclopropanecarboxylic Acid)会促进野生型拟南芥根毛伸长;高浓度ACC 还可以诱导拟南芥异位根毛(在N 位置表皮上发生的根毛)的发生[26]。此外,外源施加ACC 可以恢复rhd6 rsl1突变体根毛缺陷的表型,这暗示乙烯信号促进根毛伸长的作用在遗传上可能位于RHD6/RSL1下游或与之平行[1]。2017 年,Feng 等[27]研究发现乙烯信号通路核心转录因子EIN3(ETHYLENE INSENSITIVE 3)蛋白可以直接结合RSL4的启动子区域,诱导RSL4基因表达上调,促进根毛伸长。EIN3 还可以和RHD6 直接相互作用形成转录复合体加强对RSL4的转录上调作 用[27]。近 期 有 研 究 报 道,EIN3 可 以 通 过 和MYB30 的蛋白相互作用,解除MYB30 对RSL4的转录抑制作用,从而促进根毛伸长[28]。此外,乙烯促进根毛伸长需要1 个锌指蛋白ZFP5(ZINC FINGER PROTEIN 5)发挥作用,然而具体的分子机制尚不清楚[29]。
相较于乙烯促进根毛伸长分子机制的研究,乙烯促进异位根毛发生的分子机制研究相对较少。早期,研究人员鉴于乙烯处理后GL2表达的细胞特异性不变推测乙烯信号可能是平行或者位于TTG1/GL2下游调控根毛发育[30]。2021 年,Qiu等[31]发现在饱和浓度外源乙烯处理下,EIN3 可以竞争结合N 位置细胞中TTG1 蛋白,干扰WERGL3-TTG1 转录复合体对GL2的转录激活,下调其表达量,从而诱导N 位置细胞发育出根毛。此外,RSL4 也会通过和EIN3 类似的方式调控GL2的转录水平,从而参与到乙烯诱导的异位根毛发生过程中[31]。乙烯不仅会参与调控拟南芥根毛细胞命运分化,根毛起始和根毛伸长等多个环节,并且还会和其他植物激素或者环境刺激相互作用共同调控根毛发育。
2.2 生长素
同乙烯类似,生长素也是一种具有正调控根毛发育作用的植物激素[1,32]。外源施加生长素IAA(Indole-3-acetic acid)可以促进拟南芥根毛伸长[32],而生长素信号转导突变体axr1(auxin resistant 1),生长素转运突变aux1(auxin1)和pin2(pinformed 2)等都具有根毛缺陷表型[1]。这都说明生长素具有正调控根毛发育的功能。和乙烯类似,生长素可以恢复rhd6 rsl1根毛缺陷的表型,暗示生长素也可能是位于RHD6/RSL1下游调控根毛发育[1,24,32]。外源施加的生长素可以促进RSL4表达[1]。生长素信号转导通路中ARF5(AXUIN RESPONSE FACTOR 5)、ARF7、ARF8 和 ARF19 等转录因子能直接结合RSL4的启动子区域促进RSL4转录,从而促进根毛伸长[23,33]。此外,ARF7 和ARF19 能直接结合RSL4 的靶基因ERU(ERULUS)调控根毛细胞壁的组分变化,促进根毛伸长[34]。
生长素和乙烯在调控根系发育过程中具有很多交汇,比如生长素和乙烯都是通过限制根表皮细胞的伸长抑制主根生长[35],都会通过促进RSL4转录水平促进根毛伸长[23],都会影响彼此的合成和信号通路调控根系发育[36]。值得注意的是,生长素并不能像乙烯一样诱导拟南芥N 位置细胞发育出根毛,也不能恢复ein3 eil1 rhd6 rsl1突变体的无毛表型[1,27],这说明乙烯和生长素信号在调控根毛发育中具有更加复杂的调控机制。
2.3 茉莉酸
茉莉酸作为一种经典的胁迫激素,在调控植物根系发育、应对逆境胁迫等过程中发挥着十分重要的作用[37]。外源施加茉莉酸或者茉莉酸甲酯会促进拟南芥根毛的伸长、促进根毛的分叉,从而增加根毛的覆盖面积;减少内源茉莉酸含量则显著抑制根毛伸长[38]。茉莉酸信号抑制子JAZ(JASMONATE-ZIM-DOMAIN)的五重突变体jazQ的根毛显著长于野生型,而JAZ过表达植物的根毛长度要短于野生型[39]。这些都说明茉莉酸具有正调控根毛发育的功能。研究发现,茉莉酸信号通路中负调控因子JAZ 蛋白可以干扰根毛发育因子RHD6 和RSL1 的功能,抑制根毛发育。激活茉莉酸信号通路可以促进JAZ蛋白降解,解除JAZ蛋白对RHD6/RSL1 的抑制作用,促进根毛发育[39]。乙烯和茉莉酸在调控根毛发育过程中具有协同作用。JAZ蛋白可以和乙烯信号核心转录因子EIN3/EIL1 相互作用,抑制EIN3/EIL1 功能,抑制根毛伸长[40]。
2.4 细胞分裂素
细胞分裂素在植物生长发育和细胞周期调控中起到重要作用[41]。在根毛发育过程中,细胞分裂素起正调控作用。外源施加或者内源增加植物体内细胞分裂素的含量都能显著促进拟南芥根毛发育[42]。研究报道,锌指蛋白ZFP5 在细胞分裂素调控的根毛发育过程中起到重要作用。外源施加细胞分裂素不能恢复zfp5突变体短根毛的表型。并且外源施加的细胞分裂素能促进ZFP5转录水平的上调。这些都显示细胞分裂素是通过调控ZFP5调控根毛伸长的[29]。研究发现,细胞分裂素、生长素和乙烯在调控根毛发育过程中具有相互独立的作用[42],然而这3 种激素都能促进RSL4转录本的上调,促进根毛伸长,暗示他们在促进根毛伸长过程中存在共同节点[23,42]。
2.5 油菜素甾醇
油菜素甾醇信号通路是维持拟南芥根表皮细胞命运分化所必需的[43]。内源激活油菜素甾醇信号通路会导致拟南芥根表皮的H 位置细胞进入非根毛细胞命运,从而减少根毛发生;与之相对的是,阻断油菜素甾醇信号通路会导致N 位置细胞进入根毛细胞命运,从而增加根毛发生[44-45]。这说明油菜素甾醇信号具有维持N 位置细胞非根毛细胞命运的作用。研究发现,油菜素甾醇具有正调控非根毛细胞核心转录因子WER转录水平的功能[45]。2014年,Cheng等[44]发现在植物体内油菜素甾醇信号具有调控根表皮细胞命运复合体WERGL3/EGL3-TTG1 的作用。当植物体内油菜素甾醇浓度较低时,其信号核心负调控因子BIN2(BRASSINOSTEROID-INSENSITIVE 2)处于激活状态。激活状态的BIN2 会磷酸化根表皮细胞中EGL3 和TTG1 蛋 白,从 而 干 扰WER-GL3/EGL3-TTG1 对GL2的转录激活作用,诱导N 位置细胞发育出根毛;当植物体内油菜素甾醇浓度正常时,其信号核心负调控因子BIN2 处于失活状态,失活状态的BIN2 无法磷酸化EGL3 和TTG1 蛋白,根表皮细胞中WER-GL3/EGL3-TTG1 得以激活GL2的转录,从而维持正常的根表皮细胞命运分化;当植物体内油菜素甾醇浓度较高时,会促进WER 蛋白在H 位置细胞中积累,导致在H 位置细胞中具有完整且有活性的WER-GL3/EGL3-TTG1复合体,促进GL2的转录水平,诱导H位置细胞进入非根毛细胞命运[44]。
2.6 脱落酸
脱落酸在调控根毛发育过程中的作用相对复杂。一方面,脱落酸会通过促进OBP4(OBF BINDING PROTEIN4)蛋白积累抑制RSL2转录,抑制根毛伸长[46-47];另一方面,外源施加脱落酸能促进拟南芥异位根毛发生[48]。脱落酸促进根毛起始可能部分依赖于过氧化氢的作用。外源施加适量的过氧化氢可以显著诱导根毛产生[48]。而施加过氧化氢的清除剂ASA(Ascorbic acid)可以显著抑制ABA 诱导的根毛起始[49]。然而,脱落酸促进异位根毛发生的分子机制尚不清楚。
3 环境因素调控根毛发育
植物根表皮细胞的发育过程具有很强的可塑性[4]。当环境发生变化时,植物根表皮细胞会做出响应以适应外界环境变化[5]。近年来越来越多的研究聚焦于环境因素调控的植物根毛发育(见图3)。

图3 环境因素调控拟南芥根毛的可塑性发育Fig.3 Environmental factors regulate the plastic development of root hairs in A. thaliana
3.1 磷元素
磷元素是植物生长发育所必需的大量元素。在自然界的土壤中,大部分磷酸盐会与阳离子结合而沉淀,或被土壤微生物转化为有机物而难以被植物直接摄取,因而农作物会经常面临缺磷胁迫。植物在应对缺磷胁迫时,会产生一系列生理和形态方面的变化以促进磷元素的获取和利用[50]。
在缺磷环境下生长的拟南芥根毛是正常环境下的2倍,并且缺磷环境会诱导拟南芥异位根毛发生[4]。这显示缺磷胁迫正调控根毛发育。研究发现,缺磷胁迫会活化植物体内生长素信号通路,从而促进RSL2和RSL4的转录,促进根毛伸长[51-53]。相对地,环境中高浓度的磷会抑制RSL4的转录,抑制根毛伸长[53]。有趣的是,在高磷环境下施加生长素不能促进rsl2突变体根毛伸长,却能促进rsl4突变体根毛伸长,这显示RSL2和RSL4在响应生长素和外界磷浓度变化时存在差异[54]。此外,缺磷胁迫还能通过活化乙烯信号通路,促进根毛发育。Song 等[55]发现乙烯受体ERS1的功能获得性突变体表现出对低磷的超敏感特性。该突变体在低磷环境下具有较野生型更长和更多的根毛。进一步研究发现,该突变中EIN3 蛋白会在低磷环境下积累,促进RSL4等根毛发育正调控因子表达,从而促进根毛发育[55]。缺磷胁迫还会促进CPC同 源 基 因ETC1(ENHANCER OF TRY AND CPC1)的转录表达,促进根毛发育[56]。有研究人员通过单细胞转录测序手段发现,低磷会诱导根部维管组织中细胞分裂素合成,促进根毛发育[57]。目前,关于低磷促进拟南芥根毛发育的报道有很多,但植物是如何整合缺磷信号和根毛发育的分子机制探索还较少。
3.2 铁元素
铁元素是植物体内大量酶促反应必需的辅因子,是植物体所需的大量元素之一。然而天然土壤中的铁元素常以难溶的三价铁形式存在,因此植物在自然环境中经常会面临缺铁胁迫[58]。植物的根会通过质子泵AHA2(H+-ATPASE 2)向土壤中排放氢离子从而使得土壤酸化,三价铁会在FRO2(FERRIC REDUCTASE-OXIDASE 2)的作用下转变为可溶的二价铁[58]。植物在缺铁环境下,会产生具有分叉的根毛而不是异位根毛以扩大根系覆盖面积,获取更多的铁元素[59]。考虑到外源施加茉莉酸能促进根毛分叉,缺铁胁迫导致的根毛分叉很可能和茉莉酸信号有关[38]。转录组数据分析发现,缺铁还会导致乙烯和生长素信号相关基因的表达产生变化,暗示生长素信号和乙烯信号通路可能也会参与缺铁调控的根毛发育[60]。值得注意的是,在植物响应缺铁胁迫过程中,其蛋白质组会产生显著变化,暗示转录后修饰和翻译后修饰在植物响应缺铁胁迫过程中起到重要作用[61]。
3.3 氮元素
氮元素是农作物所需的大量元素,也是限制农作物产量的主要营养元素。土壤中的氮元素主要以硝酸盐和铵盐2 种形式存在[62]。其中硝酸盐既可以作为植物的氮源,也可以作为植物信号分子调控植物根系发育[63]。
根毛在植物吸收硝酸盐过程中起到非常重要的作用。拟南芥根毛缺陷突变体较野生型会积累更少的硝酸盐;与之相对的是,具有异位根毛发生的突变体会积累较野生型更多的硝酸盐[64]。外源施加硝酸盐会增加根毛密度,并且硝酸盐这种促进根毛密度增加的效果主要是通过抑制根表皮细胞长度得以实现的[65]。此外,硝酸盐会通过TGA1/TGA4(TGACG SEQUENCE-SPECIFIC BINDING PROTEIN 1/4)诱导CPC基因表达,这暗示CPC基因可能在硝酸盐诱导的根毛密度增加过程起重要作用[65]。当环境中硝酸盐含量不足时,植物会以一种NRT2.1(NITRATE TRANSPORTER 2.1)依赖的方式促进根毛伸长[66]。此外,在培养基中减少铵盐(不减少硝酸盐)可以显著促进拟南芥根毛的伸长;有趣的是,在培养基中增加铵盐会诱导拟南芥根毛发生分叉,然而其具体分子机制尚不清楚[67]。
3.4 干旱和盐胁迫
干旱和盐胁迫是植物所面临的最普遍的非生物胁迫。除了干旱直接导致的植物缺水,高盐胁迫同样会导致植物失水[68]。根毛的存在极大增加了植物根部和土壤的接触面积,一般认为根毛有助于植物吸收矿物质和水分[1]。通过增加水稻和玉米(Zea mays)等作物的根毛密度可以显著增加这些作物的耐旱性,这显示了根毛在植物应对干旱胁迫中的重要作用[69-70]。然而在培养皿中,过多或者过少的水分都会抑制根毛发育,这体现出环境水分含量对根毛影响的复杂性[67]。与干旱胁迫类似的是,盐胁迫也会抑制植物根毛的发育,并且可能和盐响应信号通路的SOS1 相关[71-72]。此外,干旱会促进拟南芥根毛产生分叉[67]。值得注意的是,与干旱和盐胁迫有紧密关系的脱落酸在调控根毛发育过程中也具有两面性[67]。未来以脱落酸信号为靶点,研究干旱和盐胁迫调控根毛发育的分子机制可能是一种可行的方案。
3.5 温度
自然界的温度变化较实验室培养条件是十分剧烈的。环境温度的降低或者升高都会显著影响植物主根的发育[73]。有研究显示,低温(10 ℃)会显 著 促 进 拟 南 芥 根 毛 伸 长。Pacheco 等[74]利 用GWAS(Genome Wide Association Study)方法鉴定到过氧化酶PRX62(PEROXIDASE 62)和PRX69(PEROXIDASE 69)在低温诱导的拟南芥根毛伸长过程中起到重要作用。低温下PRX62 和PRX69会通过调控活性氧和细胞壁扩张蛋白方式促进根毛伸长[74]。此外,研究还发现低温会促进拟南芥长链非编码RNA APOLO(AUXIN-REGULATED PROMOTER LOOP)的积累,进而介导转录因子WRKY42对RHD6的转录激活作用,从而促进根毛伸长[75]。和低温正调控植物根毛发育相对的是,高温对植物根毛发育影响的研究较少。有研究人员在筛选温敏突变体过程中发现一个FER(FERONIA)点突变体fer-ts(feronia-temperature sensitive)具有高温诱导的根毛发育缺陷表型。该突变体在高温(30 ℃)下,几乎没有根毛发生;而在22 ℃温度培养,能正常发育出根毛[76]。然而在30 ℃下生长的野生型拟南芥的根毛长度和密度与22 ℃下生长的没有显著差异[76],这说明30 ℃的温度条件并不会影响正常的根毛生长。
3.6 根际微生物
根毛为植物和土壤微生物之间的信息交流提供了重要场所[5]。土壤中存在多种类型的土壤微生物,包括促进植物生长的根际微生物PGPR(plant growth promoting rhizobacteria)、共生固氮微生物和病原微生物等。这些微生物会通过定植在植物根毛结构和植物形成共生或非共生方式和植物一同生存[19]。在这个过程中,菌会分泌多种物质调控植物根毛发育,帮助菌和植物的互作[77-78]。比如,共生根瘤菌会首先利用凝集素结合葡甘露聚糖/根黏蛋白结合到固氮植物的根毛表面[79]。共生根瘤菌附着在根毛表面后,会释放结瘤因子(nod factors),导致根毛顶端向根瘤菌附着部位生长,导致根毛卷曲包裹根瘤菌进入根毛。根瘤菌会通过根毛顶端的质膜内陷形成的侵染线进入植物体内[80]。此外,一些PGPR和病原微生物会通过乙烯或者生长素信号依赖的方式增加根毛长度和密度[5]。还有一些研究发现,细菌群体感应信号AHLs(N-acyl-l-homoserine lactones,N-酰基-l-高丝氨酸内酯)可以生长素信号不依赖的方式促进拟南芥根毛发育[81]。这说明不同根际微生物会通过不同方式影响植物根毛发育从而帮助自身生存和繁衍。
4 根毛发育研究展望
根毛作为植物与环境接触的最外层结构,在植物生长发育和应对各种胁迫过程中起到重要作用。随着现代分子生物学的发展,人们对植物根毛的发育过程有了更加全面的认识。基于这一认识,研究者们建立了一个完整的根毛发育调控网络,并将其与其他植物激素信号和环境刺激信号整合在一起。
然而纵观根毛发育研究的历程,还是有很多不足之处。在根毛发育调控网络的搭建过程中,人们多是依赖于遗传学和分子生物学的研究手段[1],缺乏对于根毛发育调控网络中重要组分生化性质和功能的探究。此外,如今的根毛发育调控网络主要是基于转录调控的关系搭建而成,缺乏其他层面调控的研究。近年来,陆续有研究报道表观遗传、翻译和翻译后修饰调控可能参与到根毛发育过程中,但是这些调控过程在整体的根毛发育调控网络中的重要性还有待挖掘和检验[14-15,44]。在植物激素调控根毛发育的研究中,人们多是从整体上改变植物激素信号转导过程来研究植物激素对于根毛发育的影响[67],缺乏从组织层面或是细胞层面上研究植物激素对根毛发育的影响。通过现有的丰富的分子生物学工具,实现组织层面和细胞层面的激素信号转导的操纵已不是难事。未来基于分子生物学工具研究微观尺度下原位激素信号调控根毛发育是一个值得尝试的方向。在环境因素影响根毛发育研究中,分子机制研究相对较浅,缺乏诸如将植物感受环境刺激信号和根毛发育调控网络整合在一起的研究[61]。随着近年来单细胞测序技术发展,更加系统、精准地探究环境刺激对根毛发育历程的改变,可能为挖掘环境因素对根毛发育影响的分子机制提供契机。
根毛作为植物普遍具有的结构,其发育分子机制在不同植物之间具有保守性。例如,水稻、杨树(Populus)和卷柏等物种中的RSL4的同源基因可以恢复拟南芥rsl4突变体根毛缺陷表型[82];地钱和小立碗藓(Physcomitrium subeurystomum)中RSL同源基因可以促进这2种植物毛状假根(类似于根毛的结构)的形成[3]。这些都说明以拟南芥根毛研究为基础指导其他物种根毛研究是可行的。然而值得注意的是,在不同物种间,根毛发育过程也存在差异。比如,在水稻中生长素输入性蛋白OsAUX1 主要在根毛细胞中积累,而拟南芥中的AtAUX1 主要在非根毛细胞中积累[83]。这也提示了,不能将拟南芥中根毛研究成果简单推广到其他物种。
