枯草芽孢杆菌普鲁兰酶基因的分泌表达及其在粉丝制作中的应用
2022-03-07祝冬君张锦雯单逸蓝杨梦莲杨海泉夏媛媛陈献忠
祝冬君,张锦雯,姚 雁,单逸蓝,杨梦莲,沈 微*,3,杨海泉,夏媛媛,陈 磊,陈献忠
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.无锡先秦生物科技有限公司,江苏 无锡 214073;3.江南大学 中国高校工业微生物资源数据平台,江苏 无锡 214122)
普鲁兰酶是一类淀粉脱支酶,主要用于淀粉制糖工业中,与其他淀粉水解酶协同作用以提高淀粉水解效率,减少极限糊精残留,提高葡萄糖得率和产品质量[1-2]。近年来,相关研究者还开发了以普鲁兰酶为催化剂的新工艺和新产品,例如以淀粉为原料的直链淀粉、抗性淀粉生产工艺[3-4]。本课题组在前期工作中建立了一种酶法粉丝制作工艺,在粉丝制作的制芡糊阶段用普鲁兰酶处理芡糊,通过催化淀粉脱支反应,提高芡糊中直链淀粉的含量,从而使制作出的粉丝与明矾粉丝质量一致[5]。进一步研究发现,在酶法粉丝制作中,与耐酸性普鲁兰酶相比,中性普鲁兰酶具有更高的催化效率,所制作的粉丝成品的质量也明显优于以酸性普鲁兰酶为催化剂获得的粉丝[6-7]。由于普鲁兰酶主要是在淀粉制糖工业的糖化阶段与糖化酶联合使用,因此市售普鲁兰酶均为酸性普鲁兰酶,尚缺乏针对粉丝制作工艺开发的中性普鲁兰酶产品,且目前普鲁兰酶的市场价格较高,因此开发高活性、食品安全的中性普鲁兰酶对酶法粉丝工艺的应用具有关键性的意义。芽孢杆菌及其近缘微生物是中性普鲁兰酶的重要来源[8-12],其中,芽孢杆菌属、厌氧芽孢杆菌属、地芽孢杆菌属的一些种的普鲁兰酶基因已经被克隆表达[11-14]。这些普鲁兰酶在耐热性等方面差异显著,但其最适pH均在中性或接近中性,只有厌氧芽孢杆菌某些种的普鲁兰酶最适pH可以达到5.5左右,但在pH为6.5时仍具有较高的活性。可见,芽孢杆菌及其近缘微生物是筛选粉丝制作专用普鲁兰酶的理想宿主菌。枯草芽孢杆菌是公认食品安全的微生物,是淀粉酶、蛋白酶等多种食品级酶制剂的生产菌。如果能够以枯草芽孢杆菌为宿主菌,高效表达其自身的普鲁兰酶,这将有利于解决中性普鲁兰酶的来源及食品安全问题。Malle等[12]从枯草芽孢杆菌中克隆并在大肠杆菌中异源表达了一种I型普鲁兰酶,当时的研究发现这是一种胞内普鲁兰酶。本研究发现,枯草芽孢杆菌普鲁兰酶在适当的条件下可以少量分泌到大肠杆菌细胞外,在枯草芽孢杆菌中可以实现高效分泌表达,实际上是一种胞外酶,而且这种酶的分泌表达产物的酶学性质与胞内产物存在显著差异。作者研究了枯草芽孢杆菌普鲁兰酶基因的表达、重组酶性质及其在粉丝制作中的应用。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒枯草芽孢杆菌(Bacillus subtilis)模式株168、淀粉酶基因缺陷株1A717[6]:均为中国高校工业微生物资源信息平台提供,保藏号分别为CICIM B0030和CICIM B0021;大肠杆菌(Escherichia coli)表达载体pLac03、pUP43:均为作者所在课题组前期构建[6,13],含有上述质粒的大肠杆菌转化子的保藏号分别为CICIM B6937和CICIM B6941;表达耐热型中性普鲁兰酶GsP的重组大肠杆菌JM109/pLac03-GsP[13]、重组枯草芽孢杆菌1A717/pUP43-GsP[6]:均为作者所在课题组前期构建,菌株保藏号分别为CICIM B6922和CICIM B6924。
1.1.2 工具酶及主要试剂限制性核酸内切酶Mlu I、Kpn I、Spe I、Sal I、蛋白质电泳标准相对分子质量(Prestained Protein Ladder):赛默飞世尔科技有限公司产品;连接酶、DNA聚合酶Ex Taq、核酸电泳标准相对分子质量DL10000:宝生物工程(大连)有限公司产品;普鲁兰糖:MegaZyme公司产品,购自上海意果科技有限公司;其他试剂:均购自国药集团。
1.1.3 引物在NCBI公布的枯草芽孢杆菌模式株168菌株的基因组序列(美国国家生物技术信息中心登录号:NC_000964.3)中有一段标注为amyX的基因,根据Malle等[12]研究其产物为普鲁兰酶,作者将其命名为BsP基因,根据其序列设计引物如下:

引物Plb1、Plb2、Pbs1、Pbs2中带下划线部分分别为内切酶Mlu I、Kpn I、Spe I、Sal I识别位点,带双下划线部分为核糖体结合位点。引物Plb1、Pbs1与普鲁兰酶基因编码区5′端一致,引物Plb2、Pbs2与普鲁兰酶基因编码区3′端互补。下游引物中带波浪线部分为6个组氨酸编码序列,用于重组酶的纯化。
1.1.4 培养基大肠杆菌和枯草芽孢杆菌培养种子液均采用LB培养基,摇瓶发酵培养均采用TB培养基,均按常规方法配制。
1.2 实验方法
1.2.1 普鲁兰酶重组表达载体的构建提取B.subtilis 168菌株的基因组,以基因组为模板,以Plb1、Plb2为引物进行PCR扩增,用Mlu I和Kpn I酶切目的基因片段和表达载体pLac03,连接之后转化E.coli JM109,涂布在含有氨苄青霉素的LB平板上,挑取转化子进行液体培养,提取转化子质粒进行酶切验证和测序。
以B.subtilis 168的基因组为模板,以Pbs1、Pbs2为引物进行PCR扩增,用Spe I和Sal I酶切目的基因片段和表达载体pUP43,连接后转化E.coli JM109,涂布在含有氨苄青霉素的LB平板上,挑取转化子进行液体培养,提取转化子质粒进行酶切验证和测序。
1.2.2 普鲁兰酶重组枯草芽孢杆菌的构建将表达载体pUP43-BsP转化到B.subtilis 1A717中,转化方法见文献[15],涂布在含卡那霉素的LB平板上,挑取转化子提取质粒,酶切验证。其中枯草芽孢杆菌质粒提取方法见文献[16]。
1.2.3 重组普鲁兰酶的表达及产物的分析重组菌株E.coli JM109/pLac03-BsP和对照菌株E.coli JM109/pLac03的种子液及摇瓶发酵的培养方法同文献[13],发酵结束后,收集发酵液提取胞外、周质和胞质粗酶液,进行酶活检测。基本操作过程如下:取适量发酵液,4 000 r/min离心10 min,收集离心后的上清液作为胞外粗酶液。将离心后的菌体重悬于含有20 g/dL蔗糖的磷酸氢二钠和柠檬酸缓冲液中,冰浴2 h后离心去上清液,再将菌体重悬于与发酵液等体积的磷酸氢二钠和柠檬酸缓冲液的低渗透压的溶液中,由于渗透压的急剧变化,周质中的蛋白质被释放到环境中,4 000 r/min离心10 min,上清液即为周质粗酶液。沉淀部分再次重悬于磷酸氢二钠和柠檬酸缓冲液中,超声波破碎细胞,离心取上清液为胞质粗酶液。酶活检测、SDS-PAGE凝胶电泳分析重组酶的分布情况,普鲁兰酶酶活测定方法同文献[12]。其中,酶与底物的反应温度一般为45℃。酶活定义为:在相应条件下,每分钟分解普鲁兰糖所释放的还原糖,其还原力相当于1μmol葡萄糖所需的酶量,用1 U表示。
重组菌B.subtilis 1A717/pUP43-BsP及对照菌B.subtilis 1A717/pUP43的种子液及摇瓶发酵的培养方法同文献[6],发酵结束后,收集发酵液提取胞外和胞质粗酶液,并进行酶活检测和SDS-PAGE凝胶电泳分析。胞外和胞质粗酶液的提取方法同上。
1.2.4 重组普鲁兰酶的纯化重组酶的C端带有His-tag标签,所以采用镍柱进行亲和层析纯化,具体纯化方法如下:取胞外粗酶液5 mL,经0.22μm滤膜过滤,用含有0.5 mol/L NaCl和0.02 mol/L咪唑的磷酸氢二钠和磷酸二氢钠缓冲液(浓度为0.02 mol/L,pH 7.4)作为上样缓冲液,用含0.5 mol/L咪唑和0.5 mol/L NaCl的磷酸氢二钠和磷酸二氢钠缓冲液作为洗脱液,梯度洗脱,流量为1 mL/min。SDSPAGE蛋白质电泳分析纯化结果,测定蛋白质含量,计算比酶活。纯化柱为His-Trap HP 1 mL亲和层析柱,GE公司产品,购自国药集团。
1.2.5 重组普鲁兰酶酶学性质的测定重组酶最适温度的测定:分别在30、35、40、45、50、55、60、65℃下测定酶活的大小,以最高酶活为100%,计算相对酶活。重组酶最适pH的测定:在pH为4.0~8.0的磷酸氢二钠-柠檬酸缓冲液中,测定酶活力,以最高酶活为100%,计算相对酶活。重组酶热稳定性的测定:将酶液置于40、45、50、55℃金属浴中处理3 h,分别测定处理0.5、1.0、1.5、2.0、2.5、3.0 h后的酶活,以未处理的酶活为100%,计算相对酶活。金属离子对重组酶酶活的影响测定:以10 mmol/L的不同金属离子溶液替换酶活力测定反应体系中的缓冲液,用盐酸或氢氧化钠调节金属离子缓冲液pH为6.0,以去离子水代替金属离子溶液作为对照,以对照酶活为100%,计算相对酶活。每个数据均做3个平行样。
1.2.6 重组普鲁兰酶动力学参数的测定配制质量浓度分别为1、2、3、4、5、6、7、8 mg/mL的普鲁兰多糖,取不同浓度的底物在最适温度及pH条件下与普鲁兰酶BsP反应,以蒸馏水代替酶液作为空白对照,DNS法测定生成的还原糖含量,计算不同底物质量浓度[S](mg/mL)时的酶促反应初速度V(μmol/(mL·min)),作V-[S]曲线图,用L-B双倒数作图法计算出酶的Km值和Vmax。
1.2.7 重组普鲁兰酶水解普鲁兰多糖的产物分析麦芽三糖、麦芽糖和葡萄糖的标准品质量浓度10 g/L,取过量重组普鲁兰酶与普鲁兰糖在最适条件下反应,对照为灭活酶液与普鲁兰糖反应,对标准样和酶反应产物样品进行HPLC检测。色谱条件:Bio-Rad HPLC Organic Acid Analysis Column Aminex HPX-87H Ion Exclusion Column 300 mm×7.8 mm,以5 mmol/L H2SO4为流动相,流速设置为0.5 mL/min,柱温设置为55℃。
1.2.8 重组酶在粉丝制作中的应用按传统方法制作粉丝,在文献[7]的基础上根据枯草芽孢杆菌表达的重组普鲁兰酶的性质稍做改变,主要涉及第一步制芡糊,具体如下:取淀粉或红薯粉100 g,用100 mL温水悬浮,一次性加入700 mL沸水,并剧烈搅拌成芡糊,冷却至45℃时加入普鲁兰酶搅拌混匀,在45℃水浴锅中保温30 min。后续步骤包括和面、制丝、煮丝、理丝、晾干均与文献[7]相同。明矾粉丝制作方法同文献[7],以普鲁兰酶GsP和PUL3665为催化剂的粉丝制作方法分别与文献[6]和文献[7]一致。粉丝断条率、膨润度和煮沸损失率的计算方法均同文献[7],检测时均做2组平行实验。
2 结果与分析
2.1 重组菌的构建
以枯草芽孢杆菌168的染色体DNA为模板,以Plb1和Plb2为引物进行PCR扩增,获得2.2 kb的扩增产物,产物大小与根据枯草芽孢杆菌普鲁兰酶基因BsP大小一致。用核酸内切酶Mlu I和Kpn I酶切目的片段和表达载体pLac03,连接后转化E.coli JM109,任取4个转化子提取质粒,酶切验证。结果表明,这4个转化子所含质粒用Mlu I和Kpn I酶切后获得2.6 kb和2.2 kb的两个片段,分别与pLac03空质粒和扩增片段一致。图1(a)是其中1#转化子质粒酶切电泳图,酶切图谱符合重组质粒应有的特点(图1(b))。进一步测序显示,4个重组质粒中插入片段的序列完全相同,与枯草芽孢杆菌BsP基因编码区完全一致,编码区的3′端增加了由引物带入的6个组氨酸密码子,用于表达产物的亲和层析纯化,包括6个组氨酸密码子的编码区全长2 175 bp,编码的多肽链理论相对分子质量为81 800。重组菌诱导表达后进行细胞破碎,破碎液检测到明显的普鲁兰酶活性,而含空质粒的对照菌则细胞内外均未检测到酶活。这个结果与Malle等[12]对amyX基因的研究结果一致,说明克隆的基因编码的蛋白质是一种普鲁兰酶,将上述1#转化子命名为E.coli JM109/pLac03-BsP,简写为JM109/pLac03-BsP,用于后续实验。
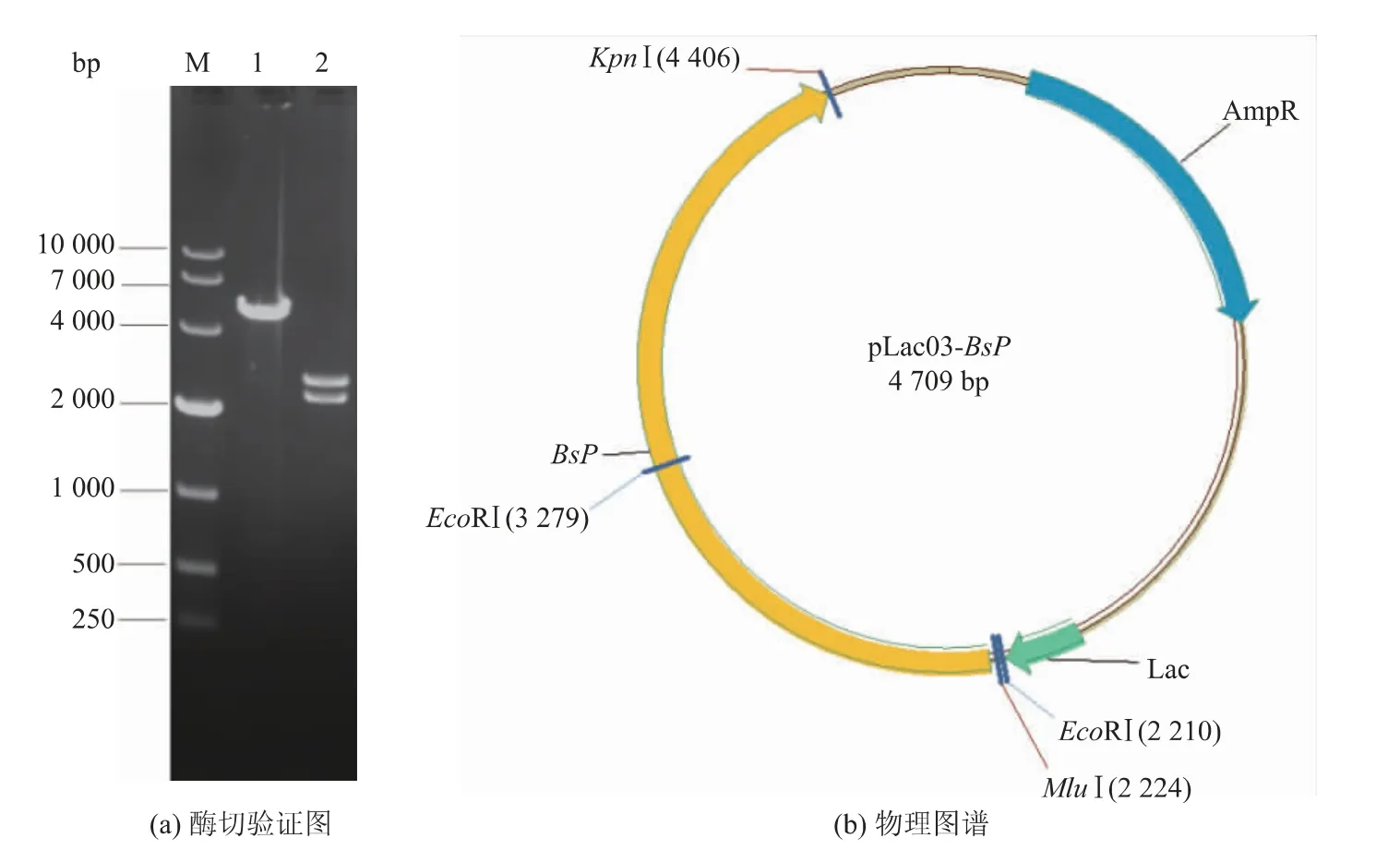
图1 重组质粒pLac03-BsP酶切验证图和物理图谱Fig.1 Restriction analysis and map of the recombinant plasmid pLac03-BsP
2.2 重组普鲁兰酶的分泌表达及纯化
在本课题组的前期工作中曾对嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus)的普鲁兰酶基因GsP和地表地芽孢杆菌(G.subterraneus)的普鲁兰酶基因pul3665进行研究,结果显示这两种基因在大肠杆菌中的表达产物均有相当大的部分可以分泌到周质空间和细胞外[7,13]。序列比对显示,BsP基因编码的蛋白质BsP与地芽孢杆菌来源的两种耐热型普鲁兰酶GsP和PUL3665的氨基酸序列的同源性大概为50%。为了研究BsP在大肠杆菌中分泌表达的可能性,将重组菌分别在LB培养基和TB培养基中进行培养和诱导表达。结果显示,重组菌JM109/pLac03-BsP在LB中诱导表达后细胞外培养液中检测不到明显的酶活,细胞破碎液则有较高的普鲁兰酶酶活,折合到等体积发酵液其酶活大约为46 U/mL。重组菌JM109/pLac03-BsP在TB培养基中诱导表达后细胞外培养液中的普鲁兰酶酶活大约为0.6 U/mL,虽然活力不高但很明显,而含空质粒的对照菌在同样条件下则完全检测不到酶活。肖亚朋等[13]研究发现,表达GsP基因的重组大肠杆菌只有在TB培养基中诱导表达时普鲁兰酶才能分泌到细胞外,而在LB培养基中诱导表达时培养液中检测不到酶活。本研究结果与其一致,但GsP分泌表达量相比本研究的BsP明显更高,前者培养液酶活达到2.3 U/mL。
为研究基因BsP表达产物在大肠杆菌中的分泌情况,将重组大肠杆菌JM109/pLac03-BsP和JM109/pLac03-GsP诱导表达后分离细胞各组分分析重组酶及重组蛋白质的情况,结果见图2~3。
图2的1~3泳道为重组菌胞质内蛋白质的电泳结果,对比这3个泳道可知,相对于含空质粒的对照菌,重组菌JM109/pLac03-BsP和JM109/pLac03-GsP的胞内蛋白质在相对分子质量80 000左右均有一个明显的表达条带,分别与BsP基因和GsP基因对应蛋白质的理论相对分子质量81 800和81 300一致。从表达条带的浓度看,BsP基因的表达量明显比GsP更高,酶活检测结果显示,JM109/pLac03-BsP胞质组分的酶活为44.7 U/mL,而JM109/pLac03-GsP胞质组分的酶活为29.6 U/mL,这个结果与蛋白质条带的差异能大致对应,从这个结果看BsP、GsP两条基因的表达产物的比酶活应该比较接近。
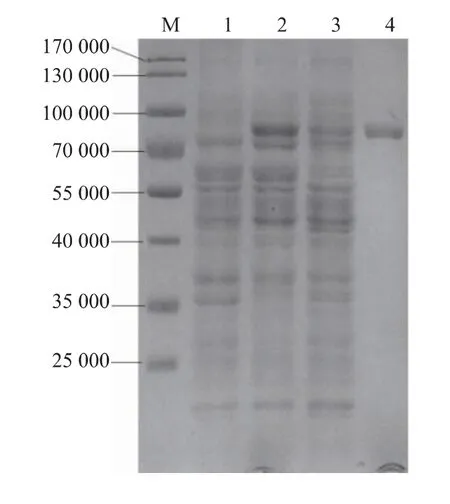
图2 重组菌株胞质蛋白质SDS-PAGE分析Fig.2 SDS-PAGE analysis of cytoplasmic protein of the recombinants
图3的1~3泳道是重组菌周质蛋白质的电泳结果,对比3个电泳道可见,与对照菌相比,重组菌JM109/pLac03-BsP和JM109/pLac03-GsP的周质蛋白质在80 000附近也存在明显的差异表达条带,与各自的重组普鲁兰酶相对分子质量一致。从差异表达条带的浓度看,GsP的条带很浓,而BsP只有很微弱的差异条带,用软件Image Lab 4.0对两个条带进行分析显示,条带所代表的GsP的浓度是BsP的12倍。进一步进行酶活检测,结果显示JM109/pLac03-GsP的周质酶活为14.6 U/mL,而JM109/pLac03-BsP的周质酶活为4.6 U/mL。显然,两者酶活的差异显著小于蛋白质浓度的差异,初步推算可以发现,周质中BsP的比酶活大约是GsP的4倍,这和胞质内重组酶比酶活的计算结果形成明显的矛盾。由于周质中BsP的含量过低,未能获得其纯酶,同时考虑到大肠杆菌周质蛋白质的分离并不准确,容易被胞质内组分污染,因此在大肠杆菌中只采用胞质内蛋白质进行重组BsP的分离纯化。图2泳道4是纯酶的电泳结果,可见采用镍柱亲和层析得到的产物显示为单一条带,结合蛋白质质量浓度检测进行计算,大肠杆菌胞质内BsP纯酶比活力为27.7 U/mg,这与Malle等[12]获得的BsP纯酶比酶活24.1 U/mg比较接近。
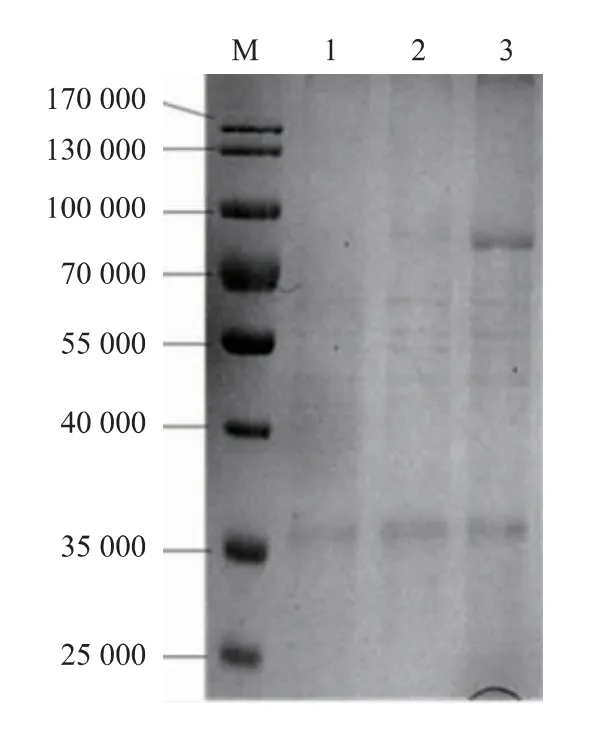
图3 重组菌株周质蛋白质SDS-PAGE分析Fig.3 SDS-PAGE analysis ofperiplasmic protein of the recombinants
2.3 重组枯草芽孢杆菌的构建
以B.subtilis 168的基因组为模板,以Pbs1和Pbs2为引物进行PCR扩增得到目的基因,将目的基因和载体pUP43用Spe I和Sal I酶切连接,并转化大肠杆菌,挑取转化子提取质粒酶切验证。图4(a)中泳道1是其中1#转化子所含质粒的酶切电泳图,用Spe I和Sal I酶切后电泳显示大小为2.2 kb和6.7 kb的两条带,与BsP基因和表达载体pUP43的大小一致(图4(b))。进一步测序显示,重组质粒中的插入片段与amyX基因编码区一致,编码区的3′端增加了由引物带入的6个组氨酸密码子。
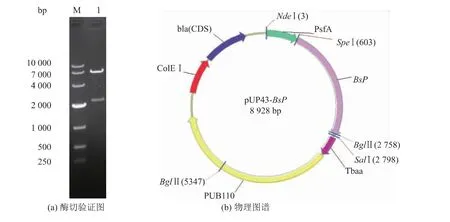
图4 重组质粒pUP43-BsP酶切验证图和物理图谱Fig.4 Restriction analysis and map of the recombinant plasmid pUP43-BsP
将重组质粒pUP43-BsP转化到B.subtilis 1A717中,提取转化子质粒进行酶切验证,结果显示所提取质粒的酶切图谱与图4(a)一致,表明该菌株是转入了重组质粒pUP43-BsP的重组菌,将该重组菌命名为B.subtilis 1A717/pUP43-BsP,简称1A717/pUP43-BsP,用于后续实验。
2.4 BsP基因在枯草芽孢杆菌中的表达
按上述方法进行重组枯草芽孢杆菌重组酶的发酵。重组枯草芽孢杆菌1A717/pUP43-BsP和1A717/pUP43-GsP发酵至36 h,发酵上清液酶活分别达到71 U/mL,和34 U/mL。图5是重组菌发酵上清液的SDS-PAGE电泳图。对比图5的1~3泳道可知,相对于对照菌株,1A717/pUP43-BsP和1A717/pUP43-GsP的发酵液上清液在81 000附近有明显表达条带,与目的蛋白质理论相对分子质量一致。由图5泳道2、3可见,GsP基因的表达量明显高于BsP基因,但酶活检测显示,发酵液中GsP的酶活不到BsP的一半,显然BsP的比酶活远高于GsP,这与大肠杆菌周质酶活检测及蛋白质电泳分析结果一致。对1A717/pUP43-BsP发酵上清液进行纯化,图5泳道4为纯化后的酶液,显示为单一条带。测定其蛋白质浓度,经过计算得出该蛋白质的比酶活为153.7 U/mg,这个比活力是同一基因在大肠杆菌胞质内表达产物的5.5倍。结合大肠杆菌中BsP胞质内产物和周质产物的差异可见,BsP的周质分泌表达产物的比活力远高于胞质内非分泌产物的比活力。鉴于BsP基因在枯草芽孢杆菌中分泌表达产物和在大肠杆菌胞质内产物的比活力显著差异,在后续工作中前者命名为BsBsP,后者为EcBsP。
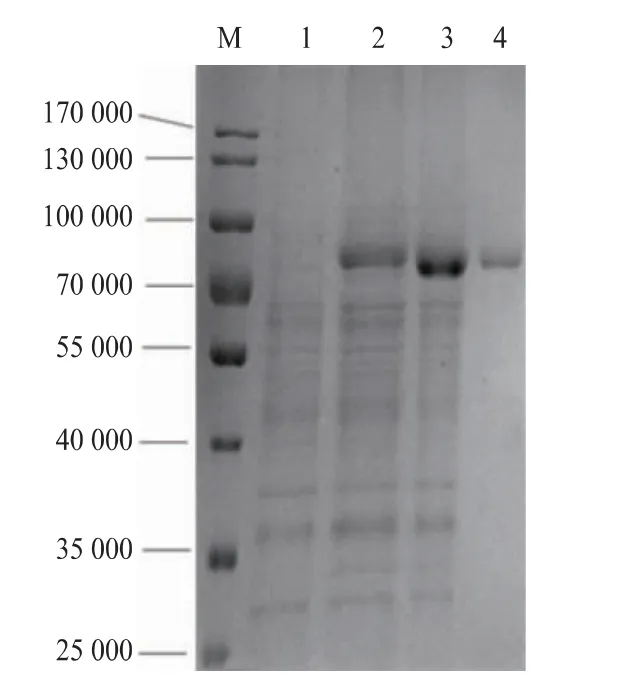
图5 重组菌株胞外蛋白质SDS-PAGE分析Fig.5 SDS-PAGE analysis of extracellular protein of the recombinants
BsBsP和EcBsP是同一个基因的表达产物,两种蛋白质的酶学性质发生大的差异一般可能有两个原因,一是蛋白质折叠方式不同,二是蛋白质的后加工。对于后一种情况,由于枯草芽孢杆菌不是真核生物,不存在糖基化等后修饰现象,最有可能发生的是蛋白质的部分切除。由于两种蛋白质的纯酶都是利用其羧基端的组氨酸残基通过亲和层析分离的,因此羧基端一定是完整的。为验证两种蛋白质氨基端是否有差异,将纯化得到的BsBsP和EcBsP送上海生工生物技术公司进行氨基端测序。测序结果表明,BsBsP和EcBsP氨基端的6个氨基酸一样,都是Met-Val-Ser-Ile-Arg-Arg,与BsP基因编码区的5′端翻译产物完全一致,可见2种蛋白质的N端均未发生部分切除,因此2种蛋白质的氨基酸序列应该完全相同,EcBsP比酶活低的原因很可能源于形成立体结构过程中发生的错误折叠。
2.5 重组普鲁兰酶的酶学性质
2.5.1 重组普鲁兰酶的最适温度和最适pH在pH 6.0的缓冲液中,30~65℃温度范围内测定BsBsP的相对酶活,结果见图6。BsBsP在40~50℃时酶活较高,45℃为最适温度,温度超过50℃时酶活迅速下降。EcBsP的最适pH、最适温度和温度稳定性检测结果与BsBsP几乎完全相同,以下不再赘述。
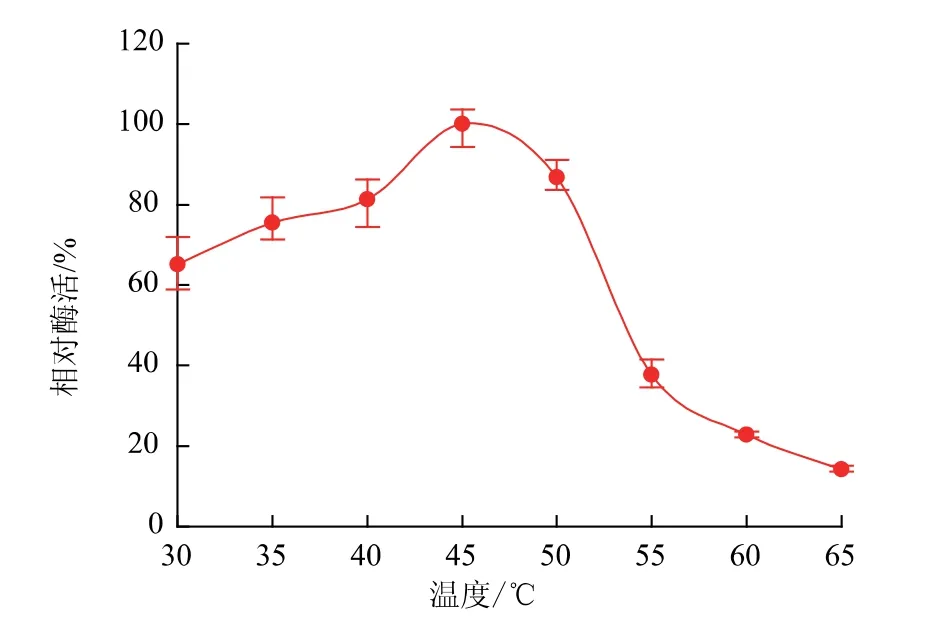
图6 温度对重组普鲁兰酶BsBsP酶活力的影响Fig.6 Effects of temperature on the activity of the recombinant pullulanase BsBsP
在45℃下,测定不同pH值的Na2HPO4-柠檬酸缓冲液对酶活力的影响,结果见图7。重组普鲁兰酶BsBsP对pH变化较敏感,pH为5.5~6.5时,酶活均在最高酶活的90%以上,6.0为最适pH值。pH 5时相对酶活为47%,pH超过6.5时酶活力下降明显。
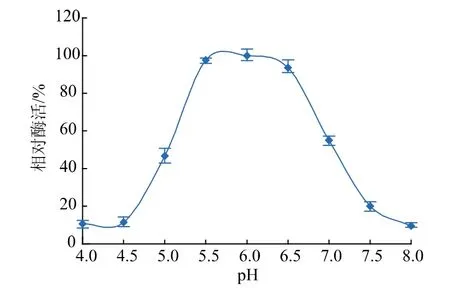
图7 pH对重组普鲁兰酶BsBsP酶活力的影响Fig.7 Effects of pH on the activity of the recombinant pullulanase BsBsP
2.5.2 重组普鲁兰酶的热稳定性将酶液置于40、45、50、55℃金属浴中处理3 h,每间隔0.5 h测定相对酶活,结果见图8。40℃保温处理3 h,相对酶活在80%以上;45℃保温处理3 h,相对酶活在60%以上;温度超过45℃,酶活下降迅速;50℃保温处理3 h,相对酶活仅为19%;在55℃下BsBsP迅速失活。
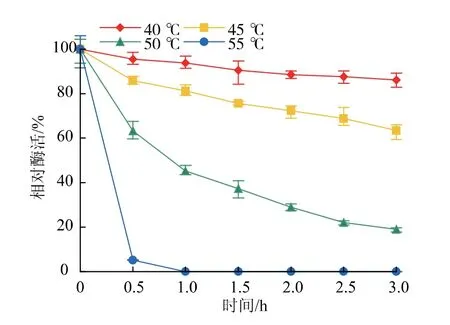
图8 重组普鲁兰酶BsBsP的热稳定性Fig.8 Thermo-stability of the recombinant pullulanase BsBsP
2.5.3 不同金属离子及溶液对重组普鲁兰酶酶活力的影响在45℃、pH 6.0条件下,测定几种常见金属离子及溶液对普鲁兰酶BsBsP和EcBsP的催化活力的影响,结果见表1。Mn2+、Co2+对两种酶的活性均有激活作用;Na+、K+、Fe2+、Cu2+对两种酶的活性有一定的抑制作用;Zn2+对重组酶均有强烈抑制作用,在实验条件下两种重组酶的酶活几乎完全丧失。Na+对BsP活性的作用是一个需要重视的问题,因为粉丝制作的芡糊中需要添加1 g/dL的氯化钠。进一步实验显示,增加Na+对BsP的影响不明显,另外酶活检测是在磷酸氢二钠和柠檬酸缓冲液中进行,由于溶液本身含有钠离子,因此虽然钠离子对酶活有影响,但对其在粉丝中应用的影响可能并不大。从表1可知,金属离子及化合物对BsBsP和EcBsP的影响基本一致,只有SDS的影响相差很大,SDS导致BsBsP酶活几乎减少一半,而对EcBsP几乎没有影响。
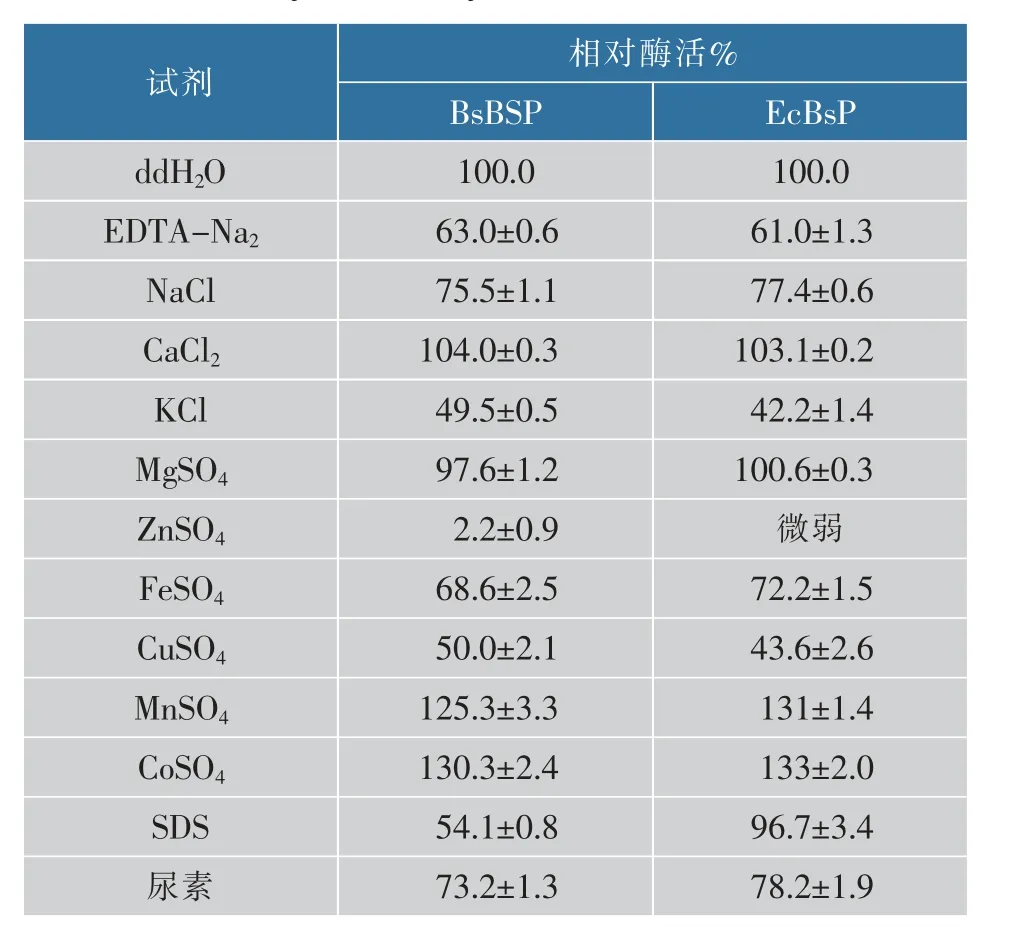
表1 不同金属离子及试剂对BsP酶活力的影响Table 1 Effects of different metal ions and reagents on the enzyme activity of BsP
2.5.4 重组普鲁兰酶的动力学参数按照1.2.6的方法测定BsBsP的酶促反应动力学参数,做出重组酶BsBsP催化普鲁兰多糖的V-[S]曲线图,见图9。根据L-B双倒数曲线图(图10),得到线性方程y=2.863 6x+1.301,由此可得重组酶BsBsP的Km=2.201 mg/mL,Vmax=0.769μmol/(mL·min)。
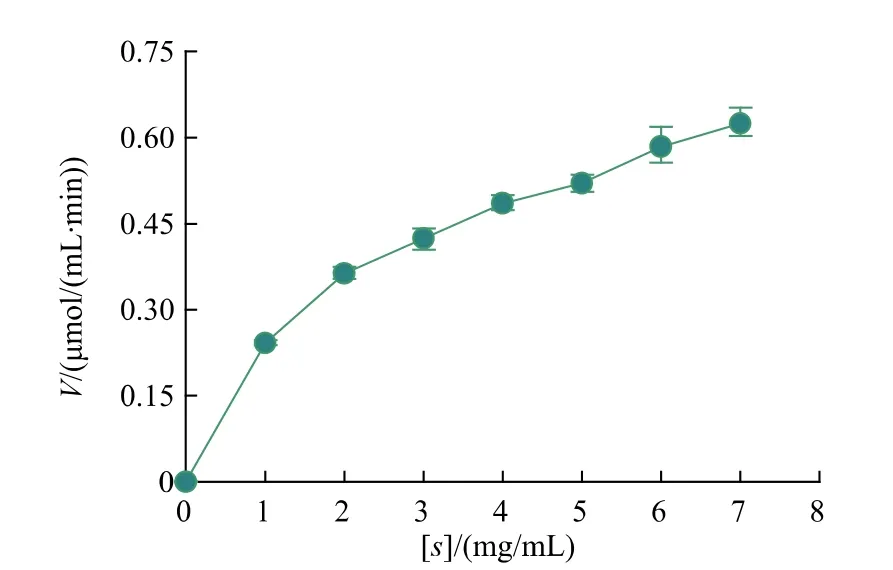
图9 BsBsP作用于普鲁兰多糖的V-[S]动力学曲线Fig.9 V-[S]kinetic curve of BsBsP acting onpullulan
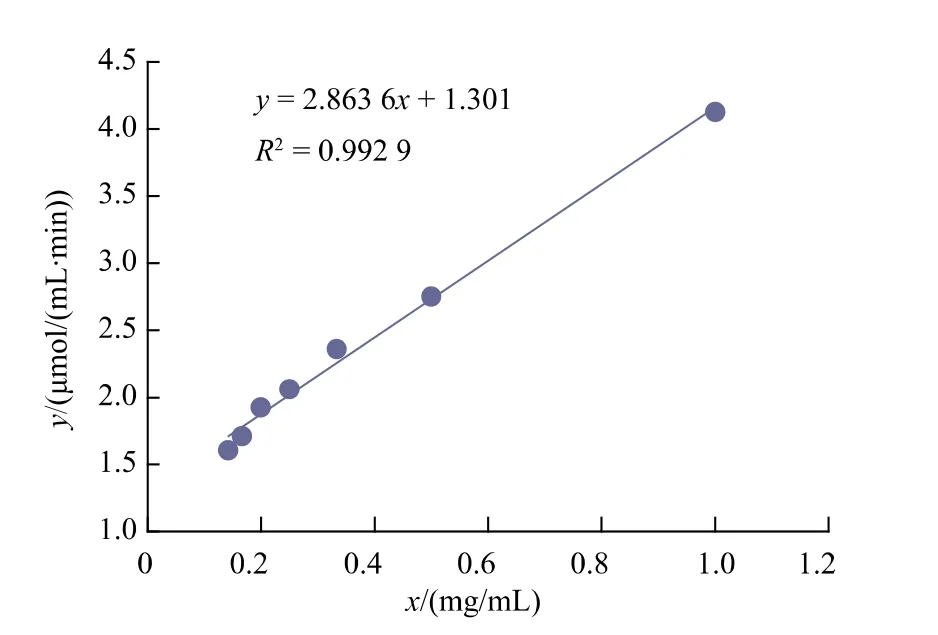
图10 Linewaver-Burk双倒数曲线图Fig.10 Linewaver-Burk double reciprocal curve
2.6 重组普鲁兰酶对普鲁兰多糖的降解
取过量BsBsP与普鲁兰多糖在45℃反应2 h,对降解产物进行HPLC检测,结果见图11。BsBsP降解底物普鲁兰多糖生成单一产物麦芽三糖,没有检测到麦芽糖、葡萄糖以及潘糖,表明BsBsP只作用于普鲁兰多糖的α-1,6-糖苷键,对α-1,4-糖苷键不起作用。将BsBsP与质量浓度为0.5 g/dL的直链淀粉溶液在45℃反应24 h,结果显示BsBsP对直链淀粉溶液蓝值没有影响,进一步表明BsBsP不降解α-1,4-糖苷键,由此可见BsBsP是一种专一性降解α-1,6-糖苷键的I型普鲁兰酶。在粉丝制作中,采用I型普鲁兰酶处理芡糊可以获得质量较高的成品粉丝,而II型普鲁兰酶由于具有水解α-1,4-糖苷键的活性,导致淀粉链变短,由此获得的粉丝断条率较高[17]。BsBsP完全不水解α-1,4-糖苷键,比较适合在粉丝制作中使用。
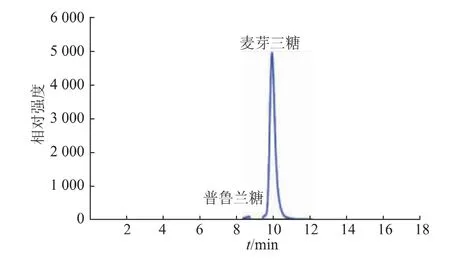
图11 BsBsP催化普鲁兰多糖降解的产物分析Fig.11 Analysis of BsBsP-catalyzed degradation products of pullulan
2.7 重组普鲁兰酶BsBsP在粉丝制作中的应用效果
将重组枯草芽孢杆菌1A717/pUP43-BsP发酵获得的普鲁兰酶发酵液用超滤机进行超滤浓缩,获得最终酶活681 U/mL的浓缩酶液,将BsBsP浓缩酶液用于马铃薯淀粉粉丝的制作,结果见表2。

表2 添加BsBsP对马铃薯淀粉粉丝质量的影响Table 2 Effects of BsBsP addition on the quality of potato starch vermicelli
表2结果表明,按照传统粉丝的制作工艺,如果不添加明矾,制作出的粉丝在煮丝阶段互相粘连严重,质量不合格。如果用适量BsBsP处理芡糊可以解决煮丝阶段的并条问题,也可以制作出质量合格的粉丝。按照本文方法制作粉丝,按每克芡糊淀粉1 U的量添加BsBsP处理芡糊,制作的粉丝断条率可以控制在10%以内,基本达到优质粉丝质量的国家标准,但以这一条件制作粉丝时粉丝并条较多,这可能增加后续理丝阶段的工作量,因此酶的使用效果不够理想;如果按照1.5 U的量使用普鲁兰酶,则粉丝并条现象基本消失,所制作的粉丝的断条率大约为2.5%,与添加明矾获得的粉丝非常接近;继续增加酶的用量对进一步提高粉丝质量没有明显的作用,因此每克芡糊淀粉1.5 U普鲁兰酶是比较合适的用量。这个结果与采用GsP处理芡糊的效果基本一致[6],所获得的粉丝的质量也很接近。
红薯粉是粉丝制作的另一种重要的原材料,由于部分保留了红薯香甜的口感及更多的营养成分而受到人们的欢迎。由于红薯粉是一种未经提纯的初级农产品,成分复杂,因此以红薯粉为原料制作粉丝时有一定的困难[7]。表3是BsBsP用于红薯粉粉丝制作的实验结果。
由表3可知,以红薯粉为原料制作的粉丝断条率明显比采用纯淀粉为原料制作的粉丝的断条率高。采用BsBsP水解芡糊可以解决煮丝阶段并条问题,也能在一定程度上降低产品断条率,但断条率只能降低到10%左右,而且酶的用量需要达到3 U,增加酶的用量并不能进一步提高粉丝的质量。本课题组前期开发的两种耐热型中性普鲁兰酶GsP和PUL3665用于红薯粉粉丝制作时,成品粉丝的断条率可以降低到5%左右[7],但与纯淀粉粉丝的质量仍有差距。BsBsP用于以红薯粉为原料的粉丝制作时其工艺条件还需要进一步改进。在所试验的方法中,用红薯淀粉替代大约50%的红薯粉可以明显改进粉丝质量,在使用1.5 U的BsBsP的条件下,所获得的成品粉丝断条率一般可以降低到7%~9%,基本达到优质粉丝的质量标准,但由此获得的粉丝的风味明显不如纯红薯粉粉丝。另外由于红薯粉种类繁多且质量差距很大,BsBsP用于红薯粉丝制作的效果很不稳定,因此其使用方法还需要进行更详细的探索。从产品质量考虑,BsBsP目前只适合于淀粉为原料的粉丝制作。
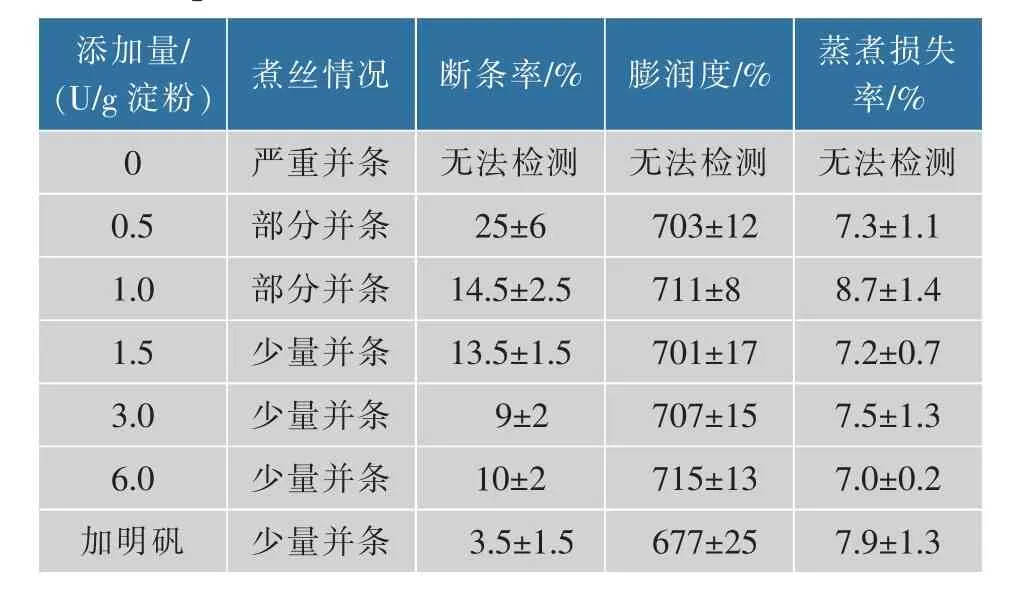
表3 添加BsBsP对红薯粉丝质量的影响Table 3 Effects of BsBsP addition on the quality of sweet potato vermicelli
3 讨论
作者研究了枯草芽孢杆菌普鲁兰酶基因BsP的表达,结果表明在枯草芽孢杆菌中BsP可以高效分泌到胞外,在大肠杆菌中则可以少量分泌到胞外。本研究采用的表达载体pLac03和pUP43本身均不含信号肽编码区,因此重组蛋白质的分泌表达是依靠自身结构完成的。用信号肽分析软件TatP(https://services.healthtech.dtu.dk/)对BsP基因编码的蛋白质序列进行分析显示,蛋白质的N端可能存在双精氨酸(twin-arginnine translocation,Tat)信号肽,其中第5、6位的连续两个精氨酸是其核心区。对BsP基因表达在大肠杆菌胞质内的重组蛋白质EcBsP和表达在枯草芽孢杆菌细胞外的蛋白质BsBsP进行N端测序显示,两种蛋白质的N端序列一致且均与按照BsP基因序列推测的蛋白质序列完全一致。Sec途径和Tat途径是细菌最重要的蛋白质分泌途径。其中,通过Sec途径分泌的蛋白质在分泌过程中其N端的一段信号肽会被切除,而通过Tat途径分泌的蛋白质由于采用先折叠后分泌的方式穿过细胞膜,一般不存在N端信号肽切除的现象[18]。N端测序和软件分析均显示,基因BsP的表达产物通过Tat途径分泌到细胞外。作者所在课题组前期对枯草芽孢杆菌的近缘微生物嗜热脂肪地芽孢杆菌(G.stearothermophilus)和地表地芽孢杆菌(G.subterraneus)的普鲁兰酶基因GsP和pul3665研究发现,两者在大肠杆菌和枯草芽孢杆菌中均能依靠自身结构实现分泌表达。其中,GsP蛋白质的N端测序显示,其胞外蛋白质的N端未发生信号肽切除的现象,因此推测其分泌表达是通过Tat途径实现的,但用TatP等信号肽预测软件对这个蛋白质的N端进行分析时却并未发现有Tat或其他形式的信号肽。图12是上述3种普鲁兰酶N端部分氨基酸序列的比对结果,3种蛋白质的序列具有一定的同源性。对3种蛋白质分子全域序列进行比对显示,BsP与另外两种蛋白质的同源性在50%左右,而3种分子均为I型普鲁兰酶,推测三者在各自细胞中应具有相同或相似的功能。从图12还可以看出,在3种蛋白质中只有BsP有典型的双精氨酸结构(—R—R—),其他两种蛋白质都只有第6位有一个精氨酸,其中GsP的精氨酸残基左右两侧甚至都不是碱性氨基酸。人们对大肠杆菌研究发现,双精氨酸(—R—R—)结构是双精氨酸途径信号肽的核心,这个特征几乎一成不变[19-20]。但本研究及文献[13]的结果显示,GsP基因在大肠杆菌中表达产物分泌到胞外的量显然超过BsP。朱新文等报道的基因pul3665在大肠杆菌中分泌表达的量也显然超过本文大肠杆菌胞外BsP的量。由此可见,在非大肠杆菌来源的蛋白质中,双精氨酸(—R—R—)序列可能不一定是Tat信号肽的必须结构,判断一种蛋白质是否能通过Tat途径实现分泌表达不能过于依赖这一特征。

图12 3种普鲁兰酶N端序列比对Fig.12 Sequence alignment of N terminal of three pullulanases
作者还发现,BsP基因在大肠杆菌中的表达产物能否分泌到细胞外还和培养条件有关。采用TB培养基培养的细胞表达的重组酶可以少量分泌到细胞外,而采用LB培养基培养的细胞在诱导表达后培养液中未检测到明显的普鲁兰酶酶活。有关GsP的研究也发现了类似的情况。枯草芽孢杆菌及其近缘微生物已经有多个普鲁兰酶基因被克隆并实现了异源表达,如嗜热喜油地芽孢杆菌(G.thermoleovorans)[11]、热链型地芽孢杆菌(G.thermocatenulatus)[21]等。作者所在课题组早年研究了苏云金芽孢杆菌(B.thuringiensis)和地衣芽孢杆菌(B.licheniformis)的普鲁兰酶基因BlP和BtP在大肠杆菌中的表达[22-23],这些研究均以LB培养基培养细胞,均未发现重组酶利用自身结构分泌到细胞外的现象。从本研究结果看,如果采用本研究的条件对上述基因重新进行研究有可能获得不同的结果。
BsP基因在胞质内和细胞外的表达产物表现出不同的性质。BsP基因在大肠杆菌胞质中的表达产物EcBsP和在枯草芽孢杆菌胞外表达产物BsBsP的氨基酸序列一致,但前者比酶活为27.7 U/mL,而后者为153.7 U/mg,后者为前者的5.5倍。枯草芽孢杆菌是一种公认食品安全的微生物,而胞外产物的提取可以省去细胞破碎的过程,因此更有利于技术的实际应用,因此枯草芽孢杆菌更适合于BsP基因的表达。从蛋白质电泳的情况看,BsBsP在枯草芽孢杆菌中的表达量还不够理想,明显小于另一种普鲁兰酶GsP的表达量,这导致发酵液中BsBsP的酶活相比GsP没有表现出应有的优势。BsP表达量不够高的一个重要原因可能是其基因中含有较多的细菌稀有密码子。在细菌密码子中,精氨酸的密码子AGA和AGG是对基因表达水平影响较大的稀有密码子。在BsP基因中,AGA和AGG密码子合计共有15个,占全部精氨酸密码子的41.7%,而GsP蛋白质虽然有52个精氨酸残基,但GsP基因却完全没有上述两种密码子。从密码子情况看,通过密码子、表达条件等的优化,BsBsP蛋白质的发酵水平还有很大的提升空间。
4 结语
枯草芽孢杆菌鲁兰酶基因BsP表达产物利用双精氨酸途径可以实现高效分泌表达。分泌表达产物BsBsP具有较高的比酶活,在以淀粉为原料的粉丝制作中有一定的应用前景。
