盐敏感性高血压患者体位性低血压和体位性高血压与靶器官损害的关系分析〔1〕
2022-03-07卫建辉翟哲民王玉梅李敏尚丽丽杜柳杨刘存学刘玲张翠萍齐鹤王琦张翠
卫建辉,翟哲民,王玉梅,李敏,尚丽丽,杜柳杨,刘存学,刘玲,张翠萍,齐鹤,王琦,张翠
(1.三门峡市中心医院,河南 三门峡 472000;2.三门峡职业技术学院,河南 三门峡 472000)
盐敏感性高血压(SSHT)是指高血压患者摄入高盐后血压明显升高,减少或限制盐的摄入后血压下降,是一种特殊类型的高血压。调查显示[1],SSHT占我国高血压人群的50%~60%,高血压人群的51%患者具有盐敏感性。临床研究显示[2],SSHT患者的心脏、肾脏等靶器官损害出现得更早、更严重,且心血管事件发生率及病死率显著升高。体位性高血压(OHT)和体位性低血压(OH)也是高血压诊治过程中经常遇到的疾病。OH可增加患者左心室肥厚、缺血性脑卒中、摔倒及动脉硬化等不良事件发生风险,导致预后不良[3]。研究显示[4-5],OHT或OH是无症状性脑卒中、晕厥和心血管事件的独立危险因素,极易发生晕厥、心脑血管事件等。目前,SSHT患者合并OHT和OH的研究报道较少。本研究旨在探讨SSHT患者OHT和OH的构成比、血压的特点以及靶器官功能损害情况。
1 资料与方法
1.1 一般资料
选取2018年1月—2020年6月三门峡市中心医院高血压科住院确诊为SSHT的患者380例,均符合《中国高血压防治指南(2018年修订版)》中高血压的诊断标准[6]以及盐敏感性高血压的定义,其中男203 例,女177 例,年龄(45.37±4.23) 岁。纳入标准:年龄18~65 岁;明确诊断为高血压;意识清楚,行动自如可配合检查;患者及其家属均知情同意,并签署知情同意书。排除标准:继发性高血压(如肾性高血压、肾血管性高血压、原发性醛固酮增多症、睡眠呼吸暂停低通气综合征、嗜铬细胞瘤或副神经节瘤等);不能完全配合卧立位血压测量的患者;有脑血管病后遗症如肢体功能障碍;合并有严重的心脏瓣膜性疾病、心力衰竭、肝脏疾病、慢性肾脏病、血液系统疾病及恶性肿瘤等;患有精神疾病或智力、肢体活动障碍不能配合者。所有患者均在进行各项检查之前同意并签署知情同意书,且得到我院医学伦理委员会的批准,本研究符合《赫尔辛基宣言》的基本原则。
1.2 方法
对入选的380 例SSHT患者进行卧立位血压测量,依据体位血压情况分为OH组、OHT组及体位性正常血压(ONT)组。高血压的盐敏感性测定:采用国际标准方法进行急性静脉盐负荷试验。试验分两天完成:第1 天盐水负荷期(随意膳食下,8:00-12:00静脉输注生理盐水2 L),第2 天削减钠量期(全天10 mmoL/d的低盐膳食,10:00,14:00和18:00分别服用利尿剂呋塞米40 mg)。凡是盐水负荷后平均动脉压(MAP)(MAP=舒张压+1/3脉压)较负荷前升高幅度和服呋塞米后平均血压较服用前下降幅度的二者之和≥10 mmHg(1 mmHg≈0.133 kPa),即判定为盐敏感者,<10 mmHg判定为盐不敏感者。测量两期末的血压,平均动脉压差≥10 mmHg者为盐敏感者,<10 mmHg者为盐不敏感者。
1.2.1 血压的标准测量方法
血压测量:选择经过定期校准的水银血压计,参照《中国血压测量指南》[7]进行血压测量。参加本研究血压测量的全部工作人员均经过严格的、统一的标准化培训。测量前静卧1 h,于安静状态下测量左侧臂肱动脉血压,记录收缩压(SBP)与舒张压(DBP)的数值,在盐负荷前、负荷结束时和口服呋塞米后次日分别测量血压,每次均需测量3 遍,同一次的血压测量每一遍均间隔至少1 min以上,并分别计算MAP。卧立位血压:所有患者均于每日上午7:00-10:00测量卧立位血压。患者取卧位,安静休息至少5 min后测定的血压值即为卧位血压;患者由卧位转为立位,测量站立后即刻(30 s)的血压和站立位2 min时的血压,取其平均值。测量血压时,血压计需与心脏保持同一水平,在测量的同时记录相应的心率。如果患者在体位转变时出现心悸出汗、身体晃动、眩晕、黑曚等现象,应立即予以平躺,缓解症状。
24 h动态血压监测:采用北京斯坦德利医疗科技有限公司动态血压监测仪(WBP-02型)。测量时间从上午6:00-7:30至次日上午6:00-7:30,袖带置于患者左上臂,自动充气测量收缩压、舒张压,并且记录心率。设置白天(6:00-21:59)为每15 min测量记录1 次,夜间(22:00-次日5:59)为每30 min测量记录1 次,自动监测24 h,监测期间可以日常活动。每小时区间有效读数无缺漏,同时设定SBP>260 mmHg或者<70 mmHg,DBP>150mmHg或者<40mmHg时的数据予以剔除,24 h动态血压监测的有效数据>90%。
观察指标:24 h、白天、夜间平均收缩压和平均舒张压,并计算24 h、白天、夜间血压标准差。
1.2.2 体位性血压异常的诊断
本研究的体位性血压异常采用美国自主神经科学学会和美国神经病学会诊断标准[8],OH的诊断标准:从卧位转为立位3 min以内,SBP下降≥20 mmHg和(或)DBP下降≥10 mmHg,或者在直立倾斜试验中至少60°,3 min内出现上述的血压变化,可伴或不伴各种低灌注临床综合征。OHT的定义:患者由平卧转为站立位后30 s和2 min平均SBP升高≥20 mmHg。ONT的定义:无上述OHT和OH者。
1.2.3 常规指标检测
入选患者均于清晨空腹采取静脉血,检测C反应蛋白(CRP)、血肌酐、甘油三酯、血尿酸(UA)、空腹血糖、N端脑钠肽前体(NT-proBNP)、尿微量白蛋白(U-mALB)等生化指标。
1.2.4 主要指标
高血压靶器官损害包括左心室肥厚(LVH)和/或左室高电压、脑卒中、眼底血管病变和肾小球滤过率(eGFR)下降。心脏损害采用超声心动图,结果提示左心室肥厚。LVH定义为左室质量指数(LVMI)≥125 g/m2(男性)或者≥110 g/m2(女性)。脑部以头颅MR或者CT检查符合脑卒中诊断标准。眼底血管损害以眼底镜检查视网膜动脉病变,按Keith-Wagener和Barker四级分类法,Ⅰ~Ⅳ级均是高血压性眼底病变。eGFR运用简化肾脏病饮食改良研究(MDRD)公式计算:[186.3×(血肌酐)-1.154×年龄-0.203×(0.742女性)(1.0男性)]。当eGFR<90 mL·min-1·1.73 m2时定义为eGFR降低。
1.2.5 意外事件观察
记录患者进行体位血压测量过程中及其后30 min内跌倒、晕厥等意外事件的发生率。本研究过程中未出现跌倒、晕厥等意外事件。
1.2.6 统计学方法
2 结 果
2.1 三组构成比
380 例SSHT中OH组患者85 例(22.37%),OHT组患者64 例(16.84%),ONT组患者231 例(60.79%)。
2.2 三组一般资料比较
三组患者的性别、年龄、体质量指数、C反应蛋白、甘油三酯(TG)、血尿酸、空腹血糖、N端脑钠肽前体、血肌酐以及尿微量白蛋白比较,差异均无统计学意义(P>0.05)(见表1)。
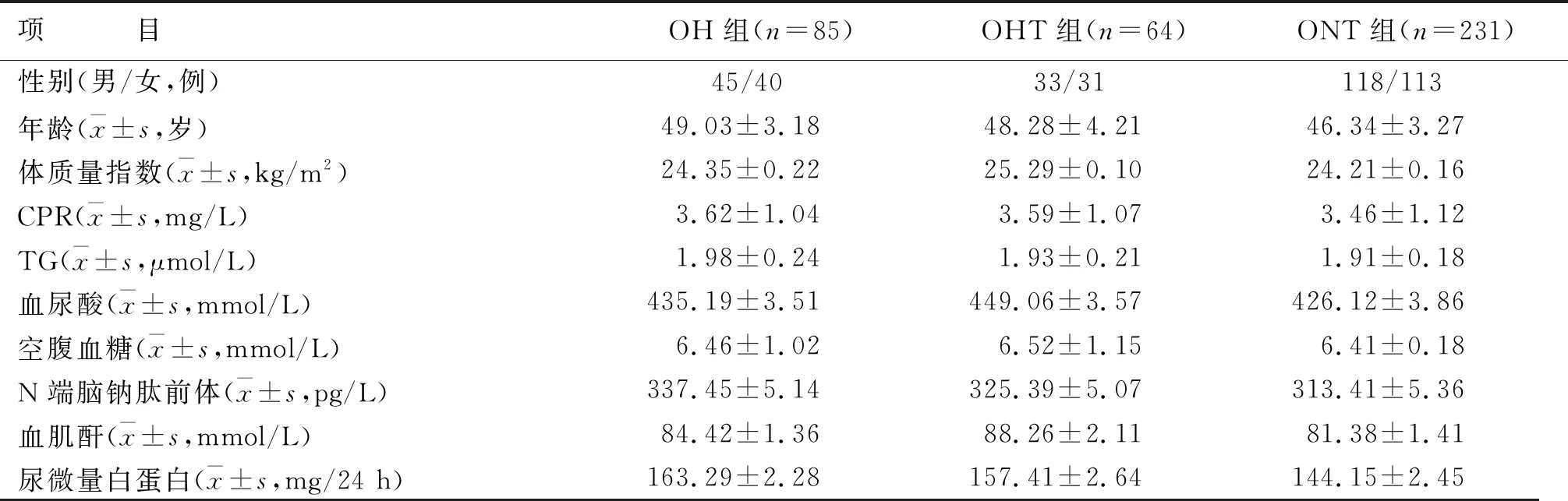
表1 三组一般资料比较
2.3 三组动态血压平均值比较
三组的全天平均血压、白天平均血压及夜间平均血压情况见表2。

表2 三组动态血压平均值比较 单位:mmHg
2.4 三组靶器官损害发生率比较
OH组及OHT组患者靶器官损害的发生率高于ONT组,差异均有统计学意义(P<0.05)(见表3)。
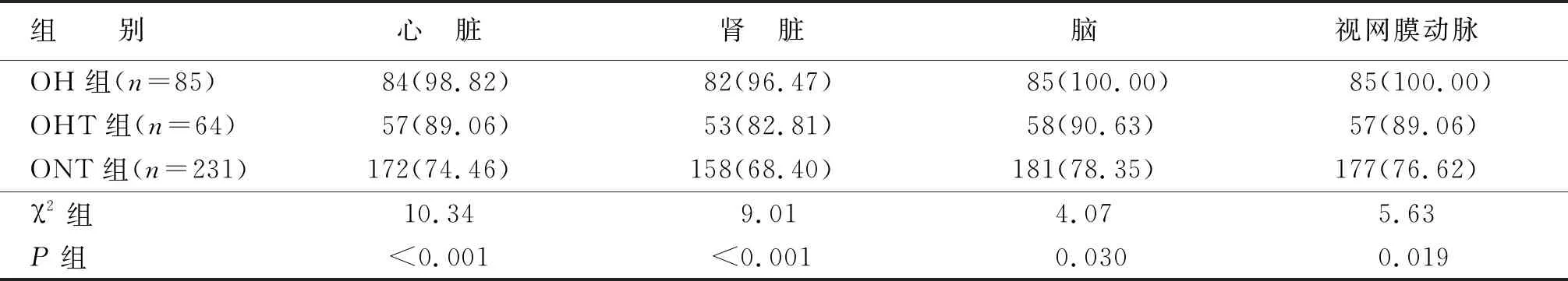
表3 三组的靶器官损害发生率对比 单位:例(%)
3 讨 论
SSHT是临床较为常见的一类高血压病。调查显示[1],SSHT占我国高血压人群的50%~60%。
牟建军等[9]研究显示,SSHT患者的靶器官损害出现较早,程度较严重,且心脑血管疾病的发病率和病死率显著增加。OH或OHT是无症状性脑卒中、晕厥和心血管事件的独立危险因素,OH也是急性心肌梗死、心力衰竭、腔隙性脑梗死等发病和全因死亡的独立危险因素[10]。研究报道[12],我国高血压患者中OHT的比例约4.2%,一般表现为舒张压升高并且波动较大,部分可伴心慌、出汗、疲倦。直立性心动过速、对利尿剂耐受、站立时腿部皮肤变为蓝色是OHT的3 个主要特征,可导致高血压靶器官损害、隐匿性脑梗死与认知功能障碍等。研究显示[12],OH发病率6%~35%,与血压升高显著相关。因此,SSHT伴OH或者OHT发生靶器官损害更早,进展更快,程度更严重,早期血压达标有利于减少靶器官损害。
本研究结果显示,SSHT患者中OH 85 例,构成比为22.37%,OHT 64 例,构成比为16.84%,ONT 231 例,构成比为60.79%,其原因可能与盐敏感性的生理特性相关。临床实践中进行OHT筛查的指标有:年龄、体质量指数、立卧位的收缩压和舒张压、甘油三酯、空腹血糖、血尿酸、血肌酐、尿微量蛋白、颈动脉超声(有无斑块)、心脏超声(左心室质量分数、舒张功能指标)、颅脑CT或者MR等[8]。本研究一般资料显示SSHT伴OH或OHT的患者男性略多于女性,以中青年居多,超重或者肥胖普遍存在;与ONT组患者比较,OH组、OHT组患者的甘油三酯、血尿酸、空腹血糖、N端脑钠肽前体、尿微量白蛋白水平均有增高,可能与患者的不良生活习惯、工作方式、饮食结构等有关,而超重或肥胖、高脂血症、高尿酸血症作为心血管病的危险因素可促进或者加重原来靶器官损害。董月等[13]研究证实,OH与卧位血压升高、高血压分级及早期肾功能损伤有关。研究发现[14],OHT与隐匿性高血压、清晨高血压、血压的变异性高度相关。本研究显示,三组间的全天平均血压、白天平均血压及夜间平均血压比较,差异有统计学意义,昼夜节律均消失,几乎全部表现为非杓型,这与既往的研究结果一致[15]。
SSHT患者特征性的动态血压改变和其本身的盐敏感性的特质密切相关。盐敏感性的病理机制是遗传性或者获得性盐敏感者机体细胞膜钠离子转运能力以及血管平滑肌收缩反应存在某种缺陷。最新研究结果显示[11],OHT时机体内的交感神经过度兴奋,β和α1受体被过度激活,进而引起内皮细胞损伤及心肌细胞肥厚,从而导致心血管重塑。OHT与冠状动脉粥样硬化性心脏病发病风险呈正相关,且与外周血管损害密切相关[16]。有研究显示[17],OHT患者的尿蛋白排泄率增加,其卧立位血压的变化与肾功能异常密切相关;OHT也是高血压患者发生隐匿性脑梗死和进展性深部脑白质病变的独立危险因素。池洪杰等[18]的研究证实了OH可增加心、肾、脑、视网膜动脉以及外周动脉损害。本研究表明,SSHT患者中三组均出现靶器官损伤,OH组和OHT组的靶器官损害发生率均高于ONT组,差异均有统计学意义(P<0.05),提示体位血压异常易加重靶器官损害,这与文献报道一致[19]。我们认为这与SSHT独特的发病机制紧密关联。研究表明[20],SSHT患者因高盐的摄入,激活肾素-血管紧张素-醛固酮系统(RAAS),增强交感神经系统活性,血管紧张素含量下降,醛固酮含量增加,血管活性物质减少,促进心肌纤维化、肾小球硬化,水钠潴留,从而引起血压升高,导致心肾等靶器官损害。当发生OHT或者OH时,人体原有的正常心血管生理状态发生频繁的异常改变,激活全身的交感神经系统,使其兴奋性增加,导致分布于心脏、肾脏的交感神经异常兴奋,从而引起心肾损伤。OHT或OH患者的全身交感神经活性增强,使血压变异性增大,长期处于此状态可致血管内皮功能障碍,血管壁损伤,促进高血压的发展,也是易出现心脑肾等靶器官损害的重要因素。
综上所述,体位性血压异常是高血压靶器官损害的重要因素,SSHT患者合并OHT和OH时靶器官损害出现的更早、更严重。因此,精准医学时代,加强OHT或OH的精准诊断、早期干预及规范治疗十分重要,血压控制平稳利于减少靶器官损害及不良事件的发生。
