基于AHP-熵权法结合色差原理优选猪心血丹参炮制工艺
2022-03-05于银萍刘欢欢陆兔林叶明磊刘明贵徐葱茏
于银萍,李 林*,张 婷,刘欢欢,王 敏,陆兔林,叶明磊,刘明贵,徐葱茏
(1. 南京中医药大学 药学院,江苏 南京 210046;2. 江西景德中药股份有限公司,江西 景德镇 333302)
猪心血丹参为孟河医派临方特色炮制品,临床上主要用于治疗心神不宁、心悸怔忡及痰迷心窍等证,历代医家认为猪心血为养心药之向导,能增强丹参入脑补血安神之功[1]。最早临床应用猪心血的是华佗,其思想影响着大批孟河医家,为增强丹参入脑补血安神之功,孟河医家创新使用猪心血炮制丹参。孟河医家巢崇山写到:“治疗素体血亏,肝脾不调,经水色黑而少,纳减形瘦,心中空洞,时有不能自主之状,夜不能寐,方中用猪心血拌炒丹参”[2]。清代凌奂编撰的《本草害利》[3]中记载:“猪心血拌补心药丹参之类,用作补心药之向导,盖取以心归心,以血导血之意”。随着孟河镇从医者越来越多,部分医家到上海行医,影响了上海的炮制技术[4],自1959 年第一版《上海市中药饮片炮制规范》起到2018 年第七版均收录猪心血丹参的炮制方法。
2018 年版《上海市中药饮片炮制规范》[5]收载猪心血丹参,其炮制工艺为:“取丹参用鲜猪心血、黄酒混合液拌匀,使之吸尽,干燥。每100 g 丹参,用鲜猪心3 只取血,加黄酒30 g,混匀”,但炮制工艺并不明晰,3 只鲜猪心血量不稳定,干燥方式及时间等均未具体说明,这些原因限制了猪心血丹参工业化生产。为使猪心血丹参更好地传承、发展,故开展猪心血丹参炮制工艺与色泽鉴别标准的相关研究,通过规范其炮制工艺,建立生产工艺技术与操作规程,为后续深入研究猪心血丹参炮制机理奠定基础。
1 仪器与材料
岛津LC-20AD 型高效液相色谱仪( 日本SHIMADZU 公司);MS-105D 型十万分之一电子分析天平(瑞士梅特勒-托利多公司);AR124CN 型万分之一电子天平[(奥豪斯仪器(上海)有限公司)];KQ-500B 型超声波清洗器(昆山市超声仪器有限公司);H1650-W 型台式高速离心机(湖南湘仪实验室仪器开发有限公司);CM-5 型分光测色仪(日本柯尼卡美能达有限公司)。
丹酚酸B( 批号:SBJ-10266,纯度≥98%,南京森贝伽生物科技有限公司);丹参酮 ⅡA( 批号:T817771,纯度≥98%,北京华威锐科化工有限公司);甲醇(色谱纯,江苏汉邦科技有限公司);乙腈(色谱纯,德国Merck 公司);磷酸[色谱纯,阿拉丁试剂(上海)有限公司];纯净水(杭州娃哈哈集团有限公司);乙醇(分析纯,南京晚晴化玻仪器有限公司)。
丹参饮片购于上海上药华宇药业有限公司,经南京中医药大学陈建伟教授鉴定为唇形科植物丹参Salvia miltiorrhizaBge.的干燥根和根茎的加工品;黄酒购于绍兴市绍一缸酒业有限公司(批号:GB/T13662);猪心血为南京大厂欣乐肉类食品中心定点屠宰场现场提供。
2 方法
2.1 猪心血丹参的制备
结合前期单因素实验,对猪心血量、黄酒量、烘干温度、烘干时间进行正交实验。取净丹参100 g,按L9(34)正交试验表分别加入不同量猪心血和黄酒拌匀,闷润至液体吸尽,在设定温度下烘干(水分<13%),到达规定时间后取出晾凉,即得。炮制工艺因素水平见表1。评价指标选择丹酚酸B 含量、丹参酮 ⅡA 含量、水溶性浸出物、醇溶性浸出物进行分析。

表1 猪心血丹参炮制工艺正交试验设计Tab. 1 Orthogonal experimental design of Porcine Cardiac Blood of Salviae Miltiorrhizae Radix et Rhizoma processing process
2.2 水溶性浸出物测定 依据2020 年版《中国药典》水溶性浸出物测定法(通则2201)项下的冷浸法测定[6]。
2.3 醇溶性浸出物测定 依据2020 年版《中国药典》醇溶性浸出物测定法(通则2201)项下的热浸法测定[6],用乙醇作溶剂。
2.4 丹参酮 ⅡA、丹酚酸B 含量测定
2.4.1 丹参酮 ⅡA 色谱条件 Kromasil C18色谱柱(4.6 mm×250 mm,5 μm);流 动 相A 为 乙 腈,B 为0.02%的磷酸溶液;柱温:20 ℃;检测波长:270 nm;流速:1 mL/min;进样量:10 μL;梯度洗脱程序(0 ~ 6 min,61%A;6 ~ 20 min,61%→90%A;20 ~ 20.5 min,90%→61%A;20.5 ~ 25 min,61%A)[6]。丹酚酸B 色谱条件 Kromasil C18色谱柱(4.6 mm×250 mm,5 μm);以乙腈-0.1%的磷酸溶液(22 ∶78)为流动相;柱温:20 ℃;检测波长:286 nm;流速:1.2 mL/min;进样量:10 μL[7]。HPLC 图见图1。
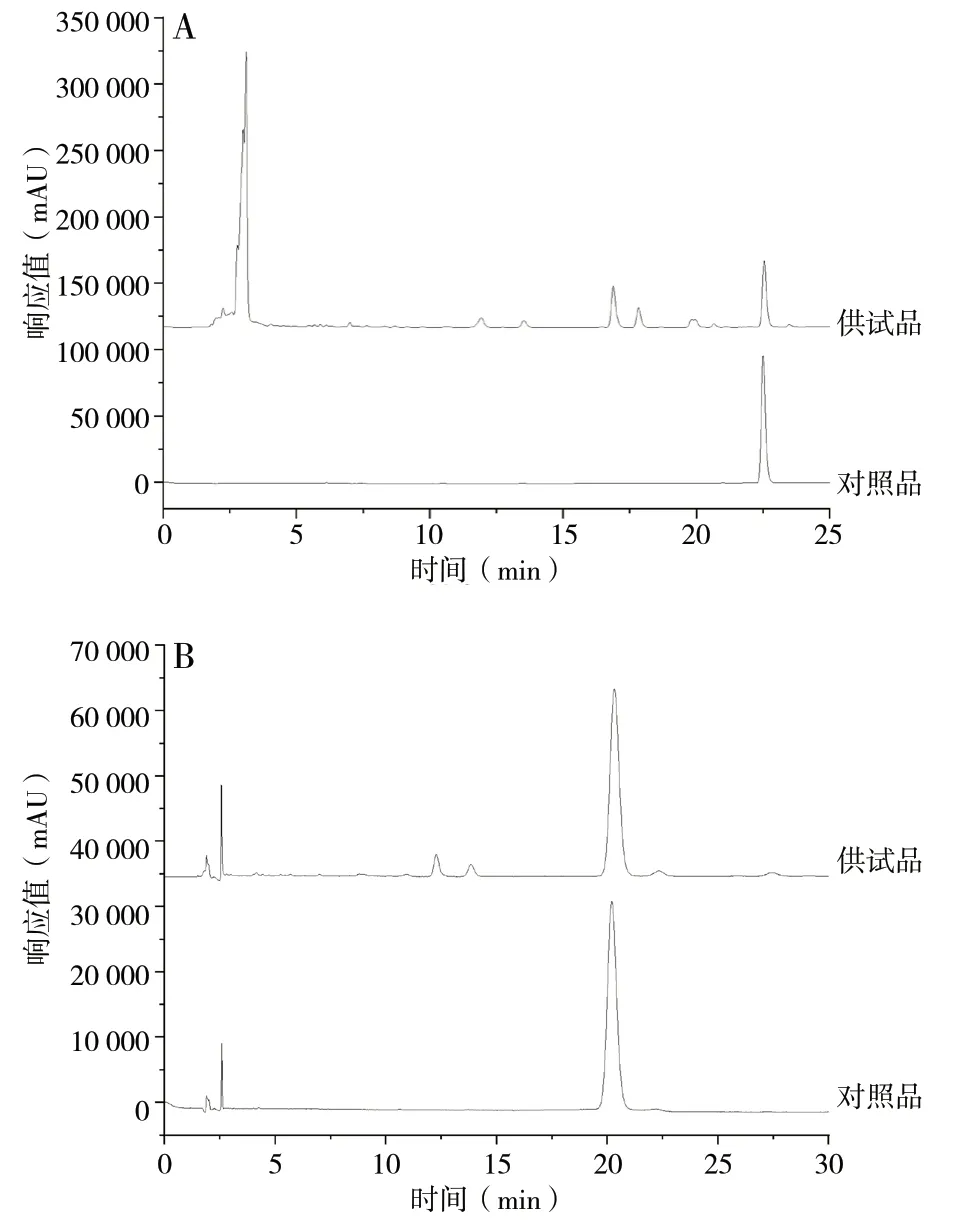
图1 各成分HPLC 图Fig.1 HPLC chromatograms of various constituent
2.4.2 对照品溶液的制备 精密称取丹参酮 ⅡA 对照品适量,置棕色容量瓶中,加甲醇配制成质量浓度为20 μg/mL 的溶液,即得丹参酮 ⅡA 对照品溶液。精密称取丹酚酸B 对照品适量,加甲醇-水(8 ∶2)混合溶液配制成质量浓度为0.11 mg/mL 的溶液,即得丹酚酸B 对照品溶液。
2.4.3 供试品溶液的制备 精密称取本品粉末(过三号筛) 0.3 g,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定重量,超声30 min,放冷,再称定重量,用甲醇补足失重,摇匀,滤过,取续滤液,即得丹参酮 ⅡA 供试品溶液。精密称取本品粉末(过三号筛)0.15 g,置具塞锥形瓶中,精密加入甲醇-水(8 ∶2)混合溶液50 mL,密塞,称定重量,超声30 min,放冷,用甲醇-水(8 ∶2)混合溶液补足失重,摇匀,滤过,精密量取续滤液5 mL,移至10 mL 容量瓶中,加甲醇-水(8 ∶2)混合溶液稀释至刻度,摇匀,滤过,取续滤液,即得丹酚酸B供试品溶液。
2.4.4 标准曲线绘制 精密称取丹参酮 ⅡA 对照品适量,置棕色容量瓶中,加甲醇分别配制成质量浓度为2.5、5.0、10.0、20.0、40.0、80.0 μg/mL 的溶液,按“2.4.1”项下色谱条件进行分析,记录峰面积。以质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得标准曲线方程Y= 54 813X,r=0.999 0,在2.5 ~ 80.0 μg/mL 范围呈良好的线性关系。精密称取丹酚酸B 对照品适量,加甲醇-水(8 ∶2)混合溶液分别配制成质量浓度为12.5、25.0、50.0、100.0、200.0、400.0 μg/mL 的溶液,按“2.4.1”项下色谱条件进行分析,记录峰面积。以质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得标准曲线方程,Y= 9 974.7X,r= 0.999 9,在12.5 ~ 400.0 μg/mL 范围呈良好的线性关系。
2.4.5 精密度试验 取同一供试品溶液连续进样6次,按“2.4.1”项下条件测定,丹参酮 ⅡA、丹酚酸B的RSD分别为0.12%、0.24%,表明仪器精密度良好。
2.4.6 重复性考察 精密称取同一样品6 份,按“2.4.3”项下方法制备。按“2.4.1”项下条件测定,丹参酮 ⅡA、丹酚酸B 的RSD 分别为0.18%、0.70%,表明方法重复性良好。
2.4.7 稳定性试验 取同一供试品溶液在 0、2、4、8、12、18、24 h 分别测定色谱峰面积,丹参酮 ⅡA、丹酚酸B 的RSD 为0.30%、0.82%,表明供试品溶液在24 h 内稳定。
2.4.8 加样回收率试验 取已知含量测定的同一猪心血丹参(丹参酮 ⅡA 的质量分数为0.154 6%) 粉末6 份,每份约0.3 g ,精密称定。加入丹参酮 ⅡA对照品约0.463 8 mg,按“2.4.1”项下色谱条件测定。取已知含量测定同一猪心血丹参(丹酚酸B 的质量分数为5.600%) 粉末6 份,每份约0.15 g,精密称定。加入丹酚酸B 对照品约8.400 0 mg,按“2.4.1”项下色谱条件测定。丹参酮 ⅡA、丹酚酸B 的回收率分别为97.55%、100.02%,RSD 分别为0.45%、0.39%,见表2,说明该方法有较好的准确性。
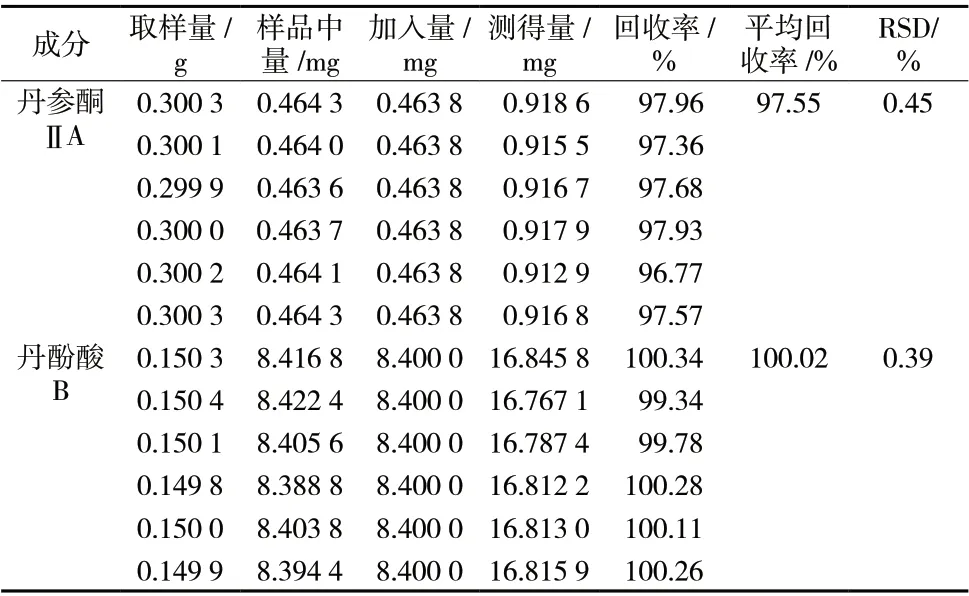
表2 加样回收率试验(n = 6)Tab. 2 Result of recovery test(n = 6)
2.5 熵权法-层次分析法计算综合评分
2.5.1 熵权法确定各指标权重 熵权法即在综合考虑各个因素所提供信息上,根据各项指标所提供的信息来确定权重。信息量越大,所得熵越小,对评价的贡献度越大,权重就越大[8]。指标权重(Wj)[9]按下式进行计算:指标标准化值(Yij) =(实测值-最小值) /(最大值-最小值)
2.5.2 层次分析法确定各指标权重 ①建立层次结构模型:结合影响猪心血丹参炮制工艺的指标等因素,建立了三个层次的结构模型。第一层为目标层,即优选猪心血丹参炮制工艺;第二层为指标层,即影响猪心血丹参炮制工艺的指标;第三层为方案层,即正交实验优选猪心血丹参炮制工艺。②构造成对比矩阵。③计算权向量并做一致性检验。④计算组合权向量并做组合一致性检验。查阅相关文献,对各指标按照不同的重要程度进行排序。
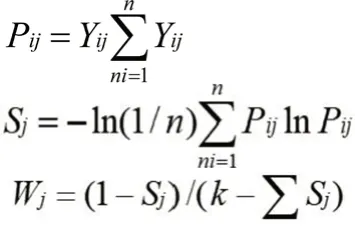
注:i , j 即第 j 项指标在第i 个方案中占该指标的比重;Pij 即该指标的变异大小;Sj 为一组数据的信息熵;Pij = 0 时,定义Si = 0; k 为指数个数。
2.5.3 熵权法-层次分析法计算复合评分 按下式计算熵权法-层次分析法综合权重(Hj)[10],wj、rj为熵权法、层次分析法所得权重系数。
2.6 色度值与指标性成分相关性研究
采用分光测色仪对不同炮制程度的猪心血丹参进行测色,以期为猪心血丹参生产在线检测提供参考。
按正交试验优选的最佳工艺进行炮制,但烘干时间从1 ~ 8 h,设置8 个点。对其颜色进行测定,每个样品平行测定3 次,取平均值,饮片粉碎过三号筛,使用CM5 分光测色仪观察脉冲下氙弧灯(D65ф3 毫米)的视角设置为10 点。校准后,选择SCE 模式。
2.6.1 精密度试验 取烘干时间4 h 的猪心血丹参饮片粉末适量,按上述条件进行颜色测定,连续测定6 次。L*,a*,b*的RSD 分别为0.01%、0.03%、0.02%,表明该仪器精密度较好。
2.6.2 重复性试验 取烘干时间4 h 的猪心血丹参饮片6 份粉末适量,按上述条件进行颜色测定,L*,a*,b*的RSD 分别为0.20%、0.40%、0.29% ,表明该方法重复性良好。
2.6.3 稳定性试验 取烘干时间4 h 的猪心血丹参饮片粉末适量,按上述条件进行颜色测定,于0、2、4、6、8、10、12、24 h 进行测定,L*,a*,b*的RSD分别为0.46%、1.61%、1.81%,表明该方法在24 h 内稳定性良好。
3 结果
3.1 熵权法-层次分析法计算复合评分
将得到的结果先采用熵权法,计算权重,丹酚酸B、丹参酮 ⅡA、水溶性浸出物、醇溶性浸出物的权重分别为0.49、0.14、0.20、0.17。再采用层次分析法对各指标按照重要程度进行排序。排列结果为丹酚酸B =丹参酮 ⅡA >水溶性浸出物=醇溶性浸出物,然后采用和积法并进行归一化,得到结果为丹酚酸B、丹参酮 ⅡA、水溶性浸出物、醇溶性浸出物的权重0.33、0.33、0.17、0.17。并进行一致性比值(CR)计算,CR = 0( <0.1)说明矩阵合理有效,权重系数可靠[11]。CR 越大,矩阵一致性越差;CR 为0 说明矩阵具有完全一致性。最后使用AHP-熵权法复合评分计算,丹酚酸B、丹参酮ⅡA、水溶性浸出物、醇溶性浸出物的综合权重分别为0.60、0.18、0.12、0.10。综合权重计算综合评分:Z = 0.60×100×( 丹酚酸B 含量/丹酚酸B 含量最大值)+ 0.18×100×(丹参酮Ⅱ A 含量/丹参酮 ⅡA 含量最大值)+ 0.12×100×(水溶性浸出物/水溶性浸出物最大值)+ 0.10×100×(醇溶性浸出物/醇溶性浸出物最大值) 。最后进行方差分析,得出炮制猪心血丹参最佳工艺,测定结果见表3、表4。
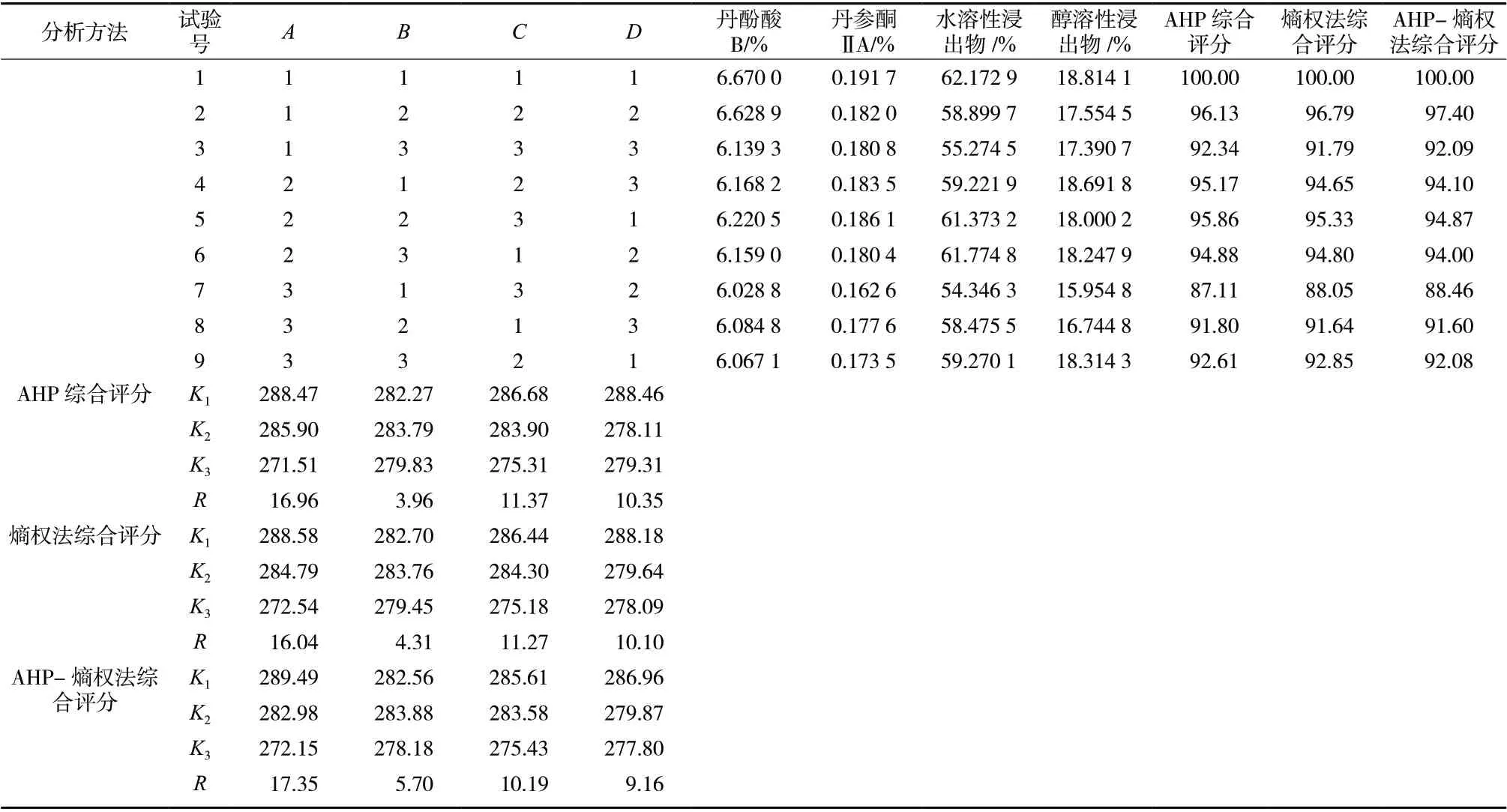
表3 L9(34)正交试验结果分析Tab. 3 Analysis of L9(34) orthogonal test results
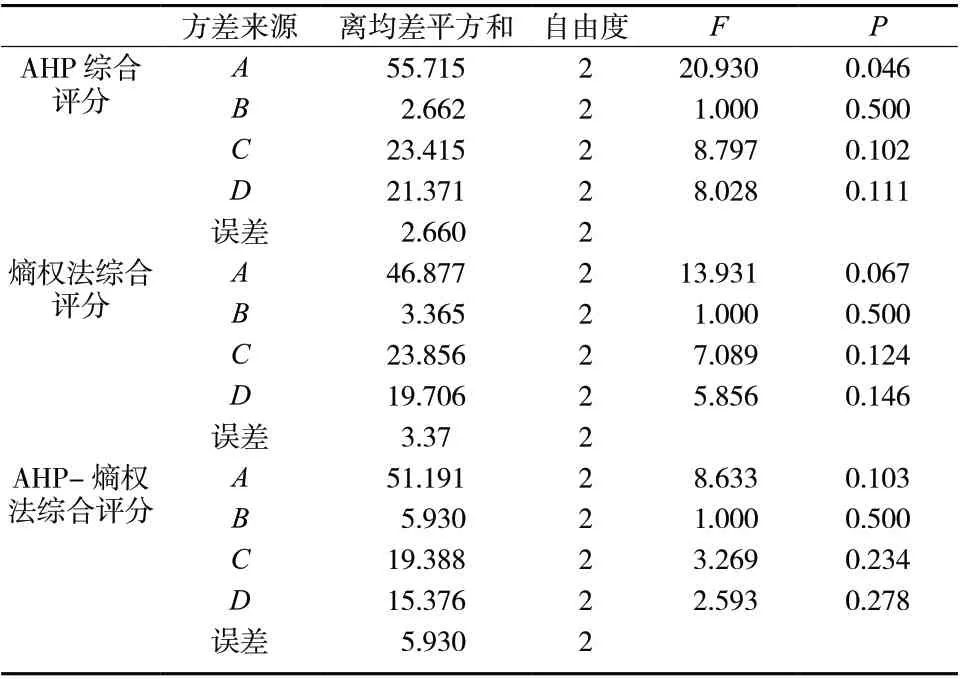
表4 方差分析结果Tab. 4 The results of the analysis of variance
结果显示,猪心血丹参炮制工艺仅因素A 对AHP 综合评分存在显著影响(P<0.05),熵权法所得各因素对综合评分无显著影响(P>0.05)。各因素对AHP-熵权法综合评分影响顺序为A>C>D>B,最佳工艺为A1B2C1D1,即猪心血量20 g/100 g,黄酒量30 g/100 g,烘干温度50 ℃,烘干时间4 h。
3.2 猪心血丹参最佳炮制工艺验证试验
称取丹参饮片100 g,按上述最佳炮制工艺炮制3 批猪心血丹参,按“2.2”“2.3”“2.4”项下方法进行含量测定,结果见表5。由结果可知,优选所得炮制工艺制备猪心血丹参饮片稳定、可行。故该工艺可作为生产时炮制猪心血丹参条件。
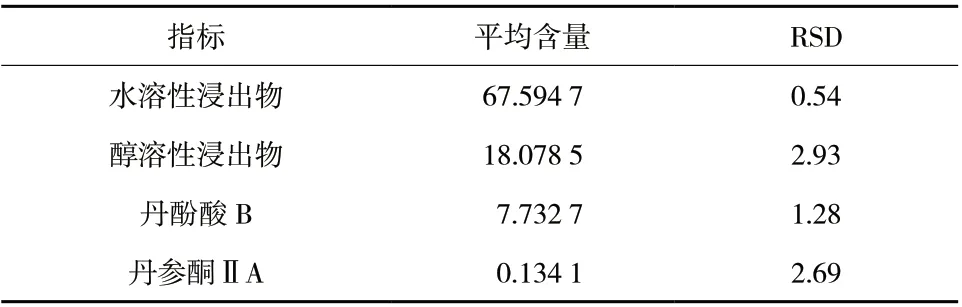
表5 猪心血丹参最佳炮制工艺验证试验结果(%,n = 3)Tab. 5 The best process verification results of Porcine Cardiac Blood of Salviae Miltiorrhizae Radix et Rhizoma(%,n = 3)
3.3 猪心血丹参样品颜色测定
对不同炮制程度猪心血丹参饮片进行颜色测定,见表6、图2。
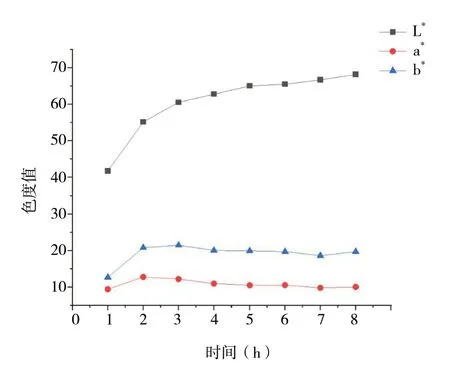
图2 猪心血丹参不同炮制程度色度值变化趋势图Fig. 2 Trend chart of color values of different degrees of preparation of Porcine Cardiac Blood of Salviae Miltiorrhizae Radix et Rhizoma
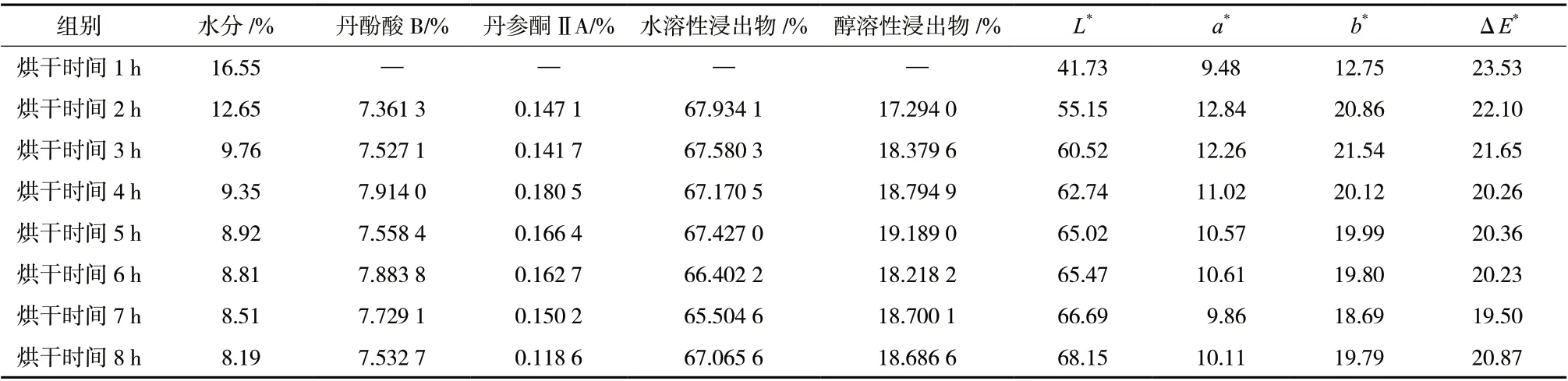
表6 猪心血丹参饮片含量测定及色度值结果(n = 3)Tab. 6 Determination of the content and color value of Porcine Cardiac Blood of Salviae Miltiorrhizae Radix et Rhizoma(n = 3)
3.4 色度测定结果分析
3.4.1 炮制时间与色泽相关性分析 将所得实验结果用SPSS 26.0 软件进行相关性分析,Pearson 相关系数显示,L*与炮制时间(2 ~ 8 h)呈正相关,相关系数为0.944(P<0.01);a*与炮制时间(2 ~ 8 h)呈负相关,相关系数为-0.931(P<0.01);b*与炮制时间(2 ~ 8 h)呈负相关,相关系数为-0.79(3P<0.05)。
3.4.2 色泽与含量相关性分析 将所得含量测定实验结果输入SPSS 26.0 软件进行相关性分析,Pearson 相关分析见表7。

表7 猪心血丹参色泽与含量的相关性分析结果Tab. 7 Results of correlation analysis between the color of Porcine Cardiac Blood of Salviae Miltiorrhizae Radix et Rhizoma and the time and content of preparation
3.4.3 建立色度值参考范围 将最佳炮制工艺所得猪心血丹参饮片的色度值作为基准上下浮动20%得到L*,a*,b*值范围为50.19 ~ 75.29、8.82 ~ 13.22、16.10 ~ 24.14。只有L*值和b*值范围可以较好的区分猪心血丹参炮制不及和炮制适中的样品,所以选择L*值和b*值范围确定猪心血丹参色度值参考范围。以此来确定猪心血丹参饮片在炮制过程中是否达到标准。
4 讨论
现代研究发现丹参炮制成猪心血丹参后,其水溶性成分与猪心血的肽类结合可以提高入血入脑的浓度[12]。脂溶性成分可以与其中的氨基酸或短肽形成盐类,增加溶解度,从而使其功效增加[13]。这些复合物目前无法进行准确的含量测定,故在丹酚酸B、丹参酮 ⅡA含量的基础上增加水溶性浸出物和醇溶性浸出物作为评价指标。层次分析法(AHP)为主观赋值法,熵权法为客观赋值法,两者进行综合评分,所得结果更加合理。猪心血丹参在炮制过程中,温度要适宜,温度太低、烘干时间太短,水分无法达到要求,则会使猪心血丹参霉变速度加快;温度太高、烘干时间太长,则会破坏猪心血丹参中有效成分,丹酚酸B 降解速度随温度升高而增大[14]。
由于饮片生产企业工业化生产烘干设备温度控制误差较大,设备不同部位温度区别明显,导致小试生产工艺无法顺利移至工业化生产,为了使企业批量生产时得到质量合格的饮片,采用分光测色仪对猪心血丹参不同炮制程度饮片进行颜色测定,研究猪心血丹参饮片颜色、含量与炮制时间的关系。以期在批量生产时通过颜色来判断猪心血丹参饮片炮制程度。经研究发现猪心血丹参炮制程度不同,其颜色也不同,对其含量和颜色进行相关性分析,结果显示炮制时间与颜色显著相关,即随着炮制时间延长,L*升高,a*和b*降低。L*值范围和b*值范围可以较好的区分猪心血丹参炮制不及和炮制适中的饮片,故选择L*值范围和b*值范围来衡量其是否合格。
5 结论
本研究通过AHP-熵权法和色差原理建立猪心血丹参的炮制工艺,经验证该炮制工艺条件稳定可行,可为规范化生产猪心血丹参奠定基础。但针对猪心血丹参饮片质量标准不完善的问题,有待进一步研究,以期为猪心血丹参的临床应用提供科学参考。
