钝顶螺旋藻多糖的分离纯化及组成分析
2022-03-05罗娟梅张鸿伟张晓梅安子哲卢海燕
范 斌,罗娟梅,张鸿伟,张晓梅,王 莉,安子哲,卢海燕,赵 雪,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.青岛海关技术中心,山东 青岛 266001)
螺旋藻为蓝藻门、蓝藻纲、颤藻目、颤藻科的一种微藻[1]。我国螺旋藻养殖量高居世界第一,占国际微藻总产量的40%~50%[2]。螺旋藻中富含多糖(15%~20%)、藻蓝蛋白(20%~28%)、不饱和脂肪酸(6%~13%)、维生素、叶绿素以及胡萝卜素、硒、锌和亚麻酸等营养物质,被美国食品药品监督管理局誉为人类的“最佳蛋白来源”,广泛应用于保健食品中[3]。螺旋藻大部分生长在碱性盐湖,因此其多糖的主要存在形式为酸性杂多糖[4]。研究表明螺旋藻多糖有抗氧化[5-6]、 免疫调节[7]、抗病毒[8-9]、降血糖[10-11]、抗肿瘤[12]、肠道调节[13]等生物活性。
螺旋藻多糖是一种复杂的杂多糖,硫酸根含量在6%左右。单糖分析确定其主要含有鼠李糖、甘露糖、葡萄糖、葡萄糖醛酸,同时含有少量的木糖、阿拉伯糖、半乳糖、核糖、岩藻糖、半乳糖醛酸等单糖[14]。在不同养殖环境和提取分离技术下,螺旋藻多糖的分子质量、单糖组成和结构都会有差异[15-18]。研究表明螺旋藻多糖主要是由葡萄糖、岩藻糖和鼠李糖通过α型糖苷键连接的硫酸黏多糖[19]。还含有部分β型糖苷键[20];采用甲基化技术分析,确定螺旋藻多糖主要是以1,3-连接的鼠李糖为主链,在2位或4位有大量分支,而葡萄糖以1,3-连接、甘露糖以1,4-连接的形式位于主链或侧链中。其中木糖为β构型,鼠李糖、葡萄糖和甘露糖醛酸均为α构型,并且在鼠李糖的2位或4位可能还有硫酸基团[21]。但采用传统的甲基化和核磁共振分析方法很难解析复杂的螺旋藻多糖中多种单糖的连接序列和糖链的基本组成单元。而多糖降解结合质谱分析是目前解析复杂多糖的糖链组成和结构的有效工具,已经用于肝素、硫酸软骨素和海藻多糖等复杂的硫酸多糖的结构解析。
为更好地分析螺旋藻中多种糖链的精确结构,为螺旋藻多糖的构效关系的提供结构基础,本实验采用蛋白酶酶解、热水提取、Q-Sepharose Fast Flow(Q-FF)阴离子交换柱法,从钝顶螺旋藻水溶性多糖中提取和分离纯化出5个多糖组分,分析比较不同多糖组分的基本化学组成。采用热降解结合亲水液相色谱-高分辨傅里叶转换质谱(hydrophilic interaction liquid chromatography-Fourier transform mass spectrometry,HILIC-FTMS)联用技术,进一步解析螺旋藻多糖糖链的寡糖片段和精确组成,以期为螺旋藻多糖的产品开发和高值化利用提供数据参考。
1 材料与方法
1.1 材料与试剂
钝顶螺旋藻粉 云南生物工程有限公司。
葡聚糖标准品(重均分子质量5 220、11 600、48 600、147 600、27 300 Da)、单糖标准品(葡萄糖、半乳糖、甘露糖、岩藻糖、鼠李糖、木糖、阿拉伯糖、葡萄糖醛酸、半乳糖醛酸、氨基葡萄糖、氨基半乳糖) 美国Sigma公司;Q-FF阴离子交换色谱 美国Amersham Pharmacia Biotech公司;1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP) 上海麦克林生化科技有限公司。
1.2 仪器与设备
1260高效液相色谱仪、ICS-2000离子色谱仪 美国Agilent公司;OHpak SB-804HQ柱(8.0 mm×300 mm,10 μm) 日本Shodex公司; Q-FF阴离子色谱填料(8 cm×30 cm) 美国GE Healthcare Bio-Sciences AB公司;Luna HILIC亲水液相色谱柱(2.0 mm×150 mm,3 μm) 美国 Phenomenex公司;IonPac AG11-HC离子色谱柱(4 mm×50 mm,9 μm)、IonPac AS11-HC离子色谱柱(4 mm×250 mm,9 μm)、UltiMate3000高效液相色谱仪、Q-Exactive高分辨质谱仪、傅里叶红外光谱仪 美国 Thermo Fisher公司;真空冷冻干燥机 德国Christ公司; MLS-3750高温高压灭菌锅 日本Sanyo株式会社。
1.3 方法
1.3.1 多糖的提取和纯化
称取100 g钝顶螺旋藻藻粉,加入干冰中充分研磨破壁。分别加入用甲醇、石油醚-三氯甲烷(2∶1,V/V)进行脱色脱脂。然后藻体中加入3 L 0.1 mol/L乙酸钠缓冲溶液、10 g木瓜蛋白酶、15 mmol EDTA-Na2、15 mmolL-半胱氨酸,于50 ℃水浴酶解24 h。水解液1 700×g离心15 min,收集上清液。将上清液浓缩后,加入无水乙醇至体积分数达到90%,4 ℃醇沉24 h,然后1 700×g离心15 min。取沉淀用蒸馏水溶解,溶液用截留分子质量为8 000~10 000 Da的透析袋透析。透析液真空旋转浓缩、冻干,得到粗多糖。
1.3.2 阴离子交换色谱法分离纯化多糖
将1 g粗多糖溶入100 mL磷酸盐缓冲液(0.05 mol/L,pH 7.8),加入Q-FF阴离子色谱柱(8 cm×30 cm),依次以浓度为0、0.2、0.4、0.6 mol/L 和0.8 mol/L的NaCl磷酸缓冲液(0.05 mol/L,pH 7.8)进行梯度洗脱。收集洗脱液,用截留分子质量为8 000~10 000 Da的透析袋透析脱盐,透析液浓缩、冻干后,分别得到P0、P0.2、P0.4、P0.6、P0.8五个多糖组分。
1.3.3 糖的热降解
采用高温降解法[22],将多糖用超纯水配制成 10 mg/mL溶液,用10%醋酸溶液调节溶液pH 5。取1 mL多糖溶液放于高压高温灭菌锅中,100 ℃加热降解30 min,然后冷冻干燥,得到多糖的热降解产物。
1.3.4 多糖的总糖含量测定
准确称量鼠李糖40 mg于500 mL容量瓶中溶解定容。分别吸取0.4、0.6、0.8、1.0、1.2、1.4、1.6及1.8 mL糖溶液于10 mL试管中,各加蒸馏水至2 mL,然后加入1 mL 6%的苯酚溶液和5.0 mL 98%浓硫酸,立刻摇匀,置于沸水浴中反应15 min。反应完毕,立即取出放入冰水浴中迅速冷却,使用酶标仪检测反应液在490 nm的OD值。以上述不同质量浓度鼠李糖标准品实际测定的质量浓度x(mg/mL)和OD值y作图,得到多糖的回归曲线方程y= 3.462 1x+0.082 8(R2= 0.986 1)。取0.2 mL样品溶液(2 mg/mL),同上反应,根据标准曲线计算样品中的总糖含量。
1.3.5 多糖的分子质量测定
用0.1 mol/L Na2SO4配制成5 mg/mL溶液,采用高效凝胶排阻色谱法进行分子质量分析[23]。选用1260高效液相色谱仪,色谱柱OHpak SB-804HQ柱(8.0 mm×300 mm,10 μm),流动相为0.1 mol/L Na2SO4溶液,流速0.5 mL/min,柱温30 ℃,进样体积20 μL,采用示差检测器检测。使用分子质量为5 220、11 600、48 600、147 600 Da和27 300 Da的葡聚糖作为标准品,以保留时间x(tR)和葡聚糖标准品分子质量的对数y(lgM)作图,得到回归曲线方程y=-0.362 3x+10.338 9,R2=0.997 0,根据标准曲线计算多糖的分子质量。
1.3.6 多糖的硫酸根含量测定
采用离子色谱法[24],以无水硫酸钾作为标准品,110 ℃烘干4~5 h后,准确称取0.4 g标准品定容于1 L容量瓶中,体积法稀释获取质量浓度为25、50、100、150、200、300 μg/mL和400 μg/mL的硫酸钾标准溶液。然后利用离子色谱仪测定标准品中硫酸根的含量,以标准品硫酸根质量浓度x(μg/mL)和峰面积y(μS·min)作图,得到回归曲线方程y=0.169 6x-0.499 3(R2=0.996 6)。
取2 mg多糖于安瓿瓶中,加入1 mL 2 mol/L三氟乙酸溶液,吹入N2后封瓶,然后再110 ℃消化8 h。消化完毕后,用氮气吹干三氟乙酸,用超纯水定容到10 mL。采用离子色谱检测溶液中硫酸根的峰面积,根据标准曲线计算样品中的硫酸根含量。
离子色谱仪参数设置:ICS-2000离子色谱仪;分离柱:IonPac AS11-HC(4 mm×250 mm,9 μm);保护柱:IonPac AG11-HC(4 mm×50 mm,9 μm);抑制器:ASRS ULTRA(阴离子抑制器)抑制电流90 mA;检测器:电导检测器;淋洗液及流速:20 mmol/L KOH溶液(试剂盒),1.2 mL/min;程序时间8 min;数据采集速率5.0 Hz;进样体积25 μL。
1.3.7 多糖的单糖组成分析
采用PMP柱前衍生-高效液相色谱法分析钝顶螺旋藻多糖中的单糖组成[25]。将样品配成10 mg/mL溶液,取200 μL加入安瓿瓶中,然后加入1 mL 2 mol/L三氟乙酸溶液,吹N2后封瓶,110 ℃水解4 h后,吹干三氟乙酸,用超纯水定容200 μL。取110 μL样品加入10 μL乳糖(20 mmol/L,内标),然后加入130 μL、0.3 mol/L NaOH和150 μL 1-苯基-3-甲基-5-吡唑啉酮衍生剂,在70℃水浴反应30 min。取出样品后加入130 μL、0.3 mol/L HCl终止反应后,加入三氯甲烷反复萃取除去多余的PMP衍生剂。取上层水相200 μL,稀释3 倍,进高效液相色谱分析。混合标准品由葡萄糖、半乳糖、甘露糖、岩藻糖、鼠李糖、木糖、阿拉伯糖、葡萄糖醛酸、半乳糖醛酸、氨基葡萄糖、氨基半乳糖11种单糖和乳糖内标组成(均为20 mmol/L),各取10 μL混匀,按照上述方法进行PMP衍生。
高效液相色谱参数:1260高效液相色谱仪;色谱柱:Agilent EC-C18分离柱(4.6 mm×150 mm,2.7 μm);检测器:245 nm紫外检测器;流速:0.4 mL/min; 柱温:30 ℃;流动相:A为0.1 mol/L磷酸盐缓冲液(pH 6.7)-乙腈(82∶18,V/V);B为0.1 mol/L 磷酸盐缓冲液(pH 6.7)-乙腈(65∶35,V/V);流动相梯度洗脱:0~55 min,98%~90% A、2%~10% B;55~56 min,90%~0% A、10%~100% B;56~58 min,0% A、100% B;58~59 min,0%~98% A、100%~2% B;59~60 min,98% A、2% B;进样体积20 μL。
1.3.8 多糖的红外光谱分析
将0.5 mg钝顶螺旋藻多糖与150 mg无水溴化钾混合,并在干燥条件下压制成片[26]。使用傅里叶红外光谱仪,以2 cm-1的数据采集速率记录多糖的红外光谱,范围为4 000~400 cm-1。
1.3.9 多糖降解产物的HILIC-FTMS联用分析
将多糖降解产物用超纯水溶解为10 mg/mL。取150 μL糖溶液,与乙腈按体积比1∶1混合均匀后,7 378×g离心5 min。将上清液用0.22 μm超滤膜进行过滤,收集滤液。取8 μL进行HILIC-FTMS分析[27]。
液相色谱参数:选用Luna HILIC亲水液相色谱柱;流动相:A为5 mmol/L醋酸铵溶液,B为98%乙腈;流动相梯度洗脱:0~30 min,2%~10% A、98%~90% B;30~40 min,10%~35% A、90%~65% B;40~50 min,35%~2% A、65%~98% B;50~60 min,2% A、98% B;流速150 μL/min。
高分辨-傅里叶转换质谱参数设置:使用Q-Exactive质谱,电喷雾电压4.2 kV;毛细管电压40 V;套管透镜补偿电压-50 V;毛细管温度275 ℃;鞘层气体流量 30 L/min;辅助气体的流量6 L/min;扫描时间1~50 min,分子质量范围100~1 500 Da。
1.4 数据分析及图表绘制
各实验重复3 次,采用Excel 2016软件进行统计分析,结果以±s表示。图形绘制用Origin 8.5软件。
2 结果与分析
2.1 钝顶螺旋藻不同多糖组分的基本化学组成分析比较
为研究螺旋藻多糖的种类和结构,本实验采用蛋白酶酶解、热水提取和强阴离子交换色谱法,从钝顶螺旋藻中提取和分离纯化出5个多糖组分P0、P0.2、P0.4、P0.6和P0.8。表1为5个多糖组分的化学组成分析比较。苯酚-硫酸法测得钝顶螺旋藻多糖各组分总糖质量分数为70%~90%,纯度较高。P0、P0.2、P0.4、P0.6的硫酸根质量分数均在6%左右,得率为20%~30%;而P0.8组分的硫酸根质量分数最高,达到14.46%,但是该组分得率只有1.25%,且脱盐操作繁琐,因此不适合开发利用。
表1中不同多糖组分的单糖组成分析发现,P0组分是一种葡聚糖,葡萄糖物质的量分数为77.49%,而半乳糖、鼠李糖、氨基葡萄糖、岩藻糖物质的量分数在2%~6%之间;P0.2组分是一个非常复杂的中性硫酸多糖,含有10种单糖,主要由葡萄糖(30.00%)、半乳糖(18.32%)、鼠李糖(12.72%)、岩藻糖(10.68%)等中性糖组成的杂多糖;而P0.4组分是一个非常复杂的硫酸鼠李聚糖,鼠李糖质量分数为30.46%,同时含有比较高的葡萄糖醛酸(14.91%)、葡萄糖(13.48%)、半乳糖(13.58%)和岩藻糖(11.26%);而P0.6组分主要由鼠李糖(45.81%)和葡萄糖醛酸(20.75%)组成的低硫葡萄糖醛酸鼠李聚糖。各个组分的单糖组成液相色谱图见图1。比较发现,P0.8组分与P0.6组分单糖组成非常相似,但是其硫酸根质量分数远高于P0.6组分,达到14.46%。
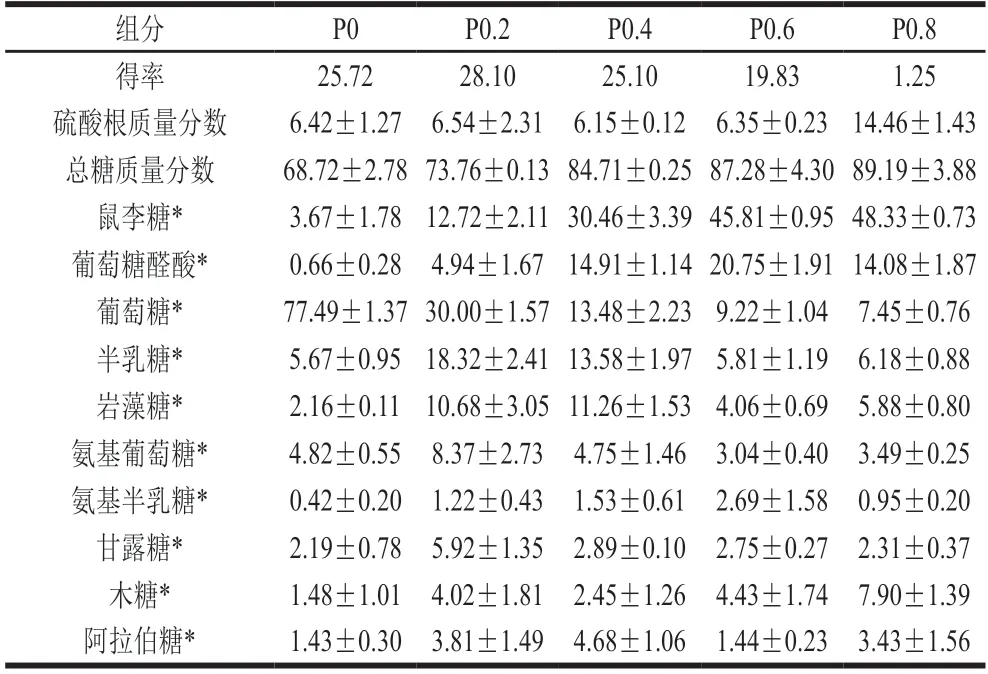
表1 钝顶螺旋藻不同多糖组分的化学组成的比较Table 1 Comparison of chemical composition of polysaccharide fractions from S. platensis %

图1 钝顶螺旋藻多糖不同组分的单糖组成液相色谱图Fig. 1 HPLC aprofiles showing the monosaccharide composition of different polysaccharide fractions from S. platensis
2.2 多糖的红外光谱分析
钝顶螺旋藻4个多糖组分的红外光谱分析的比较(图2) 可知,钝顶螺旋藻多糖P0~P0.6样品在3 354 cm-1附近均有强的O—H的伸缩振动峰,1 397 cm-1附近的O—H 的弯曲振动峰,结合1 028 cm-1附近的C—O—C碳水化合物骨架的伸缩振动峰,其为糖类共有的官能团;4个多糖组分在2 930 cm-1附近有C—H的伸缩振动峰,说明可能存在鼠李糖和岩藻糖的甲基或其他饱和碳氢键的伸缩振动;在1 651 cm-1附近有COO—和—NHCOCH3的 C=O键的伸缩振动和非对称伸缩振动,以及N—H键的弯曲振动;1 543.10 cm-1处是=CH2的变形吸收峰;P0和P0.2组分在1 543 cm-1有N—H的弯曲振动峰,说明含有—NH—;1 240 cm-1附近较小的吸收峰为S=O伸缩振动峰,证明4个多糖组分都含有少量硫酸根。
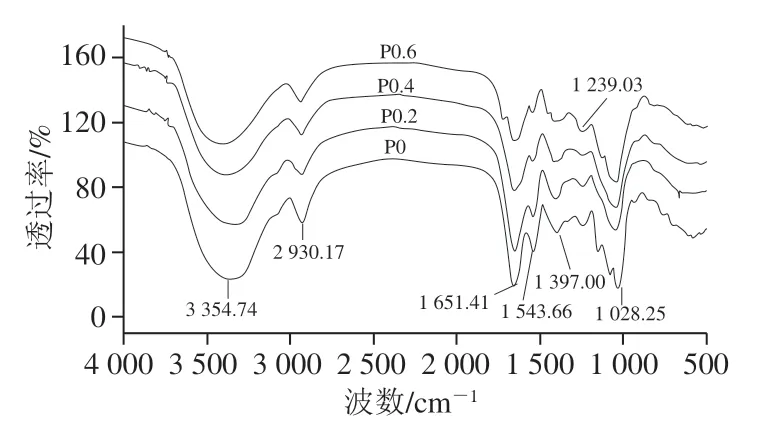
图2 钝顶螺旋藻多糖中不同组分的红外光谱图Fig. 2 FT-IR spectra of different polysaccharide fractions from S. platensis
2.3 多糖的分子质量测定结果
图3和表2为高效凝胶排阻色谱法对不同多糖组分及其降解产物分子质量的分析。P0和P0.2多糖组分中主要由分子质量为5.21 kDa(64.13%)和40.92 kDa(65.36%)的组分构成,还含有少量的分子质量为1 047 kDa(23.73%)和1 207 kDa(9.79%)的高分子质量多糖。而P0.4和P0.6多糖组分的分子质量低于P0和P0.2组分,主要含有分子质量180 kDa和167 kDa的多糖组分,还含有少量的分子质量小于1 kDa的组分。为了进一步分析钝顶螺旋藻多糖的结构特点,采用热降解法在100 ℃、pH 5.0降解钝顶螺旋藻多糖30 min。如表2所示,各多糖组分的分子质量显著下降,分子质量小于1 kDa的寡糖相对比例升高。
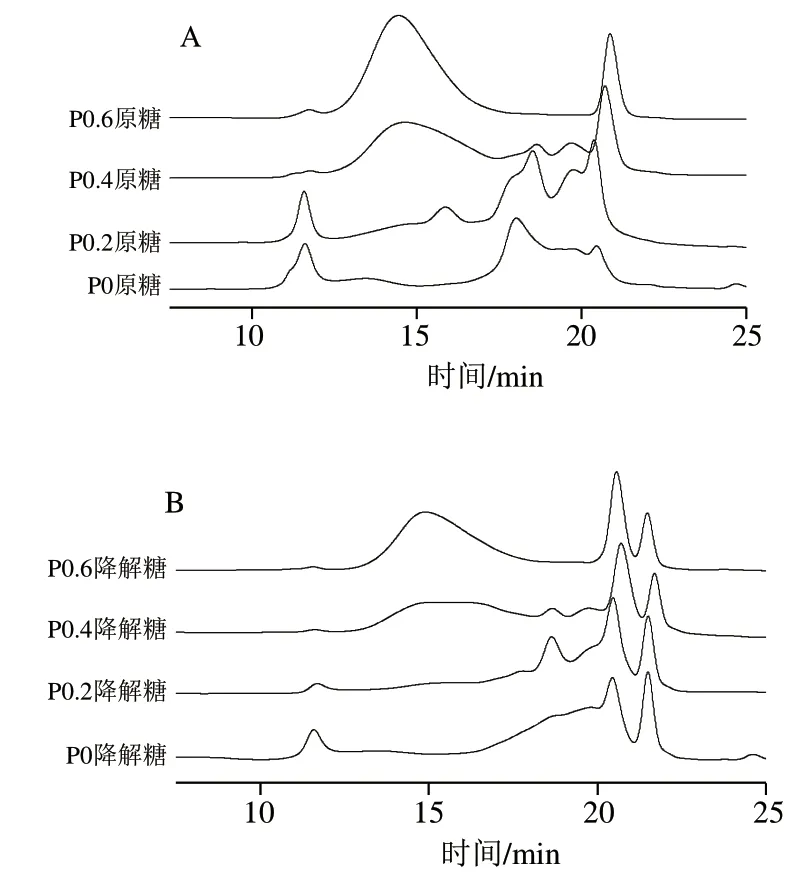
图3 钝顶螺旋藻多糖不同组分(A)及其降解产物(B)的 高效凝胶排阻色谱分析Fig. 3 HPSEC profiles of different polysaccharide fractions from S. platensis (A) and their degradation products (B)
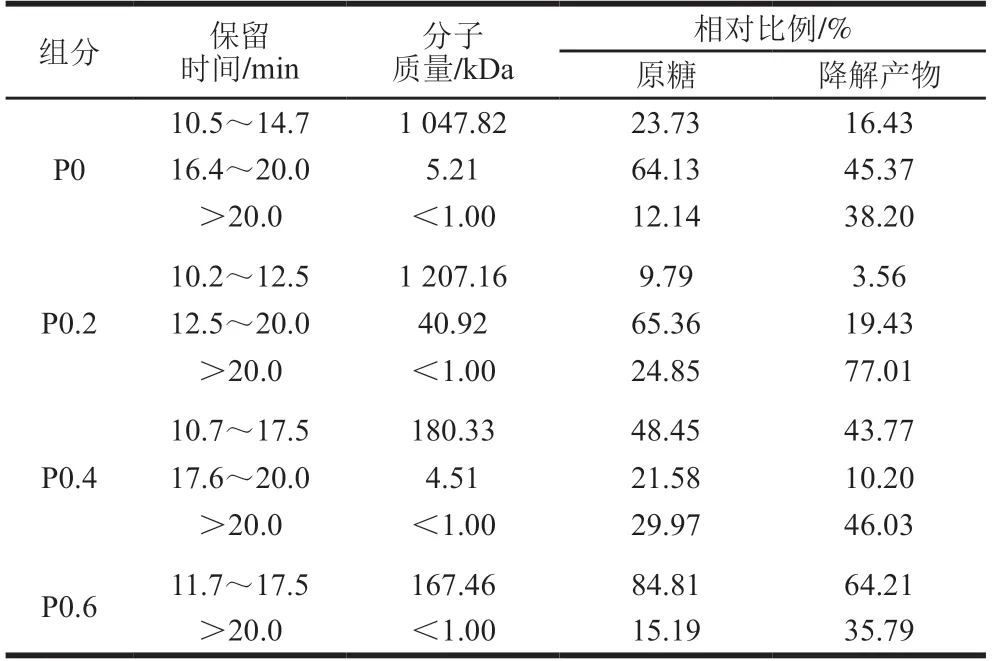
表2 钝顶螺旋藻多糖不同组分及其降解产物的分子质量分布Table 2 Molecular mass distribution of polysaccharide fractions from S. platensis and their degradation products
2.4 P0.2组分的热降解产物中寡糖的组成和糖链组成分析
因为螺旋藻多糖组成复杂,因此本实验利用热降解结合HILIC-FTMS,分析钝顶螺旋藻多糖降解产物中寡糖全指纹图谱。由于高分辨质谱的分析能力强,可以更全面地解析出降解产物中所有的寡糖组成,包括相对丰度低于0.1%的微量寡糖产物,从而解析出钝顶螺旋藻多糖的糖链上寡糖片段的组成特征,揭示多糖糖链的精细组成。因为P0组分主要为葡聚糖,P0.8组分的得率太低,因此本实验仅对P0.2、P0.4和P0.6三个组分在100 ℃ pH 5.0降解30 min的产物进行HILIC-FTMS分析。
采用HILIC-FTMS法分析钝顶螺旋藻P0.2组分的热降解产物,共发现了52个寡糖,相对丰度为0.01%~23.70%。表3为其中主要的22种寡糖的分子质量和相对丰度的比较。分析发现,P0.2组分降解产物中主要有己糖单糖Hex1(23.70%)、戊糖二糖(Pent2,17.55%;Pent2S1,6.23%)和三糖(Pent3,1.53%)、硫酸脱氧己糖Deoxyhex1S1(9.61%),其中己糖(Hex)可能是葡萄糖、半乳糖或甘露糖,戊糖可能是木糖和阿拉伯糖,脱氧己糖可能是岩藻糖或鼠李糖。说明P0.2糖链上主要是己糖、戊糖二糖、三糖和硫酸脱氧己糖组成。硫酸根主要分布在脱氧己糖和戊糖上;在降解产物中,脱氧己糖-戊糖的二糖和三糖(Deoxyhex1-2Pent1-2)占总寡糖相对丰度的18.25%,同时还存在脱氧己糖-糖醛酸、脱氧己糖-己糖(Deoxyhex2GlcA1-2(6.10%)、Deoxyhex2-3Hex1-2(2.2%)),说明该糖链的脱氧己糖上主要连接有戊糖,同时也有部分与糖醛酸和己糖连接。热降解产物中大量四糖Deoxyhex1-2Pent2-3Hex1和Deoxyhex2Pent1HexNA2的存在,也进一步说明P0.2组分中主链由脱氧己糖、糖醛酸、中性己糖和乙酰氨基己糖的寡糖片段组成。
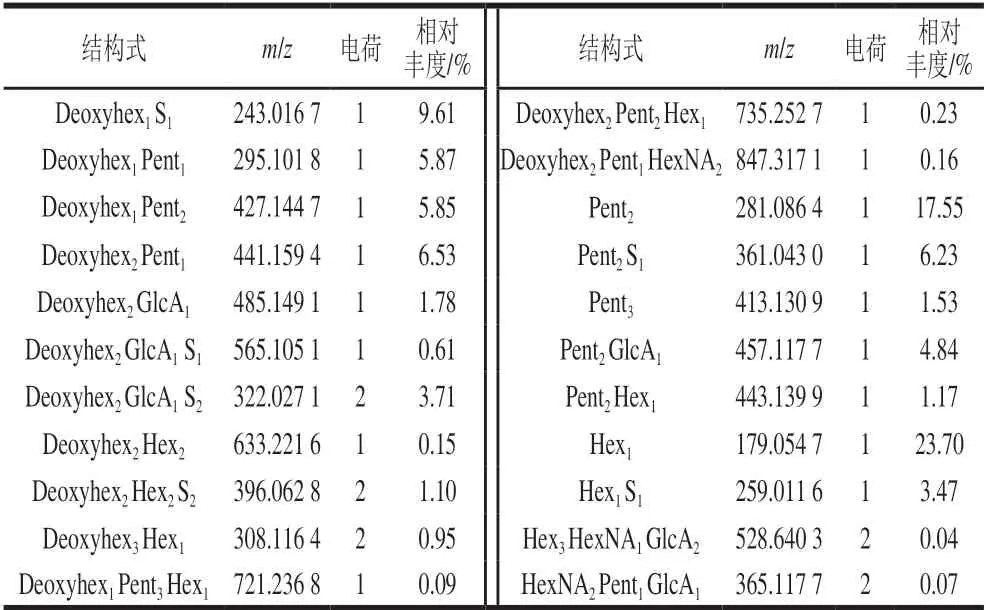
表3 钝顶螺旋藻多糖组分P0.2热降解产物中主要22个寡糖的 结构和相对丰度Table 3 Structure and relative abundance of 22 oligosaccharides identified in the degradation products of P0.2
2.5 P0.4组分的热降解产物中寡糖的组成和糖链组成分析
利用HILIC-FTMS法分析多糖组分P0.4的热降解产物,共解析出65个寡糖,相对丰度为0.01%~20.99%。表4为其中28个主要寡糖的分子质量和相对丰度的比较。单糖组成分析说明P0.4组分主要由鼠李糖组成,鼠李糖(30%)的相对丰度远高于岩藻糖(11%),因此认为糖链中的脱氧己糖主要是鼠李糖。在降解产物中,鼠李糖-戊糖(Rha1-4Pent1-2)寡糖相对丰度最高(29.78%),尤其是三糖Rha2Pent1最高,达到17.39%,说明糖链上主要是Rha-Rha-Pent的三糖重复单元和其他鼠李糖-戊糖寡糖片段组成,每1~2个鼠李糖上就连接1个戊糖;降解产物中鼠李糖-糖醛酸寡糖(Rha1-4GlcA1)占24.04%,尤其是二糖Rha1GlcA1的相对丰度最高,达到20.99%,说明糖链上有大量的鼠李糖-糖醛酸寡糖,其中Rha-GlcA的重复二糖的相对丰度最高;寡糖中只有微量的Rha4Hex1和Rha1HexNA2,说明只有微量的己糖和乙酰氨基己糖连接在鼠李糖上;降解产物中发现了聚合度1~3的鼠李糖寡糖(Rha1-3S0-1),其中单硫鼠李糖Rha1S1的相对丰度最高,说明部分鼠李糖上有1个硫酸根取代。
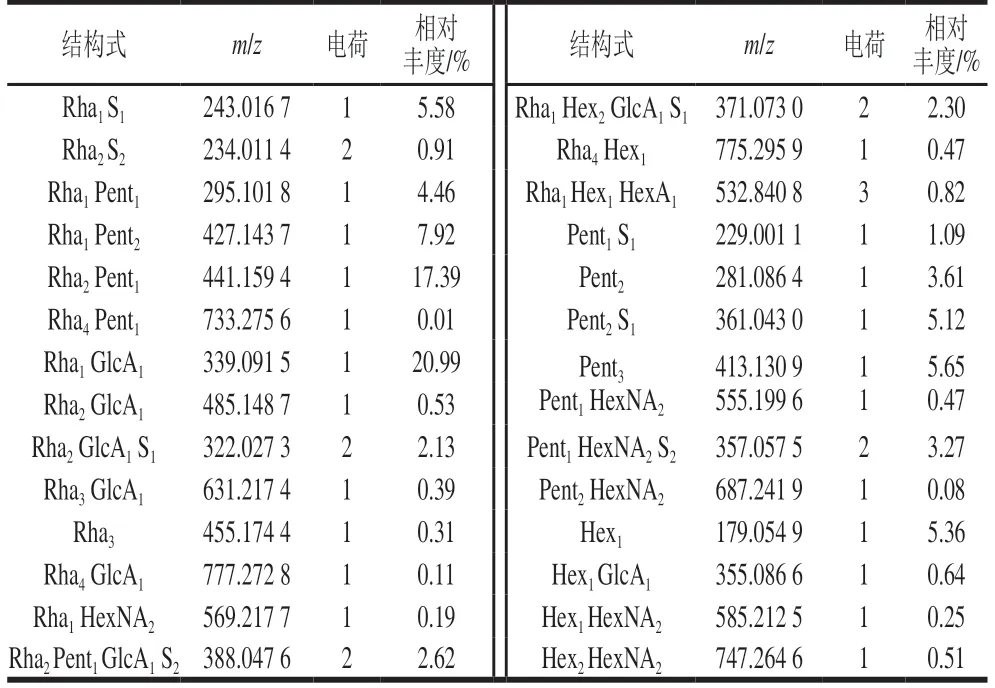
表4 钝顶螺旋藻多糖组分P0.4热降解产物中主要28个寡糖的 分子质量和相对丰度的比较Table 4 Molecular mass and relative abundance of 28 oligosaccharides identified in the degradation products of P0.4
P0.4组分降解产物中大量聚合度1~3的戊糖寡糖(Pent1-3,15.47%),说明糖链上有大量的戊糖二糖和戊糖三糖的片段,戊糖上有部分硫酸根取代;戊糖-乙酰氨基己糖寡糖Pent1-2HexNA1-2的存在说明戊糖上连接有少量的乙酰氨基己糖;而P0.4组分中己糖Hex只有5.36%,显著低于P0.2组分,微量的Hex1GlcA1和Hex1-2HexNA1-2的存在说明少量的己糖与葡萄糖醛酸和乙酰氨基己糖连接片段。Rha2Pent1GlcA1S2、Rha1Hex2GlcA1S1、Rha1Hex1HexA1为糖链中占比最高的寡糖片段。
2.6 P0.6组分的热降解产物中寡糖的组成和糖链组成分析
采用HILIC-FTMS法分析P0.6组分的热降解产物,共解析出65个寡糖,相对丰度为0.01%~19.37%, 表5为其中主要的24个寡糖的分子质量和相对丰度的比较。P0.6组分的降解产物中寡糖的组成与P0.4非常相似,主要由单硫鼠李糖(Rha1S1)、鼠李糖-戊糖寡糖 (Rha1-2Pent1-2)、鼠李糖-糖醛酸寡糖(Rha1-2GlcA1-2)和戊糖寡糖(Pent1-3)组成;但是P0.6组分中鼠李糖-糖醛酸寡糖(21%)高于鼠李糖-戊糖寡糖(14.36%)的相对丰度,糖链主要由Rha-GlcA(19.37%)和Rha-Pent(10.69%)二糖重复单元组成;同时该糖链中发现具有10%的鼠李杂糖九糖(Rha5Hex1Pent1HexNA2S2)和十糖(Rha3Hex6Pent1S4)片段。但是P0.6中只有微量的己糖Hex和己糖寡糖,与单糖组成结果一致,说明P0.6组分的糖链主要是由单硫鼠李糖寡糖、鼠李糖-戊糖寡糖、鼠李糖-糖醛酸寡糖和戊糖寡糖组成。

表5 钝顶螺旋藻多糖组分P0.6热降解产物中主要24个寡糖的 分子质量和相对丰度的比较Table 5 Molecular mass and relative abundance of 24 oligosaccharides identified in the degradation products of P0.6
3 结 论
本实验采用蛋白酶酶解、水提取、醇沉、QFF-阴离子交换色谱法,从钝顶螺旋藻中提取和分离纯化出P0、P0.2、P0.4、P0.6、P0.8五种结构不同的多糖组分。分析发现,5种多糖的分子质量在167~1 432 kDa之间,分布比较广。P0、P0.2、P0.4、P0.6四个组分硫酸根质量分数为6%~7%,只有P0.8组分硫酸根质量分数最高,达到14.46%,但是其得率只有1.25%。说明钝顶螺旋藻多糖主要是由低硫多糖组成。单糖组成分析结果说明,P0组分是一种葡聚糖,P0.2组分主要由葡萄糖、半乳糖、鼠李糖、岩藻糖等中性糖组成的杂多糖;而P0.4、P0.6和P0.8组分主要由鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖组成的非常复杂的硫酸鼠李聚糖,其中P0.6和P0.8组分的鼠李糖含量达到50%,主要由鼠李糖和葡萄糖醛酸组成。分析结果说明,钝顶螺旋藻中存在多种结构完全不同的低硫酸多糖,其中葡萄糖醛酸-鼠李聚糖是钝顶螺旋藻中特有的一种硫酸多糖。采用阴离子交换色谱技术,可以从钝顶螺旋藻粗多糖中去除葡聚糖和杂多糖的杂质,分离出纯度高的硫酸鼠李聚糖。
因为钝顶螺旋藻多糖结构复杂,使用传统核磁共振方法很难解析其结构。因此本实验采用热降解法降解钝顶螺旋藻多糖,然后利用HILIC-FTMS联用技术,分析从多糖糖链上降解下来的寡糖组成,从而解析钝顶螺旋藻多糖糖链的寡糖片段和糖链组成。HILIC-FTMS分析P0.2的热降解产物说明,P0.2的糖链主要是由己糖单糖、戊糖二糖和三糖、脱氧己糖-戊糖寡糖、脱氧己糖-糖醛酸寡糖等寡糖片段组成,硫酸根在脱氧己糖、戊糖和己糖上。而P0.4和P0.6两个组分的糖链结构相似,主要鼠李糖-戊糖寡糖、鼠李糖-葡萄糖醛酸寡糖、戊糖二糖和三糖片段组成,硫酸根连接在鼠李糖和戊糖上。研究证明,离子交换色谱、热降解和HILIC-FTMS联用技术,是分析钝顶螺旋藻中复杂的硫酸多糖糖链的精细组成的有效技术。下一步需要利用高效液相色谱-多级质谱联用技术解析寡糖的结构和序列,可以进一步解析钝顶螺旋藻多糖糖链的精确结构,为钝顶螺旋藻多糖的开发利用提供结构基础。
