锝[99Tc]亚甲基二膦酸盐注射液治疗类风湿关节炎患者前后的肠道菌群变化
2022-03-05陈昌明黄钊炜姚血明马武开
陈昌明,黄钊炜,曾 苹,姚血明,刘 灿,王 莹,马武开
类风湿关节炎(rheumatoid arthritis, RA)发病机制复杂,包括遗传因素、环境因素及免疫功能紊乱等,其中肠道菌群失调作为重要的环境因素在RA的发病及病情进展中发挥重要作用[1-2]。甲氨蝶呤 (methotrexate, MTX)、来氟米特 (leflunomide, LEF)、硫酸羟氯喹 (hydroxychloroquine sulfate, HCQ) 等传统抗风湿药物连用是目前临床规范化治疗RA的主要方案。锝[99Tc]亚甲基二膦酸盐注射液已用于RA的临床治疗,且疗效较好,克服了传统抗风湿药起效慢,不良反应率高的缺点[3]。现有研究[4]认为肠道菌群与传统抗风湿药物及宿主之间存在相互影响作用,而暂无研究锝[99Tc]亚甲基二膦酸盐注射液对RA患者肠道菌群的影响。因此,该研究主要检测锝[99Tc]亚甲基二膦酸盐注射液治疗RA前后患者肠道菌群的丰度、物种组成及多样性,探讨肠道菌群与宿主的相互影响,为阐述RA患者肠道菌群的特征及提高RA患者的临床治疗有效性和安全性提供参考。
1 材料与方法
1.1 纳入与排除标准纳入标准:① 临床诊断符合2010年ACR/EULAR的RA分类标准[5],RA患者病情评价 (DAS28评分)>3.2分;② 应用锝[99Tc]亚甲基二膦酸盐注射液 (成都云克药业有限责任公司,A:200527,B:2005309) 进行治疗,无用药禁忌;③ 年龄在75岁以下,行动不受限者。排除标准:① 有胃肠炎、消化道溃疡、胃肿瘤等严重胃肠道病史;② 2个月内服用过抗生素、DMARDs、糖皮质激素等药物;③ 2周内服用中草药制剂、微生态制剂、酸奶等;④ 近期存在不洁饮食或酗酒等特殊饮食习惯;⑤ 合并有高血压、糖尿病、高脂血症等严重心血管系统疾病或代谢性疾病;⑥ 合并有系统性红斑狼疮、强直性脊柱炎、多发性硬化症等其他自身免疫性疾病;⑦ 妊娠、哺乳期妇女或精神疾病患者;⑧ 擅自停药或失访者。
1.2 病例资料按照纳入排除标准筛选2019年9-11月贵州中医药大学第二附属医院风湿免疫科收治的明确诊断为RA的患者32例,并且使用锝[99Tc]亚甲基二膦酸盐注射液联合MTX (15 mg /周) 进行治疗,患者疼痛及活动明显时,短期应用美洛昔康 (7.5 mg/天)。就诊基本信息见表1。本研究方案经医院医学伦理委员会批准,患者知情同意并签署知情同意书。
1.3 样品采集对于符合纳入标准的RA患者,根据患者应用锝[99Tc]亚甲基二膦酸盐注射液分为治疗前组 (A组) 及治疗后组 (B组)。收集患者入院第一天粪便样本,即A组样本。待给予[99Tc]亚甲基二膦酸盐注射液治疗1个疗程 (10 d) 后,收集患者粪便样本,即B组样本。
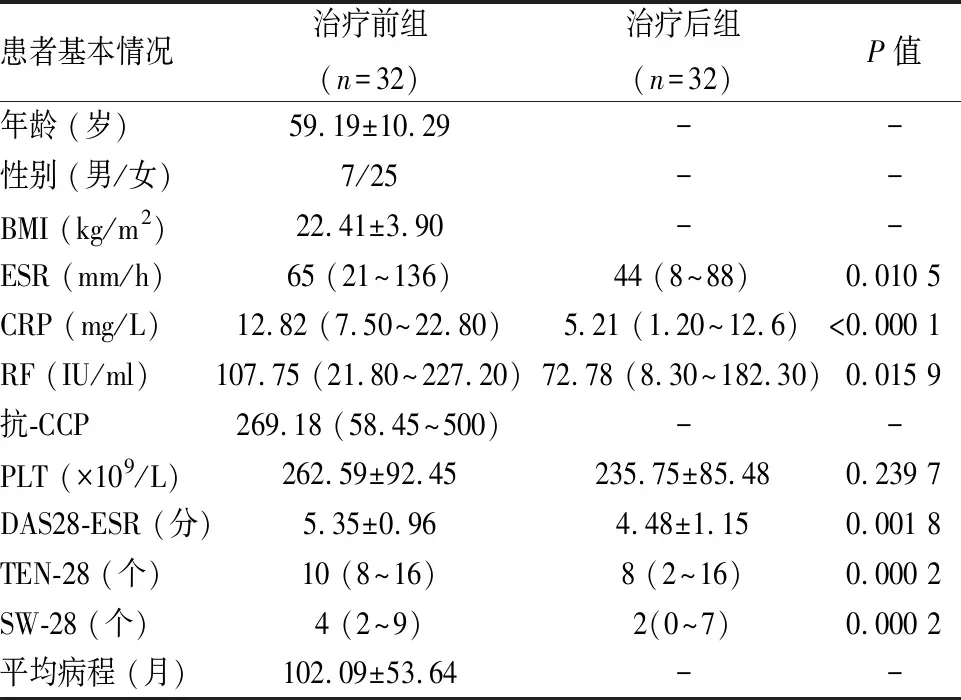
表1 患者就诊基本信息
1.4 基因组DNA的提取及上机测序分别用采集勺挑取收集好的粪便样本中间部分置于无菌管中并置于冰上待用,每个样本称取0.2 g分装于2 ml无菌EP管中,剩余样本存于-80℃冰箱。采用粪便基因组DNA提取试剂盒 (北京TIANGEN公司, DP328) 提取粪便基因组DNA并利用琼脂糖电泳检测基因组DNA的纯度。Nanodrop定量后取适量检测合格的肠道菌群DNA样本于离心管中,用无菌水稀释至1 ng/ml用作模板,使用Takara Ex TAq (日本Takara公司) 高保真酶和细菌16S rRNA 高变区V3-V4引物 (338F: 5′-ACTCCTACGGGAGGCAGCA-3′, 806R: 5′-GGACTACHVGGGTWTCTAAT-3′) 进行PCR扩增。PCR产物使用电泳检测,检测后使用磁珠纯化,纯化后作为二轮PCR模板,并进行二轮PCR扩增,并再次使用电泳检测,检测后使用磁珠纯化。随后进行文库制备、文库质检及Qubit定量,利用Illumina Hiseq 2500高通量测序平台对检测合格的文库样本进行16S rRNA测序分析。
1.5 生物信息学分析
1.5.1数据处理统计 使用Trimmomatic (version 0.35)、Flash (version 1.2.11)、split_ibraries (version 1.8.0) 及UCHIME (version 2.4.2) 软件对测序生成的raw data进行低质量部分剪切、拼接、过滤,得到有效数据 (clean data)。
1.5.2OTU分类 利用 Vsearch (version 2.4.2) 软件以有效数据97%的相似度进行基于序列间相似度的分类单元 (operational taxonomic units, OTU) 聚类,选取丰度最高的序列作为该OUT的代表序列。采用RDP classifier Naive Bayesian 分类算法对代表序列与数据库进行比对注释,得到OTU的注释信息。
1.5.3Alpha多样性分析 Alpha多样性 (简称α多样性) 指某个群落内部或环境内部物种的多样性,重点关注群落内的物种多样性及均匀度,通过单样本的多样性分析来反映样本内微生物群落的丰富度和多样性,物种丰富度和多样性主要通过α多样性指数(Simpson,Chao1,Shannon,Observed species)来表示。本研究利用α多样性指数计算统计法对A、B两组数据进行α多样性分析,通过计算指数,采用Wilcoxon rank sum test进行α多样性指数差异分析。
1.5.4Beta多样性分析 Beta 多样性 (简称β多样性) 指不同环境条件下群落之间物种组成的相似性及差异性。本研究利用R软件对Weighted的UniFra距离矩阵分别进行非度量多维尺度分析(nonmetric multidimensional scaling,NMDS),并用二维排列图显示群落样本的结构分布。
1.5.5群落结构分布 对A、B两组数据在门、纲、目、科、属、种各个不同的分类层级,进行相对丰度的注释以及汇总,并进行barplot统计并绘制Circos样本与物种关系图。
1.6 统计学处理两组之间比较如果符合正态分布且方差齐,采用配对样本的t检验或独立样本t检验,如果不符合正态分布采用Wilcoxon rank sum 检验或Mann-WhitneyU检验,P<0.05为差异有统计学意义。
2 结果
2.1 测序结果本次测序共64个样本,质控之后的干净标签数据量分布在48 152~51 989之间,clean tags经过去除嵌合体得到有效标签 valid tags (即最终用于分析的数据) 数据量分布在29 578~49 022 之间,各样本 OTU个数分布在331~1 680之间。
2.2 α多样性分析利用α多样性指数Observed species 绘制稀释曲线:观察到的物种数目随着测序数量的增加而上升,当随机抽取序列条数到6 000至8 000条时,观察到的物种数目逐渐趋向于平缓 (图1A),提示已有数据量合理,可以反映样本中的物种多样性;利用Shannon多样性指数构建的稀释曲线:当每个样本中随机抽取序列条数到1 000左右时,曲线则趋向于平坦(图1B),说明测序数据量足够,能够反应样本中大多数微生物的多样性信息。
另外,相较于RA患者治疗前,RA患者经锝[99Tc]亚甲基二膦酸盐注射液治疗后反应物种丰富度指数的Chao1及Observed species 指数有上升趋势,但差异无统计学意义,提示RA患者经锝[99Tc]亚甲基二膦酸盐注射液治疗后肠道菌群丰富度及多样性有一定程度的上升 (表2)。
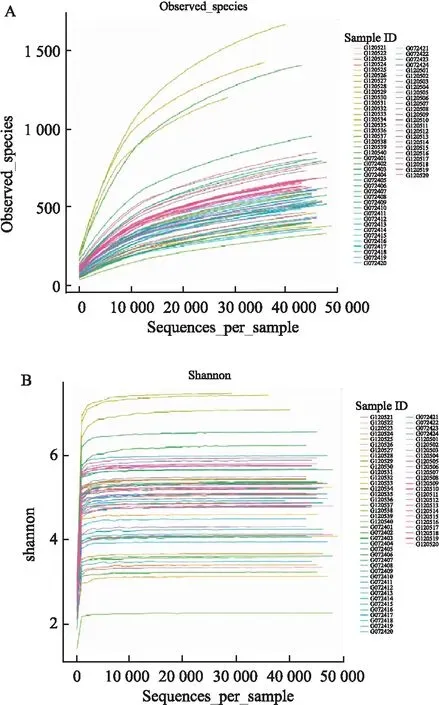
图1 Observed species指数 (A)、Shannon指数 (B) 的稀释曲线图
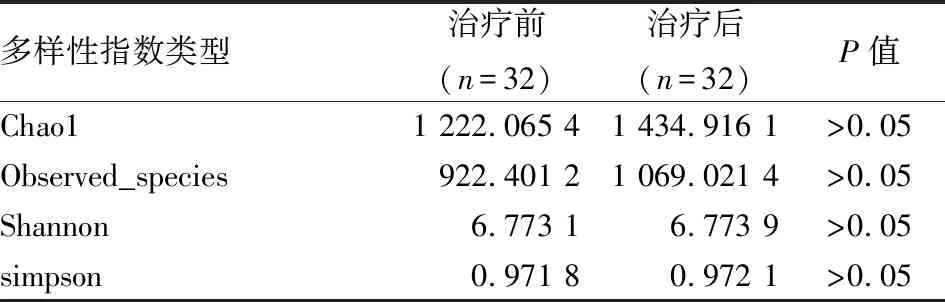
表2 治疗前组与治疗后组α多样性指数数据
2.3 β多样性分析通过Weighted UniFrac NMDS分析显示,在两组之间有一定的重叠,但能形成较能区分的两组整体肠道群落结构,并且Stress=0.092<0.2,故此分析较为可靠 (图2)。
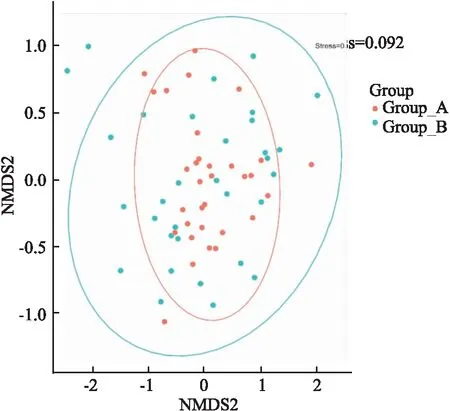
图2 NMDS分析图
2.4 RA治疗前后肠道菌群差异分析根据物种注释结果,选取每个样品在门、纲、目、科、属以及种水平上最大丰度排名前15的OUT,生成相对丰度柱形累加图。从门的水平上看,两组样本中检测到的拟杆菌门(Bacteroidetes)、厚壁菌门 (Firmicutes)、变形菌门 (Proteobacteria)、放线菌门 (Actinobacteria) 及梭杆菌门 (Fusobacteria) 为优势菌群,占细菌总数99%以上 (图3A)。用Metastats统计学算法对序列量差异进行比较检验得到 B组所占比例靠前的菌群相对丰度无差异 (P>0.05),软壁菌门 (Tenericutes) 丰度降低 (P<0.05) (图3B)。
进一步在属水平上对RA治疗前后肠道菌群进行比较分析,与RA治疗前相比,RA经锝[99Tc]亚甲基二膦酸盐注射液治疗后肠道菌群的相对丰度发生一定变化 (图4A),其中瘤胃菌属_UCG-004 (Ruminococcaceae_UCG-004)、瘤胃菌属_UCG-013 (Ruminococcaceae_UCG-013)、瘤胃菌属_UBA1819、丁酸菌 (Butyricicoccus)、稀少菌群克里斯滕森菌属_R-7_group (Christensenellaceae_R-7_group)、霍尔德曼氏菌属 (Holdemania)、厌氧弧菌属 (Anaerovibrio)、戈登氏杆菌属 (Gordonibacter)、毛绒厌氧杆菌属 (Lachnoanaerobaculum) 及Cellulosimicrobium菌属的相对丰度减少 (P<0.05),而巴氏杆菌属 (Pasteurella)、毛绒厌氧杆菌属 (Lachnoanaerobaculum)及口腔杆菌属 (Stomatobaculum) 的相对丰度增加 (P<0.05) (图4B)。
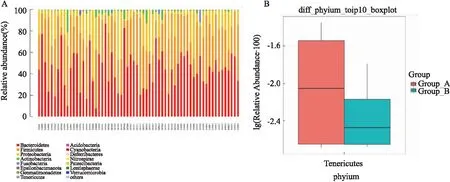
图3 门水平上的物种相对丰度 (A) 及治疗前后两组的相对丰度差异 (B)
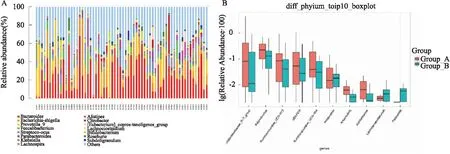
图4 属水平(A)及属水平上的物种相对丰度(B)
3 讨论
目前研究[6-7]表明肠道菌群失调可能是影响RA发生发展的一个重要环境因素,肠道菌群失调会使机体的免疫耐受功能发生变化,产生各种炎性因子及抗体在关节处或各器官聚集,启动细胞免疫或体液免疫反应,攻击自身组织,导致RA的发生。例如Teng et al[8]研究发现分节丝状杆菌能够通过诱导IgA分泌及激活B细胞刺激免疫应答,增强机体自身抗体的产生并通过诱导Th17细胞产生加速关节炎的发生发展。Gomez et al[9]发现关节炎易感型小鼠的肠道菌群主要由梭菌样细菌主导,而关节炎抵抗型的小鼠肠道则富集了紫单胞菌和双歧杆菌,证实了肠道菌群可能是RA的潜在生物标志物。Rastawicki et al[10]报道RA患者中大肠杆菌、乳酸菌、产气荚膜梭菌的数量较高。Scher et al[11]也发现肠道菌群失调的RA患者携带的普氏菌属细菌可能介导RA疾病的发生。
临床治疗RA以抗炎、镇痛及延缓病情进展为主。目前公认的治疗RA最有效的药物是DMARDs,但不良反应较多。一种DMARDs药物与其他药物联用控制RA病情比单用治疗效果更好,且能降低不良反应率。锝[99Tc]亚甲基二膦酸盐注射液能有效降低RA患者IL-1、TNF-α水平,减少滑膜等组织的胶原酶和前列腺素的形成,起到抗炎抗风湿的作用,较少引起感染、肝肾功能损伤及骨髓抑制等不良反应,但该药疗效不如DMARDs药物。因此应用锝[99Tc]亚甲基二膦酸盐注射液联合MTX治疗RA是目前较为有效的治疗RA方案之一[12]。由于肠道菌群与抗风湿药物及宿主之间可能存在相互影响,因此研究药物对肠道菌群的影响能够为类风湿关节炎的发病机制、疾病预防以及药物作用机制提供参考。目前关于肠道菌群与RA治疗的相关研究较少,且各研究结果存在差异。Zhang et al[13]在单用MTX或与其他DMARDs药物联合治疗RA后发现,RA患者肠道菌群数量发生改变肠球菌明显减少。刘雪梅[14]发现DMARDs治疗后RA患者肠道菌群中链球菌属的相对丰度有明显的上升。
本研究对应用锝[99Tc]亚甲基二膦酸盐注射液治疗RA患者前后的新鲜粪便样本进行16S rRNA分析。结果表明在应用锝[99Tc]亚甲基二膦酸盐注射液治疗后,RA患者的肠道菌群多样性有一定程度的升高,说明RA患者的肠道菌群在经治疗后得到了一定的恢复。利用Metastats分析得出治疗后的软壁菌门、瘤胃菌属_UCG-004、瘤胃菌属_UCG-013、瘤胃菌属_UBA1819、稀少菌群丁酸菌、克里斯滕森菌属_R-7_group、霍尔德曼氏菌属、厌氧弧菌属、戈登氏杆菌属、毛绒厌氧杆菌属及Cellulosimicrobium菌属的相对丰度降低;而相对丰度增加的菌属有巴氏杆菌属、毛绒厌氧杆菌属及口腔杆菌属。
软壁菌门又称柔壁菌门,菌体无细胞壁,只有一种称为单位膜的原生质膜包围在菌体四周,目前暂无报道RA与软壁菌门丰度的改变有关。Di Paola et al[15]在比较青少年特发性关节炎 (JIAc) 患者与健康人群肠道菌群结构时发现,JIA患者粪便中瘤胃菌科丰度增加。而瘤胃菌属会在反应性关节炎、强直性脊柱炎、腺瘤、直肠癌、炎症性肠病等状态下大量扩增,本研究显示治疗后组的瘤胃菌属的相对丰度下降,说明锝[99Tc]亚甲基二膦酸盐注射液能够抑制瘤胃菌属,对人体来说是有益的,值得进一步探讨。
由于该研究的样本量相对较少以及存在一定的地域差异及个体差异,并且患者粪便中的菌群也不能完全反映人体肠道中的固有定植菌群,所以本研究有一定的局限性。进一步研究锝[99Tc]亚甲基二膦酸盐注射液对患者肠道菌群的影响需要扩大样本,并建立动物模型验证实验结果,并对药物影响的差异细菌进行深入探讨。
