子宫腺肌病在位/异位内膜TRPV 1、OTR的表达与痛经的相关性研究
2022-03-05朱雨婷张炜煜周曙光蒋晓敏
陈 果,朱雨婷 , 姚 慧,张炜煜,周曙光,蒋晓敏
子宫腺肌病(adenomyosis,AM)是一种常见的内膜浸润性疾病[1]。其发病机制复杂,痛经是其典型临床症状之一。随着患者对于生活质量要求的逐步提高,AM在治疗及管理过程遇到较大的困难[2]。瞬时受体电位香草酸亚型1(transient receptor potentialvanilloid type1,TRPV 1)是瞬态电压感受器 (transient receptor potential,TRP) 阳离子通道家族中被研究最多的成员之一[3],现有的研究[4]为TRPV1介导痛觉感受器产生动作电位、参与疼痛的调节机制以及痛觉敏化奠定了基础。Ma et al[5]研究显示TRPV 1在前列腺素相关炎性疼痛的产生起重要作用。Brenner et al[6]研究表明,催产素(oxytocin, OT)直接作用于子宫内膜上的OT受体(oxytocin receptor, OTR),进而诱导内膜合成前列腺素(prostaglandin, PGs)。OTR已被证明在子宫内膜异位症的平滑肌和上皮细胞中过表达,表明它可能参与子宫内膜异位症的发生[7]。该实验通过检测AM在位/异位内膜中TRPV 1和OTR的定位和表达情况,探讨TRPV 1和OTR是否在AM痛经机制中发挥相互作用,以期为AM痛经的治疗寻找新的治疗靶点。
1 材料与方法
1.1 材料
1.1.1病例资料 本研究实验组选取2019年1月-2020年12月在妇科就诊的60例行子宫切除术或子宫腺肌瘤行腺肌瘤病灶挖除术的子宫腺肌病患者进行回顾性研究。术前经阴道超声或MRI诊断,术后经病理组织学证实。子宫切除及腺肌瘤病灶挖除术后收集所有患者的子宫内膜组织样本,连同其同源异位的子宫内膜组织样本,无菌条件下剪取一部分组织放于液氮中快速冻存用于提取蛋白,另选取一部分组织样本经10%的福尔马林固定后用于免疫组化。对照组取手术诊断子宫平滑肌瘤通过刮宫术或子宫切除术时获取的子宫内膜组织样本30例,对照组患者均无子宫内膜异位症相关痛经及其他症状。
实验组和对照组的所有患者均为绝经前女性(排除患有生殖道感染、内分泌、免疫及代谢性疾病的女性),月经周期正常(21~35 d),其中实验组依据术前检查、术中所见及术后病理排除盆腔及卵巢子宫内膜异位囊肿,对照组排除原发性痛经史患者。在手术或组织收集前6个月未使用激素治疗或放置宫内节育器。所有子宫内膜标本均为增殖期。
两组临床资料分析包括:患者年龄、孕产次、痛经严重程度、经期持续时间、月经量。月经量采用月经失血图法(PBAC)依据卫生巾浸湿程度分为三度[8]。轻度:浸湿面积超过3/5的卫生巾最多2张;中度:浸湿面积超过3/5的卫生巾3~4张;重度:浸湿面积超过3/5的卫生巾至少5张。其中浸湿面积小于3/5的卫生巾张数换算成浸湿面积超过3/5的卫生巾张数。痛经的严重程度依据视觉模拟评分法(VAS)分为四级:0 分为无痛;1~4分为轻度(疼痛但不干扰日常生活或工作,不需要镇痛药),5~7分为中度(疼痛在一定程度上干扰日常生活或工作,服用镇痛药后可减轻疼痛),8~10分为重度(疼痛严重干扰日常生活或工作,服用镇痛药后不减轻疼痛)。所有标本取材均取得患者知情同意,并通过本院机构伦理审查委员会批准(伦理编号:YYLL2019-2019xkj173-01-01)。
1.1.2主要试剂 TRPV 1兔多克隆抗体(ab3487)(美国Abcam公司)、OTR兔多克隆抗( 230045-1-ap) (武汉三鹰生物公司); HRP标记山羊抗兔二抗、ECL发光试剂盒、RIPA裂解液、GAPDH、免疫组化试剂盒、TRPV 1、OTR引物序列(武汉赛维尔生物科技有限公司)、PVDF膜(上海Millipore公司)。
1.1.3主要仪器 高速冷冻型微量离心机(上海力新仪器公司)、正置光学显微镜及成像系统(日本Nikon公司)、Rayto酶标检测仪(济南星辉生物仪器公司)、生物安全柜、电泳仪(北京六一仪器厂)、多功能PCR仪(美国ABI公司)。
1.2 方法
1.2.1免疫组化 收集异位内膜(ectopic endometrium,EC),同源在位内膜(eutopic endometrium,EU)以及对照组子宫内膜组织(control endometrium,CE)制成石蜡切片经脱蜡、抗原修复、封闭后加入一抗:OTR抗体和TRPV 1多克隆抗体,4℃孵育过夜,加HRP标记山羊抗兔二抗室温孵育50 min,滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,苏木精复染细胞核后脱水封片。用使用Image Pro-Plus 6.0数字图像对各组织样本中OTR 、TRPV 1染色进行分析,分别计算阳性细胞百分率及H-score评分,比较各组间免疫反应性差异。
1.2.2Western blot检测蛋白的表达 分别定量检测EC、EU、CE组内膜组织中蛋白表达水平,组织剪碎后加入RIPA裂解液,充分裂解后加入PMSF至最终浓度为1 mmol/L配制成组织匀浆液,BCA法测蛋白浓度,按10 μl /孔的量加样、电泳、转膜。转膜后,稀释一抗,OTR及TRPV 1抗体分别参考抗体说明书进行操作,将二抗用TBST稀释,洗膜,最后用ECL显影、定影试剂进行显影和定影,以GAPDH为内参,Alpha软件处理系统分析目标带的吸光度值,分析各指标的相对表达量。
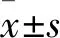
2 结果
2.1 临床资料观察实验组和对照组年龄、孕产次、经期长度、痛经严重程度、及月经量等临床特征。两组在年龄、孕次、产次、经期长度以及经量方面差异无统计学意义,在痛经程度上差异有统计学意义(P<0.05)。见表1。
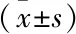
表1 两组一般临床资料比较
2.2 CE、EU、EC组内膜组织TRPV 1、OTR免疫组化表达EU、EC组与CE组内膜组织一样,TRPV 1和OTR染色多数在细胞质中可见,上皮染色比间质染色更强,其中EC组子宫腺肌病灶的肌层和血管内皮细胞中染色可见,免疫组化结果显示TRPV 1、OTR在EC组表达水平均高于EU、CE组,差异有统计学意义(P<0.05),而EU组与CE组之间差异无统计学意义。见图1、图2、表2 。
2.3 CE、EU、和EC组TRPV 1、OTR的Western blot分析将实验组按不同痛经程度分组与对照组的TRPV 1、OTR蛋白进行定量分析,见图3。结果显示TRPV 1在EC组表达水平高于EU、CE组,差异有统计学意义(P<0.05),而EU组与CE组之间差异无统计学意义。OTR在EC组表达水平高于EU、CE组,差异有统计学意义(P<0.05),而EU组与CE组之间差异无统计学意义。见图4、表3。将EC组按照不同痛经程度(轻度、中度、重度)分组分析显示,重度痛经组的TRPV 1蛋白表达水平高于轻度痛经组和中度痛经组,差异有统计学意义(P<0.05),而轻度与中度痛经组之间差异无统计学意义。重度痛经组OTR蛋白表达水平高于轻度痛经组和中度痛经组,差异有统计学意义(P<0.05),而轻度与中度痛经组之间差异无统计学意义。见图5、表4。
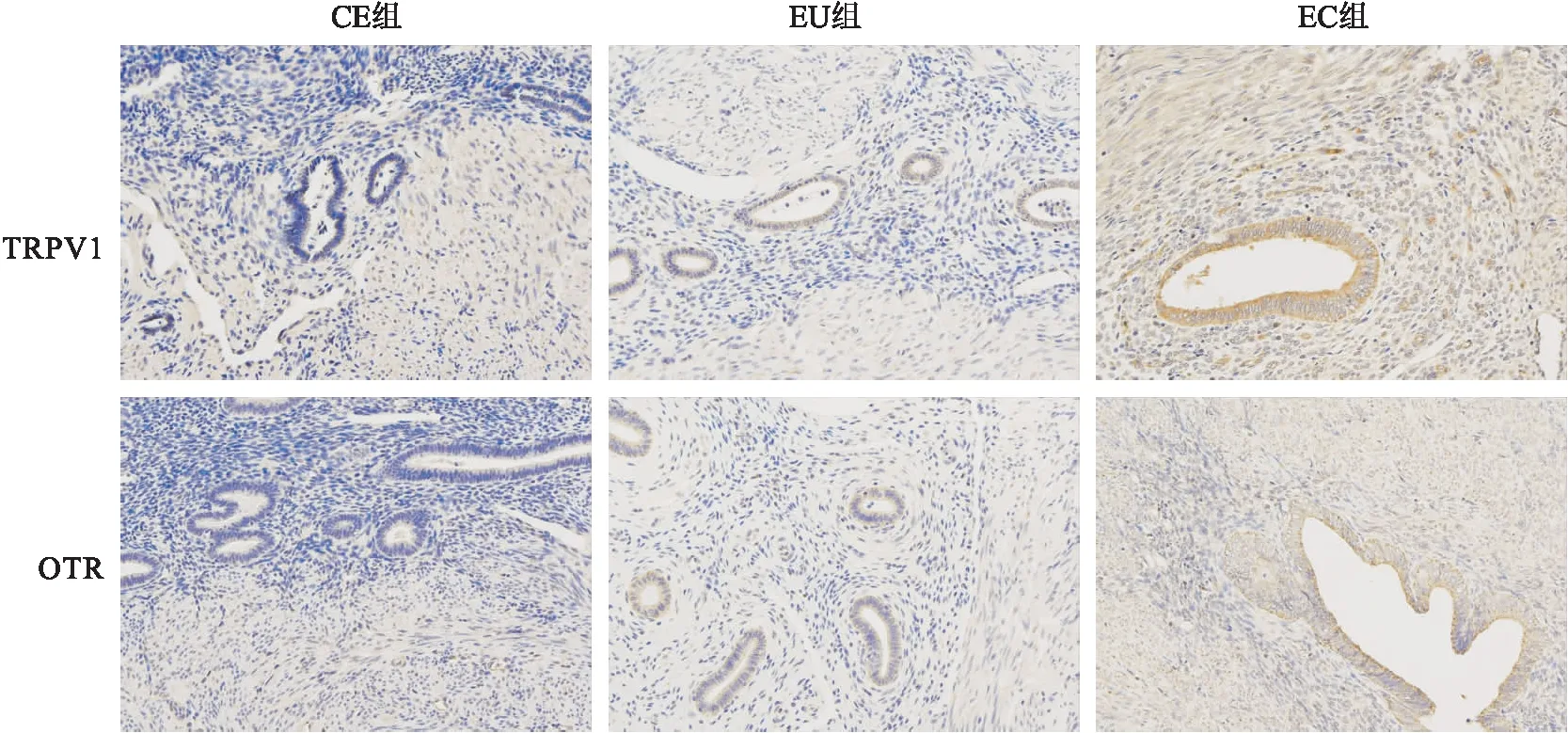
图1 TRPV 1和OTR在CE、EU、EC组内膜组织中的免疫组化表达情况 ×200
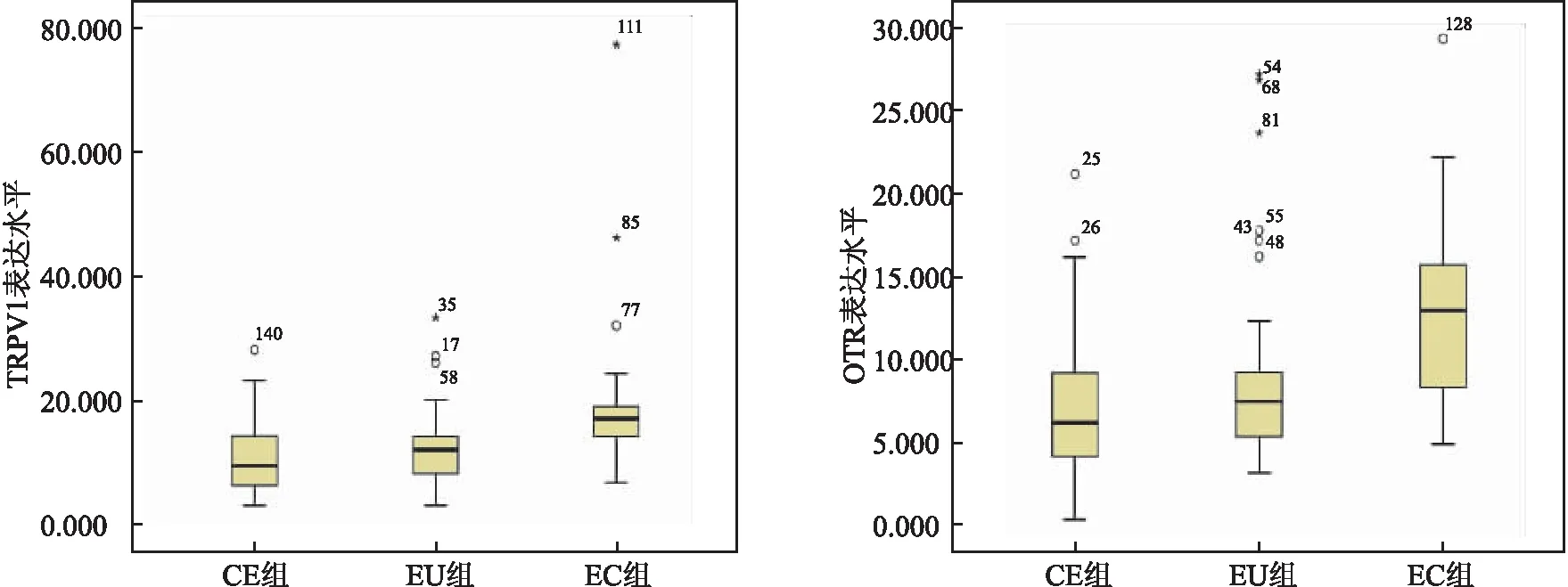
图2 TRPV 1和OTR在CE、EU、EC组内膜组织中的免疫组化水平(H-score)
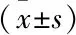
表2 CE、EU、EC组TRPV 1和OTR的在免疫组化中表达水平
图3 Western blot检测TRPV 1、OTR蛋白表达情况
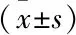
表3 CE、EU、EC组TRPV 1和OTR的蛋白表达水平

表4 EC组不同痛经程度TRPV 1和OTR的表达水平
图4 CE、EU和EC组内膜组织TRPV 1、OTR的蛋白表达情况

图5 EC组不同痛经程度TRPV 1、OTR蛋白的相对表达
2.4 EC组内膜组织中TRPV 1和OTR表达的相关性分析进一步进行相关性分析显示EC组内膜组织中TRPV 1、OTR的表达均与痛经程度呈正相关(rs=0.280,P=0.030;rs=0.318,P=0.013),TRPV 1与OTR的表达呈正相关(rs=0.287,P=0.026)。
3 讨论
流行病学研究表明AM流行率较高,且呈年轻化趋势[9],部分研究统计,AM的痛经率高达64.8%~77.8%[10]。某些重度痛经患者子宫切除仍作为其最终选择[11-12]。面对趋于年轻化的患者临床医师亟待新的治疗方法出现。
目前研究认为,AM引起的继发性痛经与子宫平滑肌、血管的痉挛性收缩有关。Brenner et al[6]研究显示,PGs和OT均可使子宫的平滑肌、血管发生不规则收缩,OT作用于子宫内膜上的OTR,结合后启动磷酸肌醇-蛋白激酶C-花生四烯酸途径,诱导内膜合成PGs,随后迅速转移至胞外以旁分泌的形式与受体结合后刺激子宫平滑肌及血管收缩,造成子宫乏氧微环境导致多种致痛因子产生,大量致痛因子可促进外周神经敏化、神经纤维分布异常增加,引起痛经。本研究发现在异位子宫内膜上皮细胞和间质细胞中,以及异位内膜侵袭病灶的肌层和血管内皮细胞中,OTR表达均增加。并且数据分析显示OTR在异位内膜的表达水平与痛经的严重程度呈正相关。
已有许多研究指出,外周神经敏化是导致内脏疼痛致敏的重要环节,导致外周神经兴奋阈值降低的分子可能在神经敏化中起到重要作用,Nie et al[13]通过免疫组化检测发现TRPV 1在AM异位内膜组织的表达水平显著升高。TRPV 1受炎症敏化后其激活阈值显著降低,产生痛觉过敏和疼痛超敏反应。TRPV 1在动物模型中已被证明在周围终末或初级感觉神经元上整合多种刺激,如热(43 ℃), 酸(pH>5.9)和炎性介质,TRPV 1的激活也会导致感觉肽的局部释放,从而激活器效应细胞受体,促进神经性炎症的发生。在前列腺素存在下,TRPV 1 激活的温度阈值降低到 35℃以下,使得TRPV 1 在正常体温下可以被激活,诱导自发性疼痛[5]。本次实验通过Western blot检测显示TRPV 1在AM的异位内膜组织过高表达,且与痛经程度呈正相关,因此TRPV 1可能是重要治疗靶点。
研究者推测痛经的发生机制:①可能与子宫收缩障碍有关,子宫结合带的收缩依赖于OT[14],由OTR介导的OT促进子宫内膜细胞释放PGs。PGs的大量释放使得TRPV 1在正常体温下即被激活,诱发疼痛;②史精华 等[15]发现子宫内膜异位病灶中的神经纤维密度增加。TRPV 1作为传入神经纤维上表达的重要离子通道,通过和炎性介质的相互作用,从多个方面参与了盆腔痛的发生。TRPV 1通过蛋白激酶A(PKA)和蛋白激酶C(PKC)介导,形成一条PKA/C-PGs-TRPV 1的疼痛信号通路。TRPV 1被敏化之后,反过来又会刺激外周伤害性感受器,转变成神经冲动信号传递至中枢神经系统,痛觉程度再次加剧,由此形成疼痛的级联放大效应[16]。本次研究通过免疫组化及Western blot检测发现,异位内膜组织的TRPV 1、OTR均高于对照组,且随着痛经程度的加重其表达量亦呈正相关。因此研究者推测OTR及TRPV 1协同参与了子宫腺肌病痛经的机制。
子宫腺肌病的继发痛经严重影响女性身心健康,一直是临床研究的热点问题,本次研究结果显示OTR及TRPV 1表达在异位内膜组织中显著升高,且与痛经程度呈正相关。OTR及TRPV 1的拮抗剂可能是未来研究治疗子宫腺肌症患者痛经和慢性盆腔疼痛的潜在靶点。但本课题研究结果仅局限于组织水平,今后可以通过体外实验建立细胞或动物模型探索TRPV 1配体受体识别过程、信号通路调控机制以及下游趋化因子表达情况等,以便更深入的探讨子宫腺肌病痛经的发生机制,为探究子宫腺肌病的治疗策略提供新的思路。
