右美托咪定对心肌缺血再灌注所致脑损伤的影响
2022-03-05吴科帆张爱宁季烨龙夏中元
吴科帆,张爱宁,季烨龙,张 艺,江 梦,夏中元
心肌缺血再灌注(ischemia reperfusion,IR)是治疗心肌梗死的主要方法,同时也是加重心肌损伤的机制之一。虽然它可以提供心肌有氧代谢所必需的氧气和营养物质,但血流的重建和恢复可以对心肌产生更严重的打击,称为缺血再灌注损伤(ischemia reperfusion injury,IRI)[1]。研究[2]表明IRI可导致细胞内离子堆积、线粒体膜损伤、活性氧形成、一氧化氮代谢紊乱、内皮功能障碍、血小板聚集、免疫激活、细胞凋亡和自噬等多种病理生理过程。大脑作为人体生命中枢器官,虽有血脑屏障的保护,仍易由于体内血液再分布而遭受侵袭,导致IRI后的继发性脑损伤[3]。右美托咪定(dexmedetomidine,Dex)是一种高选择性的α2-肾上腺素能受体激动剂,对心脏、肾脏等器官的缺血再灌注损伤有保护作用。已有研究[4-6]证实Dex可通过抑制内质网应激和炎症反应等途径减轻糖尿病大鼠脑损伤。该研究拟观察右美托咪定预处理对心肌缺血再灌注所致脑损伤的影响,并探究其与全身炎症反应及内质网应激的关系。
1 材料与方法
1.1 实验材料与仪器SD大鼠购自北京维通利华实验技术有限公司。右美托咪定购自江苏恒瑞医药股份有限公司(批号:14030332)。CCAAT-增强子结合蛋白同源蛋白(CCAAT-enhancer-bindingproteinhomologousprotein,Chop)、免疫球蛋白结合蛋白(bindingimmunoglobulinprotein,Bip)一抗购自美国Abcam公司,磷酸化真核生物起始因子2(phosphorylated-αsubunit of eukaryotic initiation factor 2,p-eif-2α)、磷酸化蛋白激酶RNA样内质网激酶(phosphorylated proteinkinase RNA-likeendoplasmicreticulumkinase,p-perk)一抗购自美国CST公司,荧光二抗购自美国LI-COR公司。DW-2000型小动物呼吸机购自上海嘉鹏科技有限公司,BX50型光学显微镜购自日本Olympus公司,ELISA试剂盒购自南京建成生物工程研究所,Odyssey双色红外激光扫描显影仪购自美国LI-COR公司。
1.2 实验分组与处理SPF级健康雄性SD大鼠24只,体质量200~220 g,6~8周龄,采用随机数字表法分为3组,每组8只:假手术组(S组)、心肌缺血再灌注组(IR组)、心肌缺血再灌注+右美托咪定组(IR+Dex组)。于标准SPF级环境进行适应性饲养1周,术前禁食12 h。大鼠腹腔注射2%戊巴比妥钠进行麻醉并固定,同时进行心电监测。S组只穿线,不结扎LAD。IR+DEX组于再灌注开始时给予IR+Dex组静脉注射右美托咪定25 μg/kg,S组和IR组静脉注射等容量0.9%氯化钠溶液。将大鼠气管切开行气管插管术,连接小动物呼吸机进行机械通气。开胸暴露大鼠心脏,用7-0带线缝针结扎冠状动脉左前降支(LAD)30 min,肉眼观察心尖部变白,室壁运动减弱,同时心电监测出现明显ST段背向上抬高,认为心肌缺血再灌注模型造模成功。松开线结可见心电图ST段回落,心尖部恢复红润,表明再灌注成功,再灌注120 min后即刻经颈动脉采集血样,断头处死大鼠取脑组织。
1.3 观察指标以及检测方法
1.3.1HE染色观察大鼠脑组织病理结果 再灌注120 min后取脑组织,石蜡包埋后于切片机切片,置于4%多聚甲醛液固定24 h,HE染色后于光镜下观察病理结果。
1.3.2ELISA法检测血清炎性因子IL-6、IL-8、IL-10 再灌注120 min后即刻经颈动脉采集血样,于4 ℃下2 000 r/min离心15 min,离心半径8.6 cm,取上清液,使用ELISA试剂盒测定血清IL-6、IL-8和IL-10水平,操作过程严格按照试剂盒说明进行。
1.3.3Western blot法测定大鼠海马组织中Chop、Bip、p-eif-2α和p-perk的表达水平 取大鼠海马组织,置于冰上加入RIPA裂解液裂解30 min,冰浴电动匀浆,4 ℃下12 000 r/min离心20 min,离心半径8.6 cm,取上清液于-20 ℃冻存。采用BCA法测定蛋白浓度。加入5×上样缓冲液并混匀煮沸10 min,行PAGE凝胶电泳,后转移至PVDF膜上,5%脱脂奶粉室温封闭1 h;加入Chop一抗(稀释度1 ∶1 000)、Bip一抗(稀释度1 ∶1 000)、p-eif-2α一抗(稀释度1 ∶1 000)和p-perk一抗(稀释度1 ∶1 000),4 ℃下摇床孵育过夜。TBST洗涤3次, 10 min/次,加入荧光二抗(稀释度1 ∶10 000)室温孵育1 h。TBST洗涤3次,10 min/次。红外成像显影仪扫描分析荧光蛋白条带,测定各目的蛋白条带灰度值。用GAPDH作为内参,以目的蛋白条带灰度值与GAPDH条带灰度值的比值表示目的蛋白的表达水平。
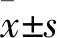
2 结果
2.1 心肌缺血再灌注后脑组织病理切片观察光镜下,S组可见神经元清晰排列,胞质丰富,核圆形,碱染呈蓝色,结构较为清晰,未见明显异常。IR组神经元病理损伤较重,形态不规则,胞质分布不均,有空泡,核固缩、溶解或消失,细胞结构被破坏,核染色不均匀,呈淡红色。IR+Dex组中,神经元损伤减轻,大多数胞膜完整,核仁清晰可见。见图1。
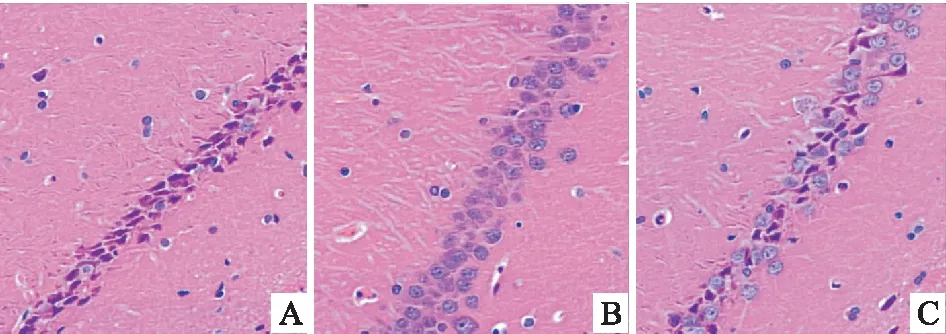
图1 三组大鼠海马组织病理学结果 HE ×40
2.2 ELISA检测心肌缺血再灌注后血清炎性因子与S组比较,IR组和IR+Dex组血清炎性因子IL-6、IL-8表达均增加(P<0.05),IL-10的表达减少(P<0.05)。与IR组比较,IR+Dex组IL-6、IL-8表达有所下调(P<0.05),而IL-10的表达增加(P<0.05)。见表1。
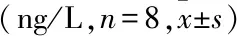
表1 3组大鼠血清炎性因子IL-6、IL-8和IL-10水平的比较
2.3 心肌缺血再灌注后大鼠海马组织中Chop、Bip、p-eif-2α和p-perk的表达与S组比较,IR组和IR+Dex组大鼠海马组织中Chop、Bip、p-eif-2α和p-perk蛋白表达水平均上调(P<0.05)。与IR组比较,进行了右美托咪定预处理后的心肌缺血再灌注后的大鼠海马组织中Chop、Bip、p-eif-2α和p-perk的表达有所下调(P<0.05)。见表2、图2。
3 讨论
该研究参照文献[7]制备大鼠心肌缺血再灌注损伤模型,即于气管插管后结扎LAD 30 min,解除结扎后再灌注120 min。结果显示,与S组比较,IR组大鼠脑组织中神经元出现病理损伤,细胞结构遭到破坏,提示心肌缺血再灌注诱发了大鼠脑损伤。该研究参照文献[8]于再灌注开始时给予IR+Dex组25 μg/kg右美托咪定,S组和IR组注射等容量0.9%氧化钠溶液。结果显示,与IR组比较,IR+Dex组脑组织病理学损伤减轻,细胞镜下无明显损伤,提示右美托咪定预处理减轻了心肌缺血再灌注所致的大鼠脑损伤。
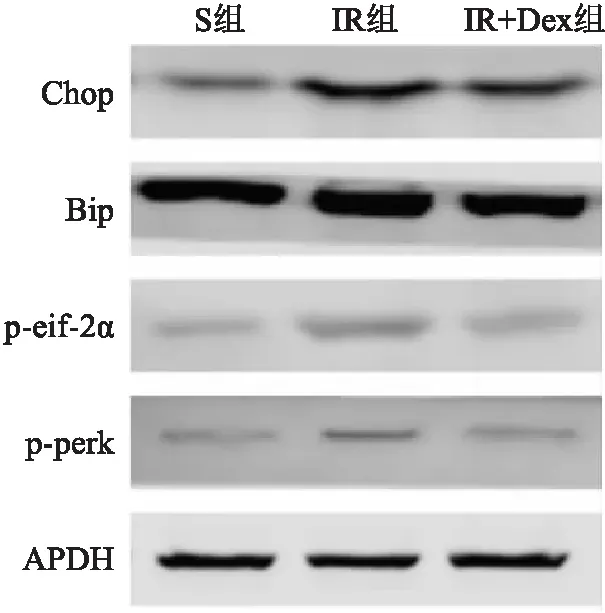
图2 3组大鼠海马组织Chop、Bip、p-eif-2α和p-perk的Western blot表达条带
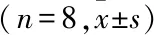
表2 3组大鼠海马组织中Chop、Bip、p-eif-2α和p-perk/GADPH表达的比较
再灌注引发的炎症反应是心肌再灌注缺血损伤的重要环节。在炎症应答机制中,许多细胞因子如IL-6、IL-8等被释放[9],而抗炎因子IL-10被大量消耗[10]。ELISA结果显示,与S组比较,IR组和IR+Dex组IL-6、IL-8表达增加,IL-10表达减少;与IR组比较,IR+Dex组IL-6、IL-8表达下调,而IL-10表达增加。提示心肌缺血再灌注引发的炎症反应使血液中炎性介质通过机体内的血液再分布进入脑组织并导致相应损伤,而右美托咪定预处理可通过抑制全身炎症反应减轻脑组织损伤。
内质网应激是指细胞内质网内稳态失衡导致细胞生理功能发生改变的一种病理反应,是由于各种病理和生理事件导致未折叠或错误折叠的蛋白质的积累加速的状态[11]。蛋白激酶RNA样内质网激酶PERK是位于内质网膜上的一种I型跨膜蛋白,属于真核生物起始因子2上游激酶家族中的一种。内质网应激早期,通过Bip免疫球蛋白结合蛋白Bip在上游激活PERK信号通路抑制蛋白质的合成,对细胞起保护作用、促进细胞生存。随着内质网应激时间的延长,PERK通过诱导Chop的表达而促进细胞凋亡。PERK信号途径在中枢神经系统损伤、缺血再灌注损伤及代谢异常等病理过程中发挥着重要的作用[12-13]。内质网应激作为介导脑缺血众多反应的复杂机制,与缺血后神经元细胞死亡有关[14]。心肌发生缺血再灌注时,心肌的缺血低氧继发了脑组织的缺血低氧,神经元出现能量代谢障碍诱发内质网应激,再灌注后脑组织血流恢复,血液中产生的各种离子、介质加重内质网应激[15]。Western blot结果显示,与S组比较,IR组和IR+Dex组大鼠海马组织中Chop、Bip、p-eif-2α和p-perk蛋白表达上调;与IR组比较,IR+Dex组海马组织中Chop、Bip、p-eif-2α和p-perk的表达下调,提示右美托咪定预处理可能通过抑制内质网应激减轻大鼠心肌缺血再灌注所致脑损伤。
综上所述,右美托咪定预处理可减轻心肌缺血再灌注所致的脑损伤,其机制可能与减轻全身炎症反应、抑制内质网应激有关。
