冠心病心外膜脂肪组织中KLF7促进炎症反应及脂肪分化成熟
2022-03-05薛亚军黄文华杜雅彦周奕君董星星魏育涛
薛亚军,黄文华,杜雅彦,3,周奕君,董星星,魏育涛,4
心脏周围脂肪堆积是公认的易引起冠心病(coronary artery disease, CAD)、心房纤颤和心力衰竭等心血管疾病(cardiovascular disease,CVD)的危险因素[1-2]。心外膜脂肪组织(epicardial adipose tissue, EAT)与心肌组织共享冠脉血供[3-4]。巨噬细胞在CAD患者EAT组织中表现出M1极化和分泌大量炎症因子。EAT能促进CAD发生发展,EAT有望作为诊断和治疗CAD的靶标[1,5-6]。
Kruppel样因子(Kruppel-like factors, KLFs)属于锌指转录因子家族[7],其在基因表达和调控中发挥着不同作用[8]。其中KLF7可调节脂肪细胞的分化和脂肪细胞因子分泌[9-10]。但是,KLF7在CAD患者EAT炎症中的作用尚未见报道。该研究通过体内及体外细胞实验观察KLF7对脂肪细胞分化的作用,旨在探讨KLF7在CAD的发生发展中的作用,为阐明CAD发生发展的分子机制提供初步理论依据。
1 材料与方法
1.1 病例资料本研究纳入2018年1月-2019年10月在石河子大学医学院第一附属医院心胸外科行非体外循环冠状动脉搭桥术(coronary artery bypass grafting,CABG)的30例CAD患者。其余30例行房间隔缺损修复或瓣膜置换手术而无冠状动脉狭窄的患者作为对照组,患者资料列于表1。
1.1.1诊断标准 参照我国卫生部发布的《冠状动脉粥样硬化性心脏病的诊断标准》(2010年版)以及2011年美国心脏联合会(American Heart Association,AHA)冠心病诊疗指南。
1.1.2纳入标准 实验组:① 年龄 40~75(63.8±4.2)岁 ;② 符合CAD的诊断标准需行CABG患者;③ 民族为汉族。对照组:① 年龄在40~75(66.5±7.3)岁;② 冠状动脉造影阴性且需行瓣膜置换手术(瓣膜为退行性变)患者;③ 民族为汉族。
1.1.3排除标准 ① 合并有糖尿病或糖耐量异常者;② 其他类型心脏病,如风湿性心脏病患者;③ 患有恶性肿瘤者;④ 近期有创伤、外科手术者;⑤ 急、慢性感染者;⑥ 长期肝、肾等脏器疾病及其它内分泌疾病。
1.2 仪器与试剂人单核细胞THP-1细胞和3T3-L1前脂肪细胞均购自中国科学院细胞库(上海)。RNA提取试剂和qRT-PCR 反应试剂盒购自TaKaRa 公司(日本)。Western blot试剂盒购自美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1临床资料 包括患者年龄、性别、身高、体质量、病程、大生化、心肌酶、超敏C反应蛋白、心脏彩超及颈动脉彩超等。
1.3.2样本采集 麻醉后1 h,从左心室前壁(与患病段相邻)收集EAT双眼样品(平均重量0.5~1.0 g)。将所有样品立即保存在RNA稳定剂中,然后转移至-80 ℃,用于后续实验。本研究符合石河子大学医学院一附院医学伦理委员会程序并通过审批(编号:2014-072-01),所有研究对象均签署知情同意书。
1.3.3细胞培养 在含有10%FBS(美国Gibco公司),青霉素(100 μg/ml)和链霉素(100 μg/ml)的Roswell Park Memorial Institute-1640(RPMI-1640)培养基(美国HyClone公司)中培养THP-1细胞及3T3-L1前脂肪细胞,在高糖培养基中培养3T3-L1前脂肪细胞,培养环境为37 ℃的含5%CO2的湿润培养箱。将THP-1细胞以2×105个/孔细胞的密度接种在12孔板中,并使用100 μg/ml phorbol-12-肉豆蔻酸酯13-乙酸酯(美国Invitrogen公司)持续培养24 h。然后将细胞与20 ng/ml 干扰素-γ(interferon-gamma,IFN-γ)(美国Gibco公司)和10 ng/ml LPS(美国Sigma-Aldrich公司)孵育24 h以诱导M1巨噬细胞。
1.3.4qRT-PCR检测相关因子 根据制造商的说明书,使用TRIzol(美国赛默飞世尔科技公司)提取CAD EAT,非CAD EAT和实验细胞组的总RNA。使用NanoDrop 1000分光光度计(美国Thermo Fisher Scientific公司)测量RNA的纯度和浓度。使用带有基因组脱氧核糖核酸(gDNA)(美国TaKaRa Bio公司)的PrimeS-cript RT试剂盒进行逆转录,每个样品分离出500 ng总RNA。使用7500实时PCR系统(美国Applied Biosystems公司)及QuantiNova SYBR Green PCR试剂盒(德国Qiagen公司)进行定量实时PCR(qRT-PCR)。EAT中KLF7、APN、IL-6、TNF-α mRNA表达水平,M1型巨噬细胞中APN、MCP-1、IL-6和TNF-α mRNA的表达,以及3T3-L1前脂肪细胞中APN、KLF4、IL-6、MCP-1 mRNA及脂肪细胞分化标志物PPARγ、C/EBPα、FABP4,表1列出了引物序列。所有实验均重复3次。使用比较循环时间法计算靶基因转录物的相对量。通过比较临界阈值方法计算每个组织和对照样品的相对表达水平。
1.3.5Western blot检测相关因子蛋白表达 将30~50 μg的总蛋白质在100℃下加热10 min,使用10%凝胶上的SDS-PAGE分离,然后转移至聚偏二氟乙烯膜上。遵循一抗通过与缀合有HRP的适当的二抗孵育并通过使用Pierce Fast.Western Blot Kit(美国Thermo Fisher Scientific公司)检测。该研究中使用的抗体是β-肌动蛋白(ZSGBBIO,CHINA)KLF7(美国Abcam公司),检测两组中KLF7、NF-κB信号通路关键因子以及脂肪分化细胞标志因子蛋白表达水平。
1.3.6KLF7小干扰RNA(siRNA)的转染 siRNA由Gene-Pharma(上海)设计和合成。按照说明书将KLF7 siRNA或阴性对照通过Lipofectamine 2000(美国Invitrogen公司)转染。24 h后通过qRT-PCR评估转染的KLF7 siRNA的水平来验证转染。表1列出了本研究中使用的siRNA序列。
2 结果
2.1 两组一般资料和生化指标两组年龄、体质量指数(body mass index,BMI)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)、总胆固醇(Total cholesterol,TC)以及甘油三酯(triglycerides,TG)等差异无统计学意义,但超敏C反应蛋白CAD组较non-CAD组升高,脂联素(Adiponectin,APN)降低(P<0.05)(表2)。
2.2 KLF7在CAD患者EAT中的表达水平检测KLF7 mRNA在实验组和对照组EAT中的表达(P<0.001),见图1A。通过Western blot验证KLF7蛋白表达(P<0.05),见图1B。
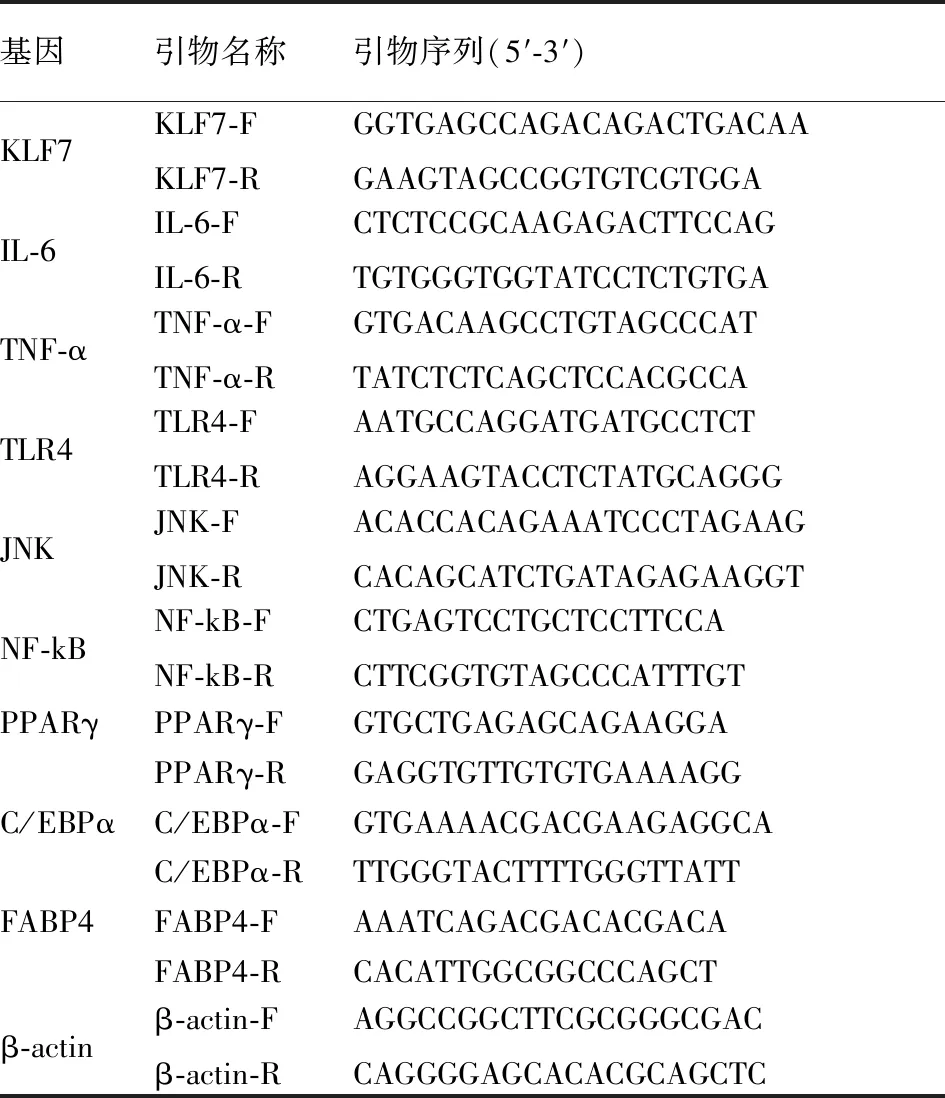
表1 实验相关引物序列列表
表2 两组一般资料和生化指标
2.3 EAT炎症信号通路关键基因mRNA表达水平在EAT中,CAD组APN表达水平低于non-CAD组,IL-6、TNF-α、JNK和NF-κB mRNA表达水平高于non-CAD组(P<0.05),见图2。
2.4 EAT中的巨噬细胞的鉴别为了确定巨噬细胞类型在EAT炎症过程中的重要性,使用炎性细胞标记CD68来检测巨噬细胞的存在。CAD患者EAT中CD68的mRNA水平高于non-CAD组(图3)。
2.5 KLF7在人类THP-1衍生的巨噬细胞中高表达并由炎症刺激诱导课题组用特定的KLF7 siRNA(siRNA 1-2)或si-NC瞬时转染THP-1衍生的M1型巨噬细胞。如图4A所示,与si-NC相比,si-KLF7-1和si-KLF7-2能够降低KLF7的表达,si-KLF7-2组最低。为了验证KLF7 mRNA的转染效率,测定在转染相同量si-KLF7由THP-1衍生的M1型巨噬细胞裂解物中KLF7的蛋白表达。结果与本研究在mRNA水平上显示的结果相同(图4B)。LPS以时间依赖和剂量依赖的方式影响KLF7 mRNA的表达(图4C、D)。LPS以时间依赖性和剂量依赖性方式进一步诱导KLF7的表达(图4E)。KLF7在人类THP-1衍生的巨噬细胞中高表达,并在体外由炎性刺激诱导,这表明它可能调控这些刺激巨噬细胞激活的相关因子。
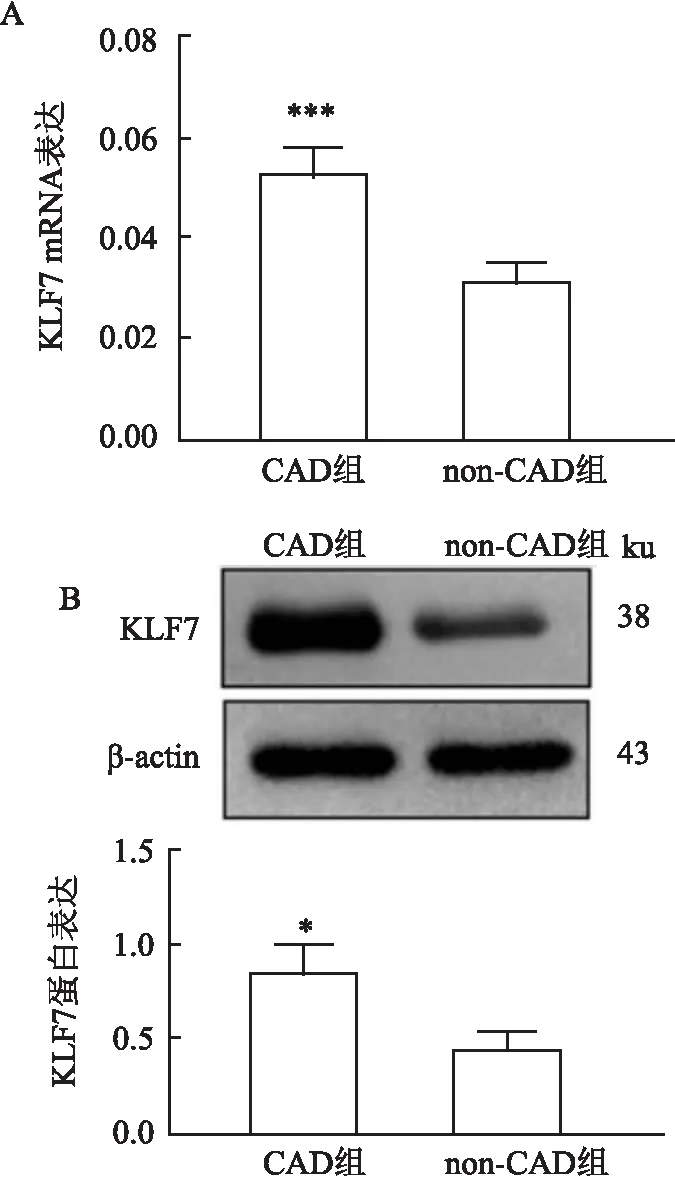
图1 KLF7在两组EAT中的表达
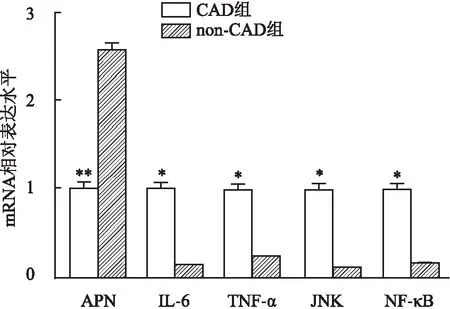
图2 炎症信号通路关键基因mRNA表达差异
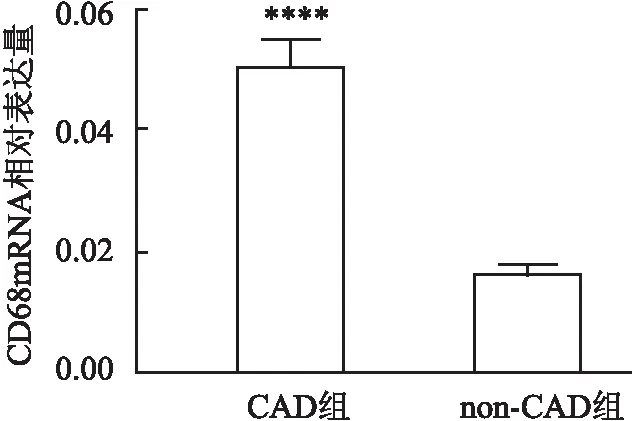
图3 EAT中巨噬细胞CD68的表达与non-CAD组比较:****P<0.000 1
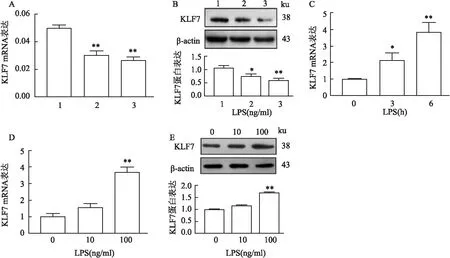
图4 KLF7在THP-1衍生的M1型巨噬细胞中的表达
2.6 KLF7促进脂肪细胞分化成熟分别将KLF7模拟物和NC(对照组)转染到3T3-L1前脂肪细胞中,于转染后每天检测FLF7表达,其表达趋势见图5A。转染处理24 h后检测APN、IL-6、MCP-1 mRNA及脂肪细胞分化标志物过氧化物酶体增殖物激活受体-γ(PPARγ)、CCAAT/增强子结合蛋白α(C/EBPα)、脂肪酸结合蛋白4(FABP4)mRNA的相对表达水平,显示KLF7模拟物组中APN表达降低,IL-6、MCP-1、PPARγ、C/EBPα和FABP4表达升高(P<0.05)(图5B)。
3 讨论
CAD在世界范围内发病率很高。CAD可导致心肌缺血、心肌梗塞、心力衰竭、并最终导致死亡。CAD是一种严重的慢性疾病,其特征是冠状动脉进行性动脉粥样硬化闭塞,导致心肌供需之间不匹配[11]。动脉粥样硬化被描述为中型动脉内膜的低度炎症状态,可因为众所周知的危险因素(例如高血压、糖尿病、肥胖症和血脂异常)而产生。EAT被认为是一种在心包内的异位脂肪[12]。EAT分泌的脂肪因子可以直接从血管周围脂肪扩散到血管内膜,引起炎症发生,最终发展为动脉粥样硬化[13]。脂肪组织驻留的免疫细胞几乎包括所有类型的免疫细胞,即巨噬细胞、B细胞、T细胞、嗜中性粒细胞、嗜酸性粒细胞和肥大细胞。
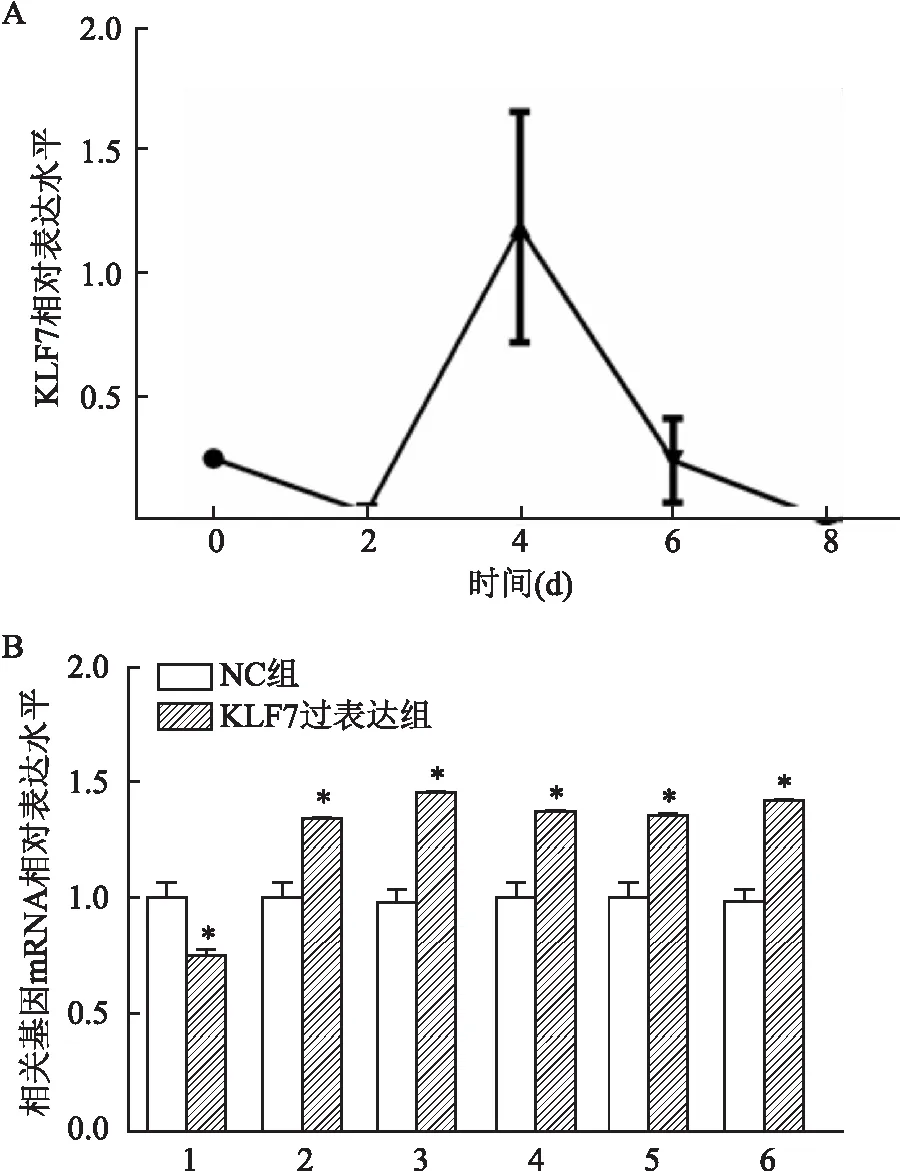
图5 KLF7促进脂肪细胞分化成熟
Kruppel样因子(Kruppel-like factors, KLFs)属于锌指转录因子家族,KLFs可调节哺乳动物组织中的多种生物过程,包括细胞增殖、分化、存活以及组织发育[14]。KLFs还控制免疫细胞的功能,例如巨噬细胞,它们参与了心血管疾病和代谢疾病的炎症过程。本课题组前期研究发现,CAD患者EAT组织中miR-455b-3p通过下调APN的表达从而促进EAT炎症因子释放。本研究显示,CAD患者EAT组织中KLF7 mRNA和蛋白表达水平高于non-CAD组,炎症相关因子TNF-α、IL-6 JNK、NF-κB mRNA表达水平也高于non-CAD组,而具有抗炎作用的APN却低于non-CAD组,以上结果提示炎症状态与KLF7的表达水平相关。本研究进一步通过体外培养诱导人类THP-1衍生的巨噬细胞,显示LPS以时间依赖性和剂量依赖性方式诱导KLF7的表达。通过体外培养3T3-L1前脂肪细胞,发现KLF7能促进前脂肪细胞分化为成熟的脂肪细胞。EAT在炎症状态下,可能通过影响KLF7的表达,进而引起脂肪组织炎症因子转录激活,促进脂肪细胞分化成熟,但其具体作用机制有待进一步研究加以验证。
