植物提取十八碳二烯酸对人胃癌组织细胞生态毒理学作用机制研究
2022-03-04谢明仁王贤贤俞蕾何天晓谢刘阳俞发荣
谢明仁, 王贤贤, 俞蕾, 何天晓, 谢刘阳, 俞发荣,*
植物提取十八碳二烯酸对人胃癌组织细胞生态毒理学作用机制研究
谢明仁1, 王贤贤1, 俞蕾2, 何天晓1, 谢刘阳1, 俞发荣1,*
1. 甘肃政法大学公安技术学院, 兰州 730070 2. 甘肃政法大学公共管理学院, 兰州 730070
为了探索植物提取十八碳二烯酸对人胃癌组织细胞生态毒理学作用机制, 取胃癌患者肿瘤组织移植到重症联合免疫缺陷(SCID)小鼠皮下, 腹腔注射100、300、900 mg·kg-1植物提取物十八碳二烯酸, 分析对移植瘤生长抑制作用; 用酶联免疫吸附法(ELISA) 检测瘤组织cAMP、P53、PI3K水平。将瘤组织经酶解消化分离出细胞进行培养, 给予胃癌瘤细胞2.0、4.0、8.0 mg·L-1十八碳二烯酸, 用MTT法检测十八碳二烯酸对胃癌瘤细胞生态毒性作用, 用酶联免疫吸附法(ELISA) 检测胃癌瘤细胞中P21、MDM2、PKB/Akt水平。结果发现, 低中高剂量组和5-FU组胃癌移植瘤生长抑制率比模型组升高17.92%—45.75%和35.85%; 胃癌移植瘤cAMP水平比模型组升高14.88%—40.70%和23.21%(<0.05—0.01), P53水平比模型组降低37.94%—63.96%和58.54%(<0.01), PI3K水平比模型组降低20.77%— 52.94%和35.29%(<0.01)。低中高剂量组和5-FU组胃癌活细胞数随给药浓度的增加和作用时间的延长而减少, 细胞增殖抑制率为23.11%—59.66%和51.26%, 半数抑制浓度(IC50)为5.811 mg·L-1; 流式细胞仪检测, G0G1期细胞比对照组增加16.54%—27.51%和20.45%; G2M期细胞比对照组减少36.40%—67.98%和41.67%; 凋亡率为17.44%—23.37%和19.21%; 胃癌瘤细胞 P21水平比对照组升高13.33%—62.81%和52.63%, PKB/Akt水平比对照组降低19.39%—51.02%和46.94%, MDM2水平比对照组升高10.26%—76.92%和33.33%。结果提示, 重症综合性免疫缺乏症(SCID)小鼠肿瘤模型的建立, 为研究人类肿瘤治疗和康复提供了生态毒理学实验对象; 十八碳二烯酸对胃癌移植瘤和瘤细胞增殖具有明显的生态毒性和抑制作用。其机制可能与升高移植瘤细胞cAMP、p21、MDM2水平, 降低P13K、PKB/Akt、P53水平, 抑制细胞分裂周期, 降低PI3K-Akt信号转导通路活性有关。
人胃癌模型; 十八碳二烯酸; 生态毒理学; 重症联合免疫缺陷小鼠
0 前言
近年来, 随着脂肪酸研究的不断深入, 人们已经认识到, 植物提取物不饱和脂肪酸是人体必需的重要的营养物质[1]。研究发现, 饮食中降低饱和脂肪的摄入, 提高不饱和脂肪酸的比例, 能增强肿瘤患者免疫力[2], 降低肿瘤发病率[3], 抑制肿瘤发生、侵袭和转移[4], 提高肿瘤细胞对化疗药物的敏感性[5], 抑制炎症反应[6], 减少并发症, 提高临床疗效, 促进机体的康复[7]。在植物提取物生态毒理学研究方面, Zhong等[8]将二氢青蒿素(DHA)给予胃癌细胞, 通过抑制PI3K-Akt信号转导通路的活化, 使细胞阻滞于G0/G1期, 明显抑制了人SGC-7901细胞的增殖, 提示PI3K-Akt信号转导通路可作为胃癌治疗的潜在靶点[9]。采用PI3K-Akt信号转导通路抑制剂可以逆转肿瘤细胞的耐药性[10]和提高抗肿瘤药物的药效[11], PI3K-Akt信号转导通路被激活时, 促进细胞增殖[12], PI3K-Akt信号转导通路被抑制时, 促进细胞凋亡, 发挥其抑制细胞增殖效应[13]。ZOU等[14]研究发现, 细胞生长或抑制受PI3K-Akt信号转导通路的调节和控制, PI3K-Akt信号转导通路在细胞内发挥重要的作用, 参与了许多生理和毒理活动。研究PI3K-Akt信号转导通路和参与机制及PI3K蛋白表达, 对胃癌诊断治疗和预后判断具有一定的参考价值[15]。十八碳二烯酸属不饱和脂肪酸的一种, 为了探索十八碳二烯酸对人类肿瘤组织细胞生态毒理学作用, 给予荷人胃癌组织的重症联合免疫缺陷(SCID)小鼠, 或给予人胃癌瘤细胞体外培养, 研究其对胃癌瘤组织细胞增殖毒理学作用以及对PI3K-Akt信号通路中相关蛋白表达影响机制。
1 材料与方法
1.1 材料

1.2 方法
1.2.1 人胃癌组织移植
选取8周龄SPF级SCID小鼠10只, 雌雄各半。全部动物在SPF级实验室独立送回风净化笼具(individal ventilation cages, IVC)饲育盒饲养适应7 d, 将外科手术切取的新鲜人胃癌组织放入超净台中, 用Hanks液反复冲洗, 去除坏死组织和非癌组织后切成1—2 mm3小块, 取2块瘤组织, 以粗针穿刺移植于SCID小鼠皮下, IVC饲育盒中饲养。
1.2.2 荷瘤SCID小鼠分组和给药
将荷胃癌组织的 SCID 小鼠随机分为 3 组, 每组 10只。模型组: 腹腔注射菜籽油2 ml·kg-1; 5-FU组: 腹腔注射5-FU 100 mg·kg-1; 给药组: 分别腹腔注射十八碳二烯酸100、300、900 mg·kg-1, 连续给药 21 d。
1.2.3 肿瘤组织检测分析
末次给药后次日, 乙醚吸入无痛麻醉, 剥取各组动物肿瘤组织, 称重, 计算肿瘤生长抑制率。分别称取各组瘤组织 500 mg, 用匀浆研磨器研磨, 以2000r·min-1离心 15 min, 取上清, 用酶标仪在 450 nm 波长下测定光密度值(OD)。
1.2.4 人胃癌细胞体外培养
待SCID小鼠移植瘤块生长到直径约10 mm左右时, 乙醚吸入麻醉, 手术切取移植瘤, 用D-Hanks液清洗, 去除表面血污和结缔组织等非瘤组织。再次清洗后, 用手术刀将瘤组织切成若干小块, 移入无菌青霉素小瓶中, 加入适量缓冲液, 用弯头眼科剪反复剪切组织, 直到组织成糊状。静置片刻后, 用吸管吸去上层液体, 加入适当的缓冲液再清洗一次。将盛有胃癌组织碎片的容器置于冰上, 去除残留的上清液, 加入0.25%的胰蛋白酶(100 mg组织加入1 mL 胰蛋白酶)在4℃孵育6—18 h。移去胰蛋白酶, 在37℃孵育20—30 min。加入热的RPMI1640培养基, 用吸管轻轻吹打分散组织, 用无菌不锈钢丝网(150×150目)过滤, 取细胞悬液分装于培养瓶中, 使细胞悬液的量略高于培养瓶底部为宜。5%CO2, 37℃静置培养3—5 d, 细胞贴附于瓶壁, 并伸展开始生长, 补加新培养液, 继续培养2—3 d后换液, 进行传代培养。
1.2.5 人胃癌细胞分组、给药和检测
取传代培养人胃癌细胞(细胞密度2×106个·L-1)分别接种于96孔板, 其中2孔只加RPMI1640培养液, 每孔100 µL, 作空白对照; 其余每孔各加细胞悬液90 µL。实验组: 十八碳二烯酸用DMSO稀释成2.0、4.0、8.0 mg·L-13个浓度组, 每组每孔分别加药10 µL; 5-FU组: 每孔加5-FU(10 mg·L-1)10 µL; 对照组加DMSO 10 µL。每组设4个重复孔。置5%CO2孵育箱中37℃, 饱和湿度条件培养48 h, 加MTT, 每孔10 µL, 孵育4 h。移入0.5 mL离心管, 1000 rpm离心5 min, 弃去上清液, 每孔加DMSO 100 µL, 置入气浴恒温振荡器37℃振荡10 min, 用酶联免疫检测仪在450 nm处测其吸光度(OD), 计算细胞生长抑制率(IR%); 用流式细胞仪测细胞周期及细胞凋亡率; 用联免疫吸附法(ELISA)检测细胞MDM2、PKB/Akt、p21蛋白表达水平。
1.2.6 直线回归方程制作
取标准品 50 μL, 加入酶标板, 用酶标仪在 450 nm 波长下测定光密度值(OD)。以标准品的浓度为横坐标, 对应的光密度值(OD)为纵坐标, 计算出标准曲线的直线回归方程。
1.3 统计学处理
用 SPSS 20.0 软件进行统计学分析。计数资料用百分率(%)表示; 组间比较采用单因素方差分析(ANOVA), 以<0.05为差异有统计学意义。
2 结果与分析
2.1 十八碳二烯酸对人胃癌移植瘤生长的抑制作用
给予2.0、4.0、8.0 mg·L-1十八碳二烯酸和5-FU, 各组动物移植瘤生长状况见图1。
给予2.0、4.0、8.0 mg·L-1十八碳二烯酸和5-FU, 人胃癌移植瘤重量, 低(1.74±0.029)、中(1.53±0.021)、高(1.15±0.014)剂量组和5-FU组(1.36±0.011)比模型组(2.12±0.004)轻17.92%, 27.83%, 45.75%和35.85%。图 2。

注: a: 正常SCID小鼠; b: 低剂量组; c: 中剂量组; d: 高剂量组; e: 5-FU组; f: 模型组
Figure 1 Inhibitory effect of octadecadienoic acid on the growth of human transplanted gastric cancer

图2 十八碳二烯酸对人胃癌生长的影响
Figure 2 Effect of octadecadienoic acid on growth of human gastric cancer
2.2 十八碳二烯酸对人胃癌移植瘤 cAMP、P53 和P13K 水平的影响
cAMP 标准曲线的直线回归方程为=2× 10–4+2.49×10–2,2=0.9989。人胃癌移植瘤cAMP 水平, 低(2.48±0.016)、中(2.67±0.016)、高(3.04±0.022)剂量组和5-FU组(2.66±0.011)比模型组(2.16±0.011)升高14.88%, 23.64%, 40.70%和23.21%(F=182.623,<0.05—0.01), 见图 3。
P53 标准曲线的直线回归方程为=3.92×10–2+7.22×10–2,2=0.9981。人胃癌移植瘤P53 水平, 低(2.29±0.011)、中(1.88±0.011)、高(1.33±0.007)剂量组和5-FU组(1.53±0.021)比模型组降低37.94%, 49.05%, 63.96%和58.54%(=19.88,<0.01), 见图3。
P13K 标准曲线的直线回归方程为=9.25× 10–2+4.41×10–2,2=0.9976。人胃癌移植瘤中P13K水平, 低(1.09±0.011)、中(0.91±0.015)、高(0.64±0.011)剂量组和5-FU组(0.88±0.011)比模型组(1.36±0.011)降低20.77%, 33.09%, 52.94%和35.29%(=214.902,<0.05—0.01), 见图 3。
2.3 十八碳二烯酸对人胃癌细胞生态毒理学作用
给予人胃癌细胞2.0、4.0、8.0 mg·L-1十八碳二烯酸和5-FU培养48 h, 在光学显微镜下计数活细胞, 结果发现活细胞数随给药浓度的增加和作用时间的延长而减少。图4, 5。
给予人胃癌细胞2.0、4.0、8.0 mg·L–1十八碳二烯酸和5-FU培养48 h, MTT法测定, 人胃癌细胞增殖抑制率为23.11%、47.89%、59.66%和51.26%, 半数抑制浓度(IC50)为5.811 mg·L-1。图6。
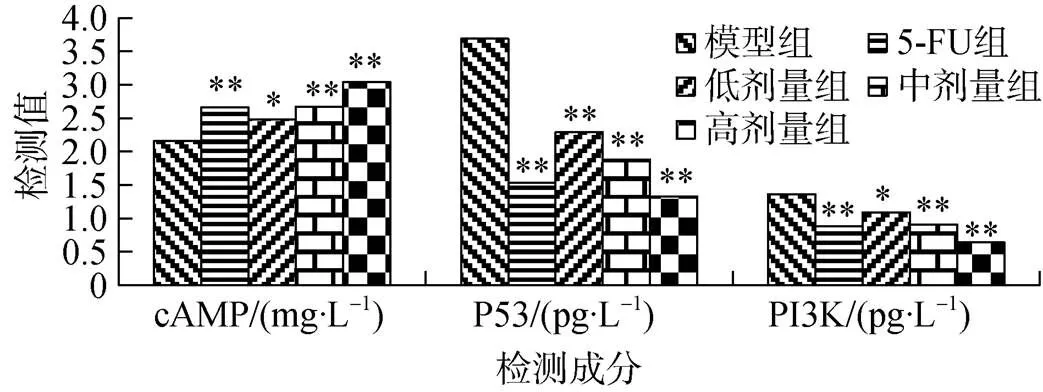
图3 十八碳二烯酸对人胃癌移植瘤 cAMP、P53 和 P13K水平的影响(与模型组比: *P< 0.05, **P < 0.01)
Figure 3 Effects of octadecadienoic acid on the levels of cAMP, P53 and P13K in transplantated human gastric cancer (*< 0.05,**< 0.01model group)
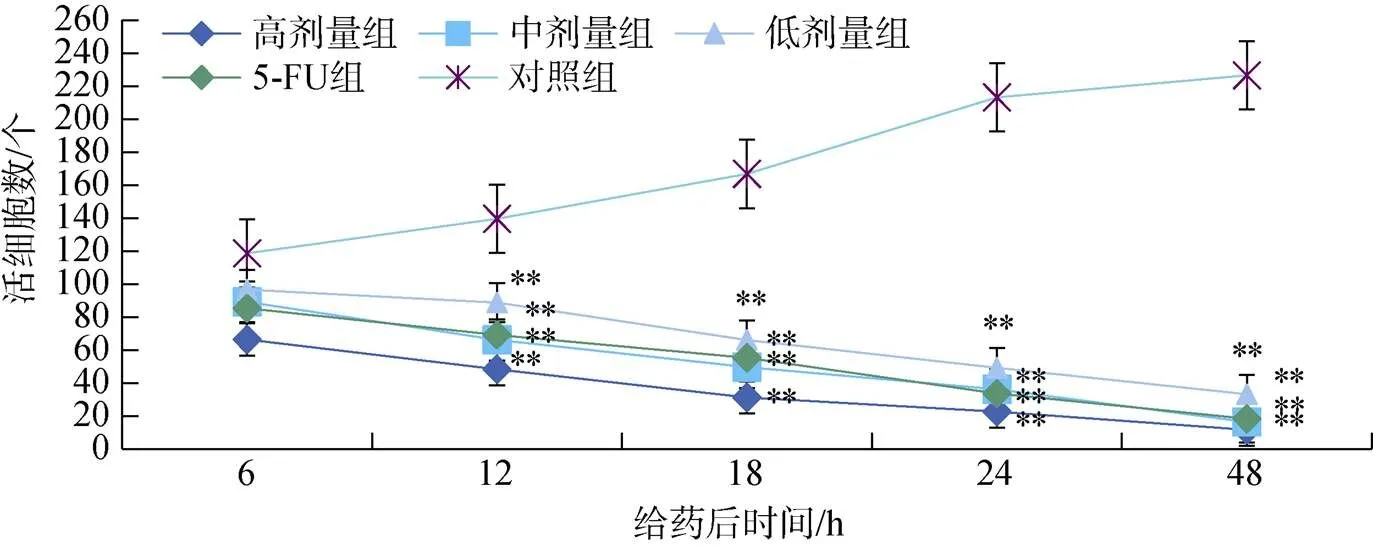
图4 十八碳二烯酸对人胃癌细胞毒性作用(和对照组比: **P<0.01)
Figure 4 Cytotoxic effect of octadecadienoic acid on human gastric cancer cells(**<0.01control group)

注: a: 对照组; b: 低剂量组; c: 中剂量组; d: 高剂量组; e: 5-FU组; : 正常细胞; : 死亡细胞
Figure 5 Damaged effect of octadecadienoic acid on human gastric cancer cells

图6 十八碳二烯酸对人胃癌细胞增殖抑制作用(与对照组比: **p<0.01)
Figure 6 Inhibition effect of octadecadienoic acid on human gastric cancer ells proliferation (**<0.01control group)
2.4 十八碳二烯酸对人胃癌细胞分裂周期的影响
给予人胃癌细胞2.0、4.0、8.0 mg·L–1十八碳二烯酸和5-FU培养48 h, 流式细胞仪检测, G0G1期细胞比对照组增加16.54%, 21.93%, 27.51%和20.45%; G2M期细胞比对照组减少36.40%, 57.02%, 67.98%和41.67%; 凋亡率为17.44%、22.16%、23.37%和19.21%。表1, 图7。
2.5 十八碳二烯酸对人胃癌细胞 P21、PKB/Akt、MDM2 水平的影响
P21标准曲线的直线回归方程为:=2.0×10-4+ 3.79×10-2,2=0.998。人胃癌细胞P21水平, 低(3.23±0.011)、中(3.86±0.025)、高(4.64±0.011)剂量组和5-FU组(4.35±0.015)比对照组(2.85±0.011)升高13.33%、35.44%、62.81%和52.63%(=2.364,<0.05—0.01)。图 8.
PKB/Akt标准曲线的直线回归方程为:=1.39× 10-2+6.04×10-2, R2=0.9983。人胃癌细胞PKB/Akt水平, 低(0.79±0.015)、中(0.57±0.022)、高(0.48±0.007)剂量组和5-FU组(0.52±0.019)比对照组(0.98±0.022)降低19.39%、41.84%、51.02%和46.94%(=144.419,<0.01)。图8。
MDM2标准曲线的直线回归方程为:=2.62× 10-2+1.37×10-2,2=0.998。人胃癌癌细胞MDM2水平, 低(0.43±0.022)、中(0.54±0.011)、高(0.69±0.025)剂量组和5-FU组(0.52±0.022)比对照组(0.39±0.011)升高10.26%、38.46%、76.92%和33.33%(=37.239,<0.05—0.01)。图8。
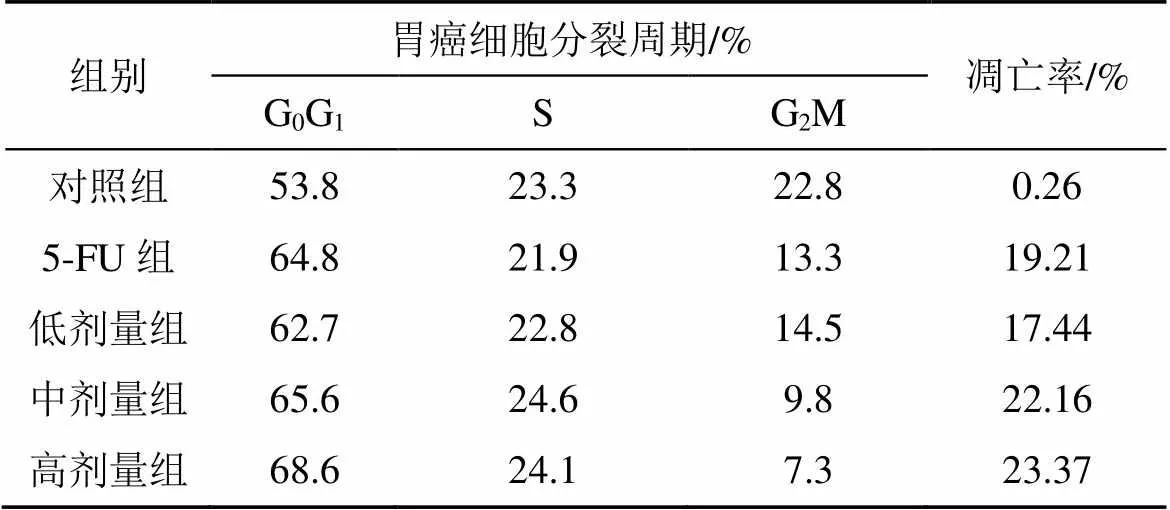
表1 十八碳二烯酸对人胃癌细胞分裂周期的影响
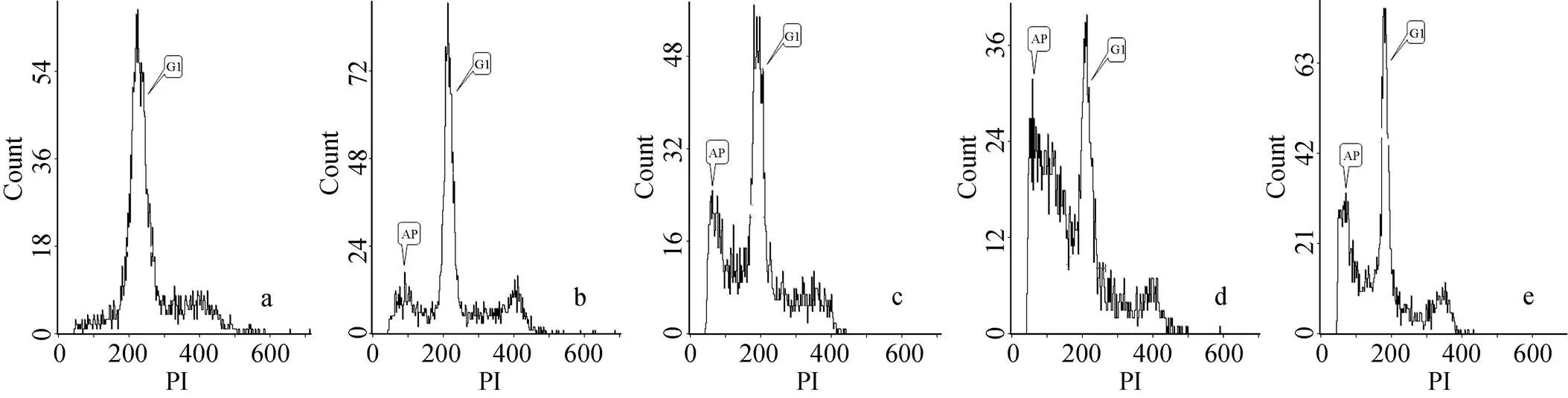
注: AP: 凋亡峰; G1: G1期细胞峰; a: 对照组; b: 低剂量组, 凋亡率17.44%; c: 中剂量组, 凋亡率22.16%; d: 高剂量组, 凋亡率23.37%; e: 5-FU组, 凋亡率19.21%
Figure 7 Effects of octadecadienoic acid on apoptosis of human gastric cancer cells
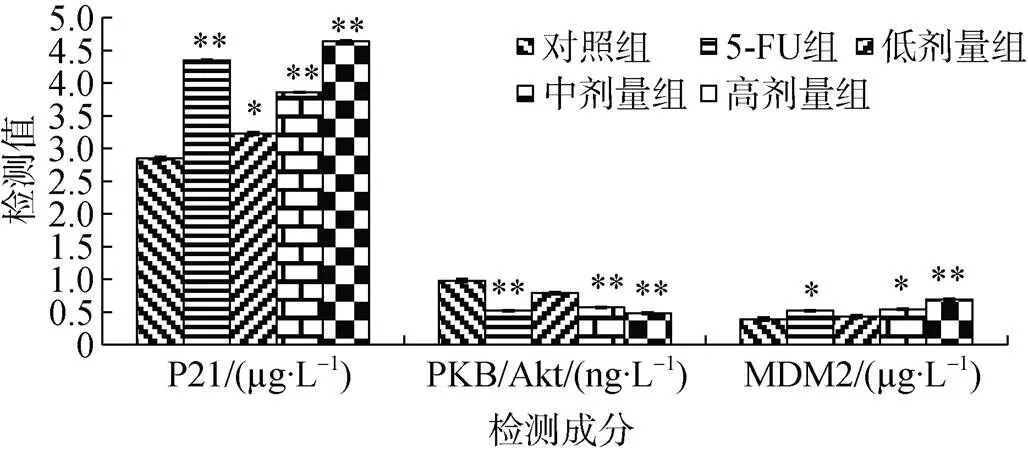
图8 十八碳二烯酸对人胃癌细胞P21、PKB/Akt、 MDM2水平的影响(与对照组比: *p<0.05, **p<0.01)
Figure 8 Effect of octadecadienoic acid on P21, PKB/Akt, MDM2 levels in human gastric cancer cells (*<0.05,**<0.01control group)
3 讨论
重症联合免疫缺陷(SCID)小鼠是研究环境资源对人类肿瘤生态毒理学理想的动物模型, 已广泛用膀胱癌[16]、食管癌[17]、胃癌[18]、乳腺癌[19]、结肠癌[20]等疾病的实验研究。不饱和脂肪酸作为被广泛研究的免疫营养物质, 不仅在调节机体免疫功能、脂质代谢等方面有着重要作用, 而且在肿瘤生态毒理学方面也有着重要作用。研究表明, 不饱和脂肪酸具有诱导多种肿瘤细胞凋亡[21], 抑制肿瘤细胞增殖[22]、转移[23]等作用, 并能抑制相关癌症基因编码蛋白表达[24], 调控信号传导通路[25], 降低癌细胞侵袭力[26], 起到抑制肿瘤增殖作用[27]。分子生物学研究发现, 肿瘤生长或抑制受磷脂酰肌醇-3激酶/蛋白激酶 B (PI3K-Akt) 信号通路的调节和控制[28]。PI3K-Akt信号通路在肿瘤血管生成和细胞生长、增殖、新陈代谢、迁移、分化和凋亡过程中起着至关重要的作用[29]。cAMP有抑制细胞分裂、促进细胞分化的作用。因此, 凡能使细胞内 cAMP含量升高的因素均能降低细胞生长速度, 抑制细胞增殖, 促进细胞分化或凋亡。在PI3K-Akt信号转导通路中, P53、P21、MDM2基因起着重要的调控作用。正常生理条件下, 体内外环境因子与细胞膜受体结合, 激活P53基因使之表达, P53蛋白与P21基因直接作用调控P21蛋白的表达[30], 促使P21与GDP分离而与GTP结合, 形成P21-GTP复合体, 使细胞内信号转导系统开放, 细胞开始分裂和增殖; P21具有GTP酶活性, 可水解GTP为GDP, P21与GDP结合而失活, 使细胞内信号转导系统处于关闭状态。P53蛋白的N末端与MDM2蛋白相结合, 形成MDM2- P53负反馈调节环路, P53激活能诱导MDM2基因转录和MDM2蛋白表达, MDM2蛋白与P53的特异性结合而阻止P53与DNA结合并抑制其反式激活功能, MDM2还可通过蛋白水解作用而促使P53蛋白降解, 从而限制P53过高的活性[31], 调控正常的细胞分裂增殖。实验结果发现, 给予荷人胃癌SCID 小鼠十八碳二烯酸, 人胃癌移植瘤生长抑制率、cAMP水平比模型组显著升高, P53 和 P13K 水平比模型组明显降低。给予胃癌瘤细胞十八碳二烯酸, 活细胞数随给药浓度的升高和培养时间的延长而明显减少。G0G1期细胞比对照组明显增加, G2M期细胞显著减少, 凋亡率升高。瘤细胞P21水平升高水解GTP为GDP, P21与GDP结合而失活, 关闭细胞内信号转导系统。MDM2水平升高, 促使P53蛋白降解, 降低PI3K-Akt信号通路活性及下游相关分子的表达, 抑制瘤细胞增殖。
4 结论
综上所述, 植物提取物十八碳二烯酸对胃癌移植瘤和瘤细胞增殖具有明显的生态毒性和抑制作用。其机制可能与升高移植瘤细胞cAMP、P21、MDM2水平, 降低P13K、PKB/Akt、P53水平, 抑制细胞分裂周期, 降低PI3K-Akt信号转导通路活性有关。在P13K-Akt信号转导通路中, P21、MDM2蛋白水平起着主要的调控作用, P21、MDM2可作为临床肿瘤治疗和康复的潜在靶点。
[1] 杨敏, 魏冰, 孟橘, 等. ω-3多不饱和脂肪酸的来源及生理功能研究进展[J]. 中国油脂, 2019, 44(10): 110–115.
[2] 陈晓昌, 马家驰, 苏河, 等. 结肠癌根治术围手术期应用ω-3多十二碳烯酸的疗效[J]. 中国普通外科杂志, 2016, 25(12): 1785–1791.
[3] 孙静文, 庄则豪. n-3多十二碳烯酸抗消化道肿瘤作用[J]. 广东医学, 2011, 12(18): 2485–2488.
[4] 贺延苓, 黄若安, 蔡昌兰. n-3多不饱和脂肪酸的抗癌功效及其生物学机制的研究进展[J]. 现代肿瘤医学, 2018, 26(24): 4025–4028.
[5] 王磊, 陈平. n-3多不饱和脂肪酸抗肿瘤机制的相关研究[J]. 中国现代普通外科进展, 2012, 15(2): 126–130.
[6] 林静梨, 李倩怡, 杨婷. ω-3多不饱和脂肪酸治疗结直肠癌术后合并脓毒症休克患者疗效观察[J]. 海南医学, 2017, 28(3): 78–380.
[7] 蒋承璐,谢东. ω-3多不饱和脂肪酸对腹腔镜结直肠癌切除术后患者血清白介素-8、超氧化物歧化酶及丙二醛水平的影响[J]. 中国医刊, 2020, 55(9): 1031–1033.
[8] Zhong Xuan, Wang Aijui, Wang Hongyu. DHA-inhibited proliferation through the PTEN /PI3K/Akt pathway in gastric cancer SGC 7901cells [J]. Chinese Journal of Clinical Oncology, 2013, 40 (4): 190–194.
[9] Guo D, Zhang B, Liu S, et al. Xanthohumol induces apoptosis via caspase activation, regulation of Bcl-2, and inhibition of PI3K/Akt/m TOR-kinase in human gastric cancer cells[J]. Biomedicine & Pharmacotherapy, 2018, 106, 1300–1306.
[10] FU XQ, Feng JR, Zeng D, et al. PAK4 confers cisplatin resistance in gastric cancer cells via PI3K/Akt- and MEK/Erk- dependent pathways[J]. Bioscience Reports, 2014, 34(2): 59–67.
[11] Shi J, Yao DM, Liu W, et al. Highly frequent PIK3CA amplification is associated with poor prognosis in gastric cancer [J]. BMC Cancer, 2012, 12: 50–61.
[12] Corti F, Nichetti F, Raimondi A, et al. Targeting the PI3K/AKT/mTOR pathway in biliary tract cancers: A review of current evidences and future perspectives[J]. Cancer Treatment Reviews, 2019, 72, 45–55.
[13] Liu H, Wang J, Tao Y, et al. Curcumol inhibits colorectal cancer proliferation by targeting miR-21 and modulated PTEN/PI3K/Akt pathways[J]. Life Sciences, 2019, 221: 354–361.
[14] Zou SJ, Chen ZF, Li M. Expression of PI3K and AKT2 in gastric cancer and its elationship with clinicopathological features and survival of patients[J]. Journal of Practical Oncology, 2011, 6(4): 346–350.
[15] Park S, Kim YS, Kim DY, et al. PI3K pathway in prostate cancer: All resistant roads lead to PI3K[J]. BBA- Reviews on Cancer, 2018, 1870, 198–206.
[16] 吴建红, 张飞, 赵炜, 等. 免疫重建荷人膀胱癌-SCID鼠模型的建立[J]. 现代生物医学进展, 2014, 14(6): 1033– 1035, 1047.
[17] 卢志红, 庞敏红, 董尚林, 等. 免疫重建荷人食管癌SCID鼠肿瘤模型的建立[J]. 肿瘤研究与临床, 2015, 27(6): 381–384.
[18] 殷晓煜, 黄嘉凌, 吕明德, 等. SCID鼠人胃癌皮下移植及免疫重建复合模型的建立[J]. 中华肝胆外科杂, 2004, 10(3): 184–186.
[19] 孙冰, 吴世凯, 宋三泰. NOD/SCID小鼠平台上的肿瘤实验研究进展[J]. 中华肿瘤防治杂志, 2008, 15(4): 307–310.
[20] 廖坚松, 陈斯泽, 柯尊富. BALB/c与SCID裸小鼠高侵袭性人结肠癌肝转移模型的比较研究[J]. 胃肠病学和肝病学杂志, 2014, 23(4): 416–419.
[21] 王迎春, 王金华. ω-3多不饱和脂肪酸对肿瘤细胞侵袭转移的影响及机制研究进展[J]. 肿瘤学杂志, 2016, 22(3): 236–241.
[22] 童茜茜, 徐嘉杰, 王峰, 等. 小球藻精油对人结肠癌细胞增殖和凋亡的作用[J]. 中国食品学报, 2016, (5): 25–31.
[23] 梁盈, 刘颖, 王荣, 等. 米糠油不饱和脂肪酸对胃癌细胞HepG2克隆及迁移能力的影响[J]. 现代食品科技, 2015, 31(11): 7–12.
[24] 薛山. N-3PUFA的抗癌功效及其生物学作用机制[J]. 中国食品添加剂, 2016, (7): 200–206.
[25] 耿丽晶, 曲兴源, 孙竹萍, 等. 海洋多不饱和脂肪酸DHA抑制肿瘤机制的研究进展[J]. 食品工业科技, 2013, 34(22): 385–391.
[26] 王莉梅, 刘睿杰, 金青哲, 等. 多不饱和脂肪酸在癌症发生中的作用机制研究进展[J]. 中国油脂, 2014, 39 (8): 37–41.
[27] 朱文劲, 许庆文, 鲁珏, 等. ω-3多不饱和脂肪酸对大鼠结直肠癌的影响及与脂质代谢相关基因的研究[J]. 黑龙江医学, 2015, 39 (4): 346–349.
[28] Cao WG, Yang WP, Fan R, et al. miR-34a regulates cisplatin-induce gastric cancer cell death by modulating PI3K/AKT/survivin pathway[J]. Tumor Biology, 2014, 35(2): 1287–1295.
[29] Piao Y, Li Y, Xu Q, et al. Association of MTOR and AKT gene polymorphisms with susceptibility and survival of gastric cancer[J]. PLOS ONE, 2015, 10(8): 16–22.
[30] Veloso M, Fritz W, Klaus K. P53 gene status and expression of P53, mdm2, and 21Waf1/Cip1 proteins in colorectal cancer[J]. Virchows Archiv, 2000, 437(3): 241– 247.
[31] AyroldiE, Petrillo MG, Bastianelli A, et al. L-GILZ binds P53 and MDM2 and suppresses tumor growth through p53 activation in human cancer cells[J]. Cell Death and Differentiation, 2015, 22, 118–130.
Ecotoxicological mechanism of the octadecadienoic acid extract on human gastric cancer cells
Xie Mingren1, Wang Xianxian1, Yu Lei2, He Tianxiao1, Xie Liuyang, Yu Farong1
1. School of Public Security Technology, Gansu University of Political Science and Law, Lanzhou 730070, China. 2. School of Public Administration, Gansu University of Political Science and Law, Lanzhou 730070, China.
In order to understand the ecotoxicological mechanism of the extracted octadecadienoic acid from plant on human gastric cancer, the tumor tissues from the gastric cancer patients were transplanted subcutaneously into severe combined immunodeficiency (SCID) mice. The mice in different groups were respectively treated with 100, 300 and 900 mg·kg-1extract intraperitoneally to evaluate the inhibitory effect on the growth of transplanted tumor cells and the levels of cAMP, P53 and PI3K with the enzyme-linked immunosorbent assay (ELISA). The tumor tissues were digested with enzyme for cell culture. The cultured tumor cells were administered 2.0, 4.0 and 8.0 mg·L-1octadecadienoic acid extract, and the ecotoxicity of extract on gastric cancer cells was detected by MTT assay and the levels of P21, MDM2 and PKB/Akt were measured by ELISA. Our results showed that, after treated with different extract doses and 5-FU, compared with the control group, the growth inhibition rates of the transplanted gastric cancer were significantly increased by 17.92%-45.75% and 35.85% and the cAMP level increased by 14.88%-40.70% and 23.21% (<0.05,<0.01), respectively; while the P53 levels were decreased by 37.94%-63.96% and 58.54% (<0.01) and the PI3K level decreased by 20.77%-52.94% and 35.29% (<0.01), respectively. In addition, the numbers of living gastric cancer cells in the extract treated groups and the 5-FU group were decreased with the increase of the extract concentration and the prolongation of action time and the IC50was 5.811 mg·L-1and the inhibitory rates of cells proliferation by 23.11%-59.66% and 51.26%, respectively. The results from the flow cytometry showed that, when the gastric cancer cells were treated with different extract doses and the 5-FU, the G0G1phase cells were increased by 16.54%-7.51% and 20.45%, respectively, while the G2M phase cells were decreased by 36.40%-67.98% and 41.67%, and the apoptosis rates were 17.44%-23.37% and 19.21%, respectively, compared with the control group. The results from the ELISA suggested that, when the gastric cancer cells were treated with different extract doses and the 5-FU, the levels of P21 and MDM2 in gastric cancer cells were increased by 13.33%-62.81% and 52.63%, and 10.26%-76.92% and 33.33%, respectively, while the levels of PKB/Akt were decreased by 19.39%-51.02% and 46.94%, respectively. Our findings indicate that the SCID mouse tumor model can be used as an ecotoxicological experimental model for human tumor treatment and rehabilitation. The octadecadienoic acid extract has significant ecotoxic and inhibitory effects on the proliferation of the transplanted gastric cancer and tumor cells. The potential mechanism may be related to the increases of the cAMP, P21 and MDM2 levels, the decrease of the PI3K, PKB/Akt and P53 levels, the inhibition of the cell division cycle, and the reduced activity of PI3K-Akt signal transduction pathway.
human gastric cancer model; octadecadienoic acid; ecotoxicology; severe combined immunodeficiency mice
10.14108/j.cnki.1008-8873.2022.01.023
谢明仁, 王贤贤, 俞蕾, 等. 植物提取十八碳二烯酸对人胃癌组织细胞生态毒理学作用机制研究[J]. 生态科学, 2022, 41(1): 206–212.
Xie Mingren, Wang Xianxian, Yu Lei, et al. Ecotoxicological mechanism of the octadecadienoic acid extract on human gastric cancer cells[J]. Ecological Science, 2022, 41(1): 206–212.
R329.21
A
1008-8873(2022)01-206-07
2021-03-11;
2021-04-14
甘肃省高校科技创新团队项目(2016C-09); 兰州市科技计划项目(2019-3-80)
谢明仁(1977—), 男, 甘肃白银人, 硕士, 副教授, 硕士生导师, 主要从事法医毒理学教学和研究, E-mail: xmr6700@gsli.edu.cn
俞发荣, 男, 博士, 研究员, 主要从事法医生物学、社会环境压力对人类健康的影响、药理学和毒理学实验及实验动物学等研究, E-mail: tim9898@163.com
