一株重金属镉耐受小球藻的分离鉴定及其生长条件优化
2022-03-04李启虔卢福芝覃勇荣
李启虔, 卢福芝, 覃勇荣
一株重金属镉耐受小球藻的分离鉴定及其生长条件优化
李启虔1,2,3, 卢福芝1,2, 覃勇荣1,*
1. 河池学院化学院生物工程学院, 河池 546300 2. 广西高校微生物与植物资源开发利用重点实验室, 河池 546300 3. 河池学院农业生物技术应用研究中心, 河池 546300
以龙江河镉污染水体预留样本为实验材料, 从中筛选得到一株重金属镉耐受藻株, 经形态和分子生物学鉴定为小球藻属, 命名为sp. LQQ-1。实验从温度、pH、Cd2+、有机碳源及有机氮源等方面对该藻株生长条件进行优化, 并考察其在最佳生长条件下对水体中Cd2+的去除效果。结果表明: 该小球藻最适宜生长温度为30℃, 最适宜pH为7.0左右。Cd2+在低浓度下能促进小球藻的生长, 当Cd2+浓度超过30 µmol·L-1时, 小球藻的生长受到抑制。适宜该小球藻生长的最佳葡萄糖添加浓度为10g·L-1, 最佳尿素添加浓度为1g·L-1。在最佳生长条件下, 该小球藻对水体中Cd2+的去除率达89.7 %。
小球藻; 重金属耐受藻株; 镉; 分离鉴定
0 前言
水体重金属污染是一类在全球范围内普遍存在的环境问题, 工业活动释放到环境中的重金属离子经过各种途径迁移到水体后, 在威胁人类健康的同时也给水体生态系统的安全带来严重风险[1]。镉作为一种典型的水体重金属污染物, 曾先后于广东北江、湖南湘江及广西龙江河等多处爆发水体污染事件[2], 并普遍存在于长江水系、珠江下游和北江中上游河段的表层沉积物中, 引发学者们的广泛重视[3-4]。利用微生物修复重金属污染作为一种高效、安全、低耗的手段, 在水体重金属污染修复中发挥着重要作用[5]。目前报道的重金属污染微生物修复技术, 大多集中在使用细菌、真菌作为生物吸附材料对环境中的重金属进行富集。然而对于微藻, 特别是淡水水体中的微藻, 去除重金属离子的研究非常有限[6]。由纤维状结构和各种多糖形成的无定形胶质组成的藻类细胞壁, 表面富含如氨基、硫酸盐和羧基之类的能吸引并结合重金属离子的功能基团, 是吸附重金属的天然优良载体[7]。同时, 微藻具有生长速度快、生长代谢活跃、吸附作用强等特点, 在水体重金属离子的吸附和富集方面具有天然优势,是一类极具潜力的生物修复材料[8]。
在利用微藻生物修复重金属水体的应用过程中, 选育重金属耐受能力优良的藻种是我们面临的首要问题。本研究从曾遭受镉污染侵害的龙江河预留水体样本中筛选分离得到一株镉耐受藻株, 对其进行分子生物学鉴定并优化生长条件, 研究最佳生长条件下该藻株对水体中镉离子的去除效果, 以期为镉污染水体的生物修复应用提供实验基础。
1 材料与方法
1.1 培养基[9]
采用BG-11液体培养基进行培养, 调节pH至7.0, 121 ℃灭菌20 min后使用。藻株筛选采用BG-11固体培养基, 即在BG-11液体培养基的基础上, 每1000 mL加入20g琼脂, 高压灭菌后于超净工作台中冷却至60 ℃左右加入氨苄西林至0.05 g·L-1, 用以杀灭细菌, 纯化藻株。
1.2 藻类的富集、分离和纯化
水体样品为2012年龙江河镉污染时期收集的河水预留样本(Cd2+浓度1.7 μmol·L-1, 50 L), 于同年进行分离纯化实验。具体纯化方法如下所述, 用绢筛去大型浮游生物和杂质后, 转移10 mL水样至Cd2+浓度为20 μmol·L-1的BG-11液体培养基中。放入30 °C、6000 lx、光暗周期为14 h亮/10 h暗的光照培养箱中富集培养一周, 每天摇动两次, 并进行观察。待培养液变绿, 于超净工作台中将培养液逐级稀释后, 移取100 μL均匀涂布至灭菌后的BG-11固体培养基, 放回光照培养箱中继续培养。待平板上长出单个藻落, 挑取单个的绿色斑点接种到100 mL已灭菌的BG-11液体培养液中进行扩大培养。显微镜镜检确认无其它藻株即得到单种藻。
1.3 藻种的鉴定
1.3.1 形态学观察
采用的奥林巴斯BX-51显微镜, 放大倍数为400倍, 对分离得到的藻株进行形态观察, 通过《中国淡水藻志》进行比对, 初步判断其种属。
1.3.2 分子生物学鉴定
将分离得到的藻株扩大培养7天后, 将培养液于4 ℃, 10000 r·min-1, 冷冻离心5 min, 弃上清液, 收集藻体。采用植物基因组DNA快速抽提试剂盒(上海生工)提取所得藻体总DNA。利用18S rDNA 序列分析鉴定经分离纯化所得藻株的种属。PCR 扩增引物为18S-F: 5′-ACCTGGTTGATCCTG CCAGT-3′, 18S-R: 5′-TCACCTACGGAAACCTT GT-3′[10]。以藻株基因组DNA为模板进行PCR扩增。 PCR体系(25 µL)为: 上下游引物各1 µL、DNA模板0.5 µL、ddH2O 10 µL、Taq DNA聚合酶12.5 µL。PCR反应条件为: 95 ℃预变性5 min; 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸40 s, 30个循环, 最后72 ℃延伸10 min。基因扩增的产物经纯化后由上海美吉生物公司测序, 所得序列通过GenBank中其它藻种的18S rDNA序列数据进行比对分析, 采用MEGA7. 1软件的NJ (Neighbor-Jointin) 法构建系统发育树。
1.4 小球藻生长条件优化
1.4.1 生长曲线的测定
将小球藻接种于100 mL 的BG-11液体培养基中, 在15 d周期里, 间隔24 h取样1 mL, 细胞计数观测藻细胞的生长情况, 绘制生长曲线。后续实验均采用对数生长期藻种进行接种, 初始接种浓度为 2.0×105个·mL-1。
1.4.2 pH对小球藻生长的影响
将小球藻接种于50 mL的pH为: 4、5、6、7、8、9的BG-11液体培养基内, 每个处理设置三个平行, 培养7 d后, 细胞计数观测藻细胞密度变化情况, 考察pH对小球藻生长情况的影响。
1.4.3 温度对小球藻生长的影响
将小球藻接种至50 mL pH为6的BG-11液体培养基内, 分别放置于温度为20 ℃, 25 ℃, 30 ℃和35 ℃的光照培养箱内, 每个处理设置三个平行, 培养7 d后, 细胞计数观测藻细胞密度变化情况, 考察培养温度对小球藻生长情况的影响。
1.4.4 有机碳源对小球藻生长的影响
将小球藻接种至50 mL含葡萄糖浓度梯度为0 g·L-1、10 g·L-1、20 g·L-1、30 g·L-1的BG-11培养基内, 每个处理设置三个平行, 培养7 d后, 细胞计数观测藻细胞密度变化情况, 考察有机碳源对小球藻生长情况的影响。
总之,在高中语文教学过程中关注生命体验,不仅体现了语文学科的人文性特点,而且有助于学生形成正确的生命价值观。语文教师应将生命体验不断地渗透教学过程中,培养学生的生命情怀,这样既可以让他们学到知识,实现既定的教学目标,也能让他们学会认识生命的价值,获得生命的成长,不断向着理想的人生进发。
1.4.5 有机氮源对小球藻生长的影响
将小球藻接种至50 mL含尿素浓度梯度为0 g·L-1、0.5 g·L-1、1.0 g·L-1、1.5 g·L-1的BG-11培养基内, 每个处理设置三个平行, 培养7d后, 细胞计数观测藻细胞密度变化情况, 考察有机氮源对小球藻生长情况的影响。
1.4.6 镉浓度对小球藻生长情况的影响
将小球藻接种至50 mL含Cd2+浓度梯度为: 10 µmol·L-1、20 µmol·L-1、30 µmol·L-1、50 µmol·L-1、100 µmol·L-1、250 µmol·L-1的BG-11培养基内, 每个处理设置三个平行, 在7 d周期里, 间隔每24 h取样1 mL, 通过血球计数板进行细胞计数, 观测藻细胞的生长情况, 绘制生长曲线并根据下面公式计算比生长速率(μ)[11-12]。
=(lnNt–lnN0)/(t–t0)
式中μ为sp. LQQ-1比生长速率, d-1; N0与Nt分别为初始时刻t0和t时刻藻细胞浓度, 个细胞·mL-1。
1.5 小球藻对重金属镉的富集能力测定
2 结果与分析
2.1 藻种的鉴定
分离出的单株藻在光学显微镜下观察细胞形态为圆球形绿色单细胞, 细胞壁平滑, 直径3—5 μm, 胞内存在色素体(图1), 初步鉴定为小球藻。经18S rDNA扩增, PCR产物大小为1619 bp, 测序并与NCBI数据库中已有的微藻18S rDNA序列比对构建系统进化树(图2)。结果显示, 该藻种与浮水小球藻(, FR865661.1)的距离最近, 其序列相似度为99.8%。显微观察和分子鉴定的结果均表明该藻株为小球藻属, 命名为sp. LQQ-1。测序数据已提交至Genbank, 并获得登记号为MN688878。

图1 分离纯化的小球藻(A:小球藻的液体培养; B: 小球藻在光学显微镜下的形态特征)
Figure 1 Purified(A: Liquid culture of purified; B: Morphological characteristic of thewas observed by microscope)

图2 基于18S rDNA基因序列构建的Chlorella sp. LQQ-1的进化树
Figure 2 Phylogenetic tree ofsp. LQQ-1 based on 18S rDNA
2.2 小球藻生长特性研究
2.2.1 小球藻生长曲线
由图3可见, 该小球藻在接种前两天内处于延迟期, 在2—6天处于对数生长期, 7—12天处于稳定期, 12天之后, 小球藻进入衰亡期。
2.2.2 小球藻生长条件优化
本研究通过单因素实验, 从pH、生长温度、有机碳源和有机氮源四方面对小球藻的生长进行了优化。由图4A可知, 小球藻的生长, 在强酸性环境下受到明显的抑制。随着pH值的增大, 小球藻的细胞浓度也相应增加。该藻株较适宜在pH 6—7范围内生长。由图4B可知, 当温度低于30 ℃时, 温度和小球藻细胞密度存在显著性差异 (< 0.05) , 温度与小球藻生长呈正相关性。继续提高培养温度, 小球藻细胞密度随着温度的增加开始下降。说明小球藻的最适生长温度在30 ℃附近。小球藻既可以利用光能自养又可以利用有机碳源进行生长繁殖[13]。采用异养和兼养培养模式能有效提高小球藻的藻细胞密度并缩短培养时间[14]。本实验通过添加有机碳源葡萄糖对小球藻的生长条件进行优化。由图4C可见, 葡萄糖的添加, 在一定程度上可以促进小球藻的生长。实验结果表明, 以添加质量浓度为10 g·L-1葡萄糖促进生长的效果最佳, 高于此浓度, 其促生效果不再提高。由图4D可知, 尿素对小球藻的生长起到积极作用, 以添加质量浓度为1 g·L-1尿素的促生效果最佳。继续增大尿素浓度, 反而会抑制小球藻的生长。这可能与小球藻对尿素的利用方式有关, 浮游生物通过脲酶将尿素经分解成NH4+和H2CO3[15], 而过高的铵盐可能会起解偶联作用, 降低小球藻类囊体薄膜两侧的pH差, 影响ATP的合成, 从而抑制小球藻的生长[16]。

图3 小球藻生长曲线
Figure 3 The growth curve ofsp. LQQ-1
2.2.6 Cd2+浓度对小球藻生长的影响
由图5可见, 在低浓度范围内, Cd2+浓度的增加一定程度上促进了小球藻的生长, 在Cd2+浓度为30 µmol·L-1的处理组中培养7d后, 小球藻细胞密度最高, 达5.9×106个·mL-1。随着Cd2+浓度的进一步增大, 小球藻的细胞密度显著下降。在Cd2+浓度为250 µmol·L-1的处理组中培养7 d后, 小球藻细胞密度仅有9.8×105个·mL-1。小球藻比生长速率的变化也呈现出相同趋势(图6)。在低浓度Cd2+胁迫下, 小球藻比生长速率随着浓度的增大而增加, 当Cd2+浓度为30 µmol·L-1时, 小球藻的繁殖速度最快, 第二天达到最大值0.96 d-1。继续增大Cd2+浓度, 小球藻的比生长速率开始降低, 且达到最大值的时间也逐渐增长。在Cd2+浓度为250 µmol·L-1的处理组中, 小球藻比生长速率在第三天达到最高值0.39 d-1。说明在高浓度Cd2+胁迫下, 小球藻虽然能存活, 但其生长繁殖受到一定的抑制。维持小球藻sp. LQQ-1生长的最佳Cd2+浓度为30 µmol·L-1。
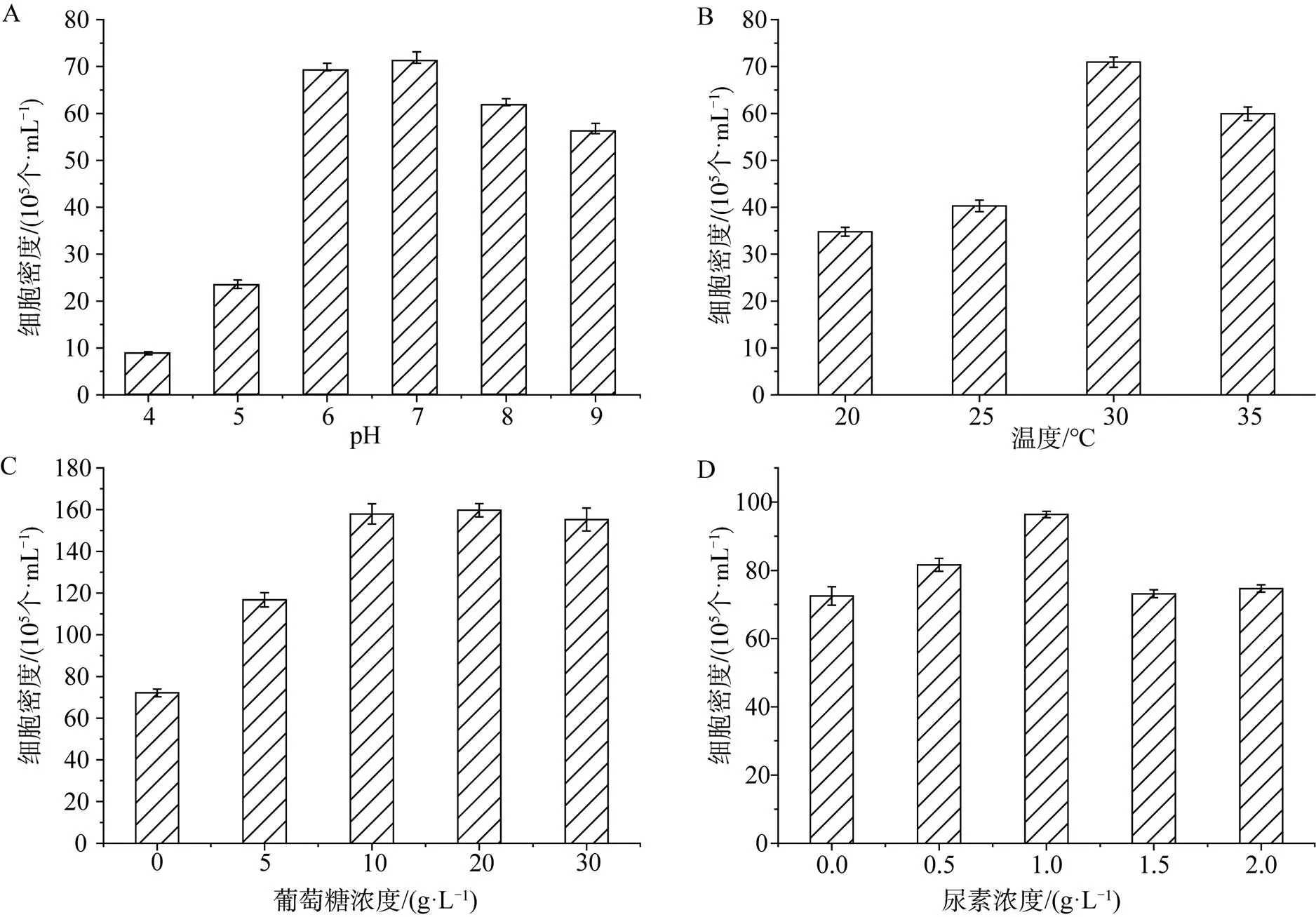
图4 小球藻生长条件优化 (A: pH; B: 温度; C: 葡萄糖浓度; D: 尿素浓度)
Figure 4 Optimization of the growth conditions ofsp. LQQ-1 (A: pH; B: temperature; C: glucose concentration; D: urea concentration)
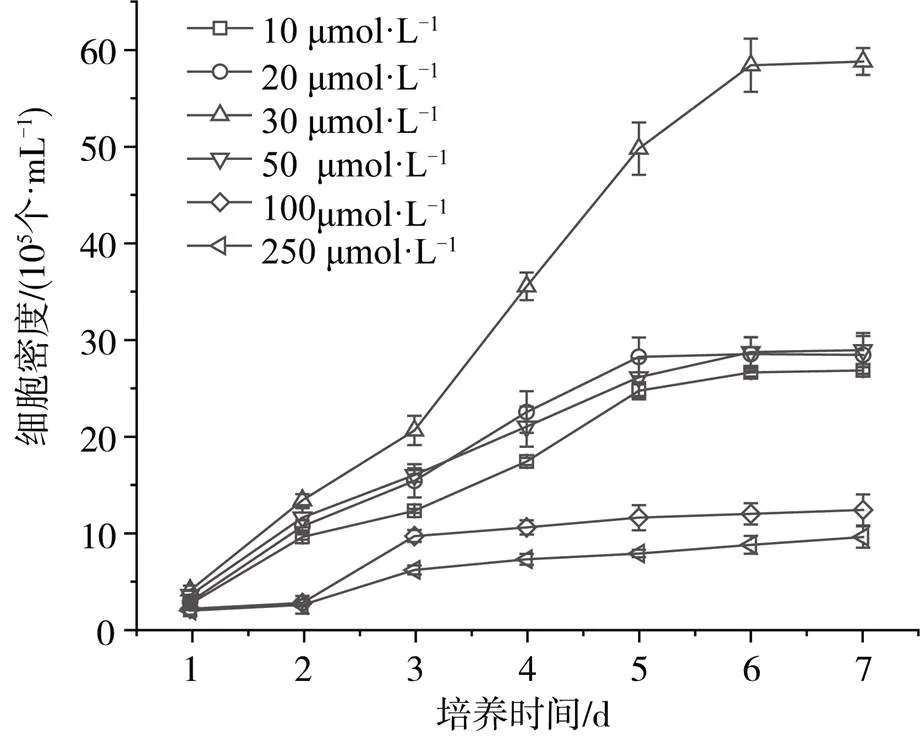
图5 不同浓度重金属Cd2 +处理下小球藻的细胞密度变化
Figure 5 Change of cell density ofsp. LQQ-1 grown in different concentration of Cd2+
2.3 小球藻对重金属的富集作用
由图7可见, 小球藻对溶液中Cd2+的去除效果, 与培养时间呈正相关性, 主要集中在前三天, 且明显受到初始Cd2+浓度的影响。在低镉浓度处理组(Cd2+初始浓度为30 µmol·L-1)中, 3天后水体中镉离子的残留率为20.4 %, 随着水体中的金属镉浓度转移到小球藻细胞壁上, 小球藻的吸附速率也开始减慢, 7天后水体中镉离子的残留率为10.3 %。但在高镉浓度处理组(Cd2+初始浓度为100 µmol·L-1)中, 重金属的去除效果显著降低, 3天后水体中仍然有71.5 %镉离子残留, 至7天趋于饱和时, 水体中镉离子的残留率为60.7 %。
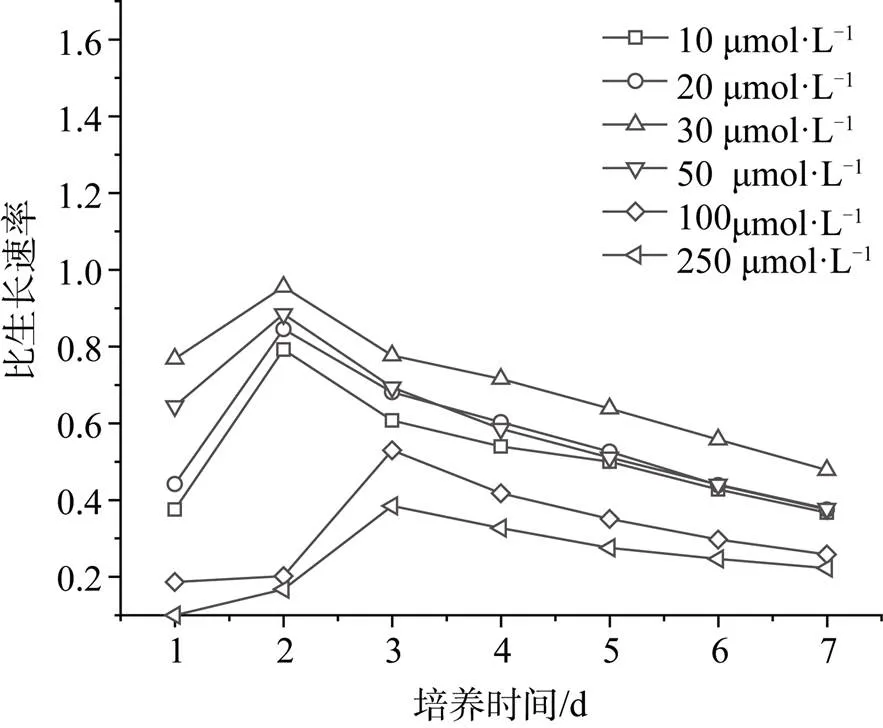
图6 不同浓度对小球藻的比生长速率的影响
Figure 6 Change of relative growth rate ofsp. LQQ-1 grown in different concentration of Cd2+

图7 小球藻对Cd2+的去除效果
Figure 7 Removal efficiency of Cd2+bysp. LQQ-1
3 讨论
藻类广泛分布于海水和淡水环境, 是地球上最大的初级生产者群体。其纤维网状结构的细胞壁表面存在大量合理排列的阴离子基团能有效的富集重金属[17]。此外, 活体微藻还可以通过生物代谢的方式将重金属离子吸收富集至细胞内部[18]。因此, 微藻是一种极具潜力的重金属生物修复材料, 发掘对重金属生物吸附能力强的优质藻种资源, 开发相应的生物修复技术, 具有广阔的应用前景。
小球藻作为淡水水体中微藻群落的常见优势种, 在水产养殖、维持水体微藻群落结构稳定和水体去营养化方面发挥着重要作用[19]。然而, 对于小球藻吸附处理水体重金属的研究还鲜有报道。葸玉琴[20]等在研究普通小球藻对不同浓度镉胁迫的生长生理响应时发现小球藻在40 µmol·L-1Cd2+浓度下, 会出现大量死亡现象。本研究涉及到的小球藻sp. LQQ-1于250 µmol·L-1Cd2+浓度下, 仍能维持一定的生长, 且低浓度的Cd2+对该藻株生长起到促进作用, 说明该小球藻对重金属镉耐受能力出色, 存在良好的重金属污染水体修复潜力。本研究中小球藻的比生长速率随着Cd2+浓度的增加呈先增后降的趋势, Hormesis效应[21]较好的解释了这一现象, 小球藻在低浓度的Cd2+刺激下, 产生了毒性兴奋效应, 提高了繁殖能力, 而高浓度的Cd2+抑制了小球藻的正常生理代谢活动使得生长变得迟缓[22]。
微藻对重金属的去除动力学分为被动吸附和主动运输两个阶段[23]。被动吸附发生在细胞表面, 重金属通过静电相互作用力被小球藻细胞表面官能团快速吸附或络合, 在此阶段Cd2+的去除率与小球藻的生物量有直接的关系, 当小球藻的生物量相对于溶液中Cd2+达到平衡, 水体中镉的去除效果亦不再增加。在主动运输阶段, 重金属离子穿过细胞膜屏障, 被胞内金属螯合蛋白捕捉固定, 于细胞体内富集, 过程要缓慢得多。活体水藻去除水体重金属离子的过程中, 被动扩散与主动运输同时存在。实验结果表明, Cd2+的去除率和小球藻的生长存在正相关性(< 0.05)。前三天小球藻对重金属的去除率增加显著, 说明在初始阶段小球藻对水体中镉的去除过程中被动扩散起到主要贡献; 三天后重金属的去除率增长明显放缓, 表明细胞壁表面的金属离子趋于饱和, 此时主动运输成为水体中镉去除的主要因素, 吸附在细胞表面的Cd2+以主动运输的方式进入胞内, 与胞内的金属螯合肽结合, 送至液泡储存, 进一步提高水体重金属去除能力。本研究表明, 小球藻对水体中重金属的去除效果受到初始Cd2+浓度的显著影响。这是由于小球藻对重金属的吸附与其生物量呈正相关关系, 高浓度Cd2+使小球藻的生长受到抑制, 所以影响到水体中Cd2+的去除率。在最适宜小球藻生长的Cd2+浓度下(30 µmol·L-1), 接种一周后, Cd2+去除率达到89.7 %, 此结果接近已报道的高效重金属吸附微藻[18,22]。表明在优化条件下, 该藻株对水体中的Cd2+具有良好的去除能力, 在重金属污染水体的修复中存在一定的应用潜力。
4 结论与展望
本研究筛选得到的小球藻sp. LQQ-1能在Cd2+污染水体中正常生长。通过培养条件优化后, 该藻株对水体中的Cd2+表现出良好的去除能力。后续工作应以此抗性藻株作为研究材料, 一方面对其去除和吸附重金属的机理以及相关动力学吸附解吸模型进行研究; 另一方面还需继续探索开发与水藻生物修复相适应的联合修复手段, 如固定化包埋、菌藻共生等技术, 进一步增强水藻在重金属修复方面的应用潜力。
[1] JACOB J M, KARTHIK C, SARATALE R G, et al. Biological approaches to tackle heavy metal pollution: A survey of literature[J]. Journal of Environmental Management, 2018, 217: 56–70.
[2] 钟格梅, 唐振柱, 赵鹏, 等. 龙江河镉污染事件卫生应急处置效果分析[J]. 环境与健康杂志, 2013, 30(3): 258– 260.
[3] 董璟琦, 张红振, 王金南, 等. 龙江河突发环境事件河流镉污染化学形态模拟[J]. 中国环境科学, 2015, 35(10): 3046–3052.
[4] 朱飞, 李彦旭, 许振成, 等. 龙江河水体与沉积物镉污染特征与潜在生态风险评价[J]. 环境污染与防治, 2013, 35(11): 56–61.
[5] 卢福芝, 李启虔, 何海燕, 等. 一株抗镉真菌的分离鉴定及特性研究[J]. 环境工程, 2016, 34(4): 64–67.
[6] 王碧荷, 王蕾, 贾元铭, 等. 微藻生物富集重金属的研究进展[J]. 环境工程, 2017, 35(8): 67–71+120.
[7] PIOTROWSKA N A, BAJGUZ A, ZAMBRZYCKA E, et al. Phytohormones as regulators of heavy metal biosorption and toxicity in green alga[J]. Plant Physiology and Biochemistry, 2012, 52: 52–65.
[8] SURESH K K, DAHMS H U, WON E J, et al. Microalgae–A promising tool for heavy metal remediation[J]. Ecotoxicology and Environmental Safety, 2015, 113: 329–352.
[9] STANIER R Y, KUNISAWA R, MANDEL M, et al. Purification and Properties of Unicellular Blue–Green Algae (Order)[J]. Bacteriological Reviews, 1971, 35(2): 171–205.
[10] 江丽丽, 温小斌, 耿亚洪, 等. 一株产油微藻的筛选及分子鉴定[J]. 水生生物学报, 2013, 37(4): 606–612.
[11] 蔡卓平, 刘伟杰, 骆育敏, 等. 重金属镉和铅胁迫对海洋微藻的毒性效应研究[J]. 生态科学, 2019, 38(3): 211–217.
[12] 蔡卓平, 刘伟杰, 段舜山. 重金属Zn2+胁迫下米氏凯伦藻()的生长生理响应研究[J]. 生态科学, 2019, 38(2): 176–181.
[13] 孙远, 刘文彬, 周铁柱, 等. Fe3+对小球藻的生长及油脂含量的影响[J]. 生物技术通报, 2014(4): 181–186.
[14] 丁丽欢, 王珺, 严虹羽, 等. 热带普通小球藻培养模式的筛选及其培养基的优化[J]. 微生物学通报, 2018, 45(5): 981–989.
[15] 章喜, 徐宁, 段舜山. 不同氮源对4种海洋微藻生长的影响[J]. 生态环境学报, 2010, 19(10): 2452–2457.
[16] 梁大勇, 王小冬, 王艳. 不同氮源对球形棕囊藻生长和囊体形成的影响[J]. 海洋科学进展, 2018, 36(2): 272– 278.
[17] PRIYADARSHINI E, PRIYADARSHINIS S, PRADHAN N. Heavy metal resistance in algae and its application for metal nanoparticle synthesis[J]. Applied Microbiology and Biotechnology, 2019, 103(8): 3297–3316.
[18] 蒋心诚, 李彩云, 周旭东, 等. 活体微藻对镉(Ⅱ)的富集机理[J]. 环境工程学报, 2018, 12(5): 1382–1388.
[19] 曹煜成, 李卓佳, 胡晓娟, 等. 磷浓度与氮磷比对蛋白核小球藻氮磷吸收效应的影响[J]. 生态科学, 2017, 36(5): 34–40.
[20] 葸玉琴, 任春燕, 朱巧巧, 等. 普通小球藻对不同浓度镉胁迫的生理应答[J]. 水生生物学报, 2017, 41(5): 1106–1111.
[21] CALABRESE E J. Hormesis:Principles and applications forpharmacology and toxicology[J]. American Journal of Pharmacology and Toxicology, 2008, 3(1): 56–68.
[22] 耿红, 刘剑锋, 王诺. 重金属汞和镉对普通小球藻生长的影响[J]. 中南民族大学学报(自然科学版), 2014, 33(3): 41–43.
[23] PRIYADARSHINI I, SAHU D, RATH B. Microalgal bioremediation: Current practices and perspectives[J]. Journal of Biochemical Technology, 2011, 3(3): 299–304.
Isolation and identification of a cadmium-resistantstrain and optimization of its growth conditions
LI Qiqian1,2,3, LU Fuzhi1,2, QIN Yongrong1,*
1.College of Chemical and Biological Engineering, Hechi University, Hechi 546300, China 2.Guangxi Colleges Universities Key Laboratary of Exploitation and Utilization of Microbial and Botanical Resources, Hechi 546300, China 3. Application and Research Center of Agricultural Biotechnology of Hechi University, Hechi 546300, China
A cadmium-resistant algal strain was isolated and purified from the reserved samples of Longjiang River polluted by cadmium. The alga was identified as aspecies by morphological and molecular biological methods, and namedsp. LQQ-1. The growth conditions (temperature, pH, Cd2+, organic carbon source and organic nitrogen source) ofsp. LQQ-1 were optimized, and the removal effect of Cd2+under optimal growth conditions was also investigated. The results showed that the most suitable growth temperature of this alga was 30 ℃, and the optimum pH was 7.0. Although the growth ofsp. LQQ-1was promoted by low concentrations of Cd2+, it was inhibited while the concentration of Cd2+was exceeded 30 µmol·L-1. Additionally, the optimum concentration of glucose and urea for thegrowth were 10 g·L-1and 1 g·L-1, respectively. Under the optimal growing conditions, the removal rate of Cd2+bysp. LQQ-1 was almost 89.7 %.
; heavy metal tolerant algae; cadmium; isolation and identification
10.14108/j.cnki.1008-8873.2022.01.007
李启虔, 卢福芝, 覃勇荣. 一株重金属镉耐受小球藻的分离鉴定及其生长条件优化[J]. 生态科学, 2022, 41(1): 59–65.
LI Qiqian, LU Fuzhi, QIN Yongrong. Isolation and identification of a cadmium-resistantstrainand optimization of its growth conditions[J]. Ecological Science, 2022, 41(1): 59–65.
X171
A
1008-8873(2022)01-059-07
2020-05-19;
2020-08-16
国家自然科学基金项目(31660017); 广西高校微生物及植物资源开发利用重点实验室开放课题(2015HL001); 河池学院青年基金科研项目(2013A-N005)
李启虔(1986—), 男, 博士, 副教授, 主要从事重金属污染修复研究, E-mail: qiqianli@hcnu.edu.cn
覃勇荣(1963—),男, 硕士, 教授, 主要从事石漠化生态恢复研究, E-mail: hcxyqyr@126.com
