抗烟草花叶病毒(TMV)生防菌的鉴定及其发酵条件优化
2022-03-04赵誉强朱三荣刘天波蔡海林周向平曾维爱杨红武戴良英周志成唐前君
赵誉强,朱三荣,刘天波,,滕 凯,蔡海林,周向平,曾维爱,杨红武,戴良英,周志成,周 鹏,唐前君*
1.湖南农业大学植物保护学院,长沙市芙蓉区农大路1号 410128
2.中国烟草总公司湖南省公司,长沙市天心区芙蓉南路一段628号 410004
烟草普通花叶病毒病是一种在世界范围内广泛传播的植物病害,由烟草花叶病毒(Tobacco mosaic virus,TMV)通过微伤口侵入宿主引起感染[1]。该病毒传播速度快,寄主广,遗传变异性高,复合侵染,传统的化学方法难以控制烟草普通花叶病毒病的侵染[2]。生防微生物的应用成为植物病虫害防治的重要手段,利用拮抗细菌防治烟草病害已有相关报道。李军营等[3]用平板对峙法从云南昆明青枯病发病烟田中筛选出1株对青枯病有拮抗作用的菌株Y4;王雯丽等[4]从烟草产区的健康烟苗中分离筛选出2株对赤星病有良好抗性的菌株,并对种子萌发有显著的促生效应;付博等[5]从烟草根结线虫卵囊中分离鉴定出1株贝莱斯芽胞杆菌(Bacillus velezensis),其发酵滤液对二龄幼虫的校正死亡率达到91.7%。在烟草病毒病防治上,芽胞杆菌属(Bacillus)拮抗菌可有效降低TMV的传播和发病程度[6];申莉莉等[7-8]从烟田土壤中分离出的两株TMV拮抗细菌By33和By88,发酵产物对TMV有预防和钝化作用,活性物质可抑制病毒在烟株体内复制且诱导植物产生抗性;Park等[9]从绿针假单胞菌(Pseudomonas chlororaphis)O6中提取的抗病毒肽对TMV病毒的抑制率超过95%;余惠荣等[10]和厉彦芳等[11]从土壤中筛选鉴定的侧孢短芽胞杆菌(Brevibacillus laterosporus)对TMV的抑制率为87.52%。郭丛等[12]从病毒病土壤中分离鉴定出1株对TMV有显著拮抗作用的恶臭假单胞菌(Pseudomonas putida)A3,发酵上清液对病毒的抑制率为95%,该菌剂还能降低烟叶内烟碱含量。生防菌剂的田间应用和工业化生产还需对发酵培养基和培养条件进行筛选和优化,许大凤等[13]、陈越等[14]通过单因素和响应面法优化培养基和发酵条件,优化后的拮抗效果和抗菌活性物质产量均显著提高。此外,生防菌的田间应用效果并不稳定,防治对象单一,不同产区种烟制度和生态环境的差异都会影响生防菌剂的定殖,并产生耐药性,同时菌种多次转接传代,优良遗传性状可能发生变异退化现象。因此,在不同的生态环境中挖掘和发现新的土著有益微生物防治烟草普通花叶病毒病十分重要。近年来贝莱斯芽胞杆菌(Bacillus velezensis)作为芽胞杆菌属的一个新种而被广泛关注,该菌在抑制病原物和生物防治上具有显著优势,但国内利用贝莱斯芽胞杆菌在植物病毒病防治中的应用报道较少。为此,从感染TMV病株的根际土壤中筛选出对TMV有显著拮抗作用的菌株Z5,并开展形态学观察、生理生化试验和分子生物学鉴定,筛选最适发酵培养基,确定最佳发酵条件,旨在为烟草普通花叶病的有效防治和生防菌的田间应用提供依据。
1 材料与方法
1.1 试验材料
土壤样品:湖南农业大学耘园烟草试验基地普通烟草花叶病毒病发病K326品种的烟株根际土壤;供试植物:三生烟(Nicotiana tabacumvar.samsun nn),种植于湖南农业大学植物病理学防虫温室;供试毒源:采自长沙市宁乡烟田,经过4次单斑分离,分子检测为纯TMV,保存在湖南农业大学东沙植保基地;磷酸缓冲液(0.02 mol/L):NaH2PO4·12H2O 4.37 g,Na2HPO4·2H2O 1.22 g,pH 7,溶 于1 000 mL ddH2O,121℃灭菌20 min。
试剂:配置培养基、生理生化试验所需药品均为沪试国药集团产品(分析纯),16S rDNA片段扩增试剂购自北京全式金生物公司,DNA提取试剂盒购自天根生化科技公司,盐酸吗啉胍(20%可湿性粉剂,上海慧光化学公司);仪器:电热恒温培养箱(DHP-9082A,上海精宏实验设备有限公司);荧光显微镜(Nikon-80i,日本尼康公司);小型高速离心机(Centrifuge 5424,德国Effendorf公司);PCR扩增仪(T00TMThermal Cycle,美国BIO-RAD公司)。
1.2 拮抗菌株的筛选与鉴定
1.2.1 拮抗菌株的筛选
稀释分离法分离细菌,将5 g根际土壤样品放入盛有45 mL无菌水的锥形瓶中,振荡器振荡1 h,在28℃恒温培养箱静置12 h或过夜培养。抽滤弃去沉淀后,获得1×10-1菌悬液。无菌水梯度稀释得到1×10-2、1×10-3、1×10-4、1×10-5、1×10-6和1×10-7不同浓度的菌悬液,各吸取200μL涂布于NA培养基,28℃恒温培养箱倒置培养1 d,间隔12 h观察菌落生长情况,挑取特征不同的单菌落画线纯化2~3次,-80℃保存备用[15]。
1.2.2 拮抗菌株的活性鉴定
初筛选菌种用局部枯斑法复筛获得具有生防潜力菌种,即取单菌落接种到25 mL NB培养基中,放置在30℃、180 r/min摇床中培养52 h,所得发酵液于10 500 r/min离心15 min除去菌体,上清液经细菌过滤器(0.45µm)过滤得无菌培养液[12]。
称取适量感病叶片,加少许绿色碳化硅研磨至匀浆,按1∶100(质量体积比)加入磷酸缓冲液配制成100倍TMV接种液,分别与NB培养基和无菌培养液等体积混合。选择叶片大小、长势一致的健康5~6叶期三生烟烟苗进行摩擦接种,右半叶接种NB培养基与病毒液的混合液为对照,左半叶接种无菌培养液与病毒液混合液为处理,接种5 min后用清水喷洒叶面。每株接种2~4个叶片,重复3次,早晚各喷清水1次。3 d后统计枯斑数,并计算抑制率[16](局部枯斑法)。

1.2.3 菌种鉴定
1.2.3.1 形态特征观察
用交叉划线法将拮抗菌株接种到LB培养基上,30℃恒温培养24~48 h,观察单菌落在培养基上的大小、颜色等特征;分别进行芽胞、荚膜、鞭毛染色,干燥后显微镜观察形态。
1.2.3.2 生理生化试验
依据细菌鉴定手册[17]进行生理生化试验,每组试验设置空白对照,重复两次。
1.2.3.3 菌株16S rDNA序列测序
用TIANGEN TIANamp Bacteria DNA Kit试剂盒(天根生化科技公司)提取细菌基因组DNA。依据吕翠等[18]的方法使用PCR进行菌落鉴定,扩增产物由上海生物工程技术公司测序。测序结果上传NCBI数据库进行Blast比对,下载同源性较高的属内菌株基因序列。利用Mega 7.0软件采用邻接法构建系统进化树。
1.2.3.4 全基因组测序
利用Illumina Miseq测序平台对Z5基因组DNA进行测序,使用soapdefve包进行组装,利用Glimmer软件对编码序列(CDSs)进行预测。利用在线平台tRNAscan-SE和RNAmmer分别对tRNA和rRNA进行鉴定。使用在线平台antiSMASH 2.0对次生代谢产物进行预测。
1.3 田间试验
在历年烟草普通花叶病毒病发病严重的烟田(湖南省长沙市宁乡烟草站)中进行拮抗菌株防治效果的小区试验。烟苗于3月中旬移栽,行株距为1.2 m×0.5 m。设置3个处理,分别为空白(清水对照),处理(Z5培养液,菌液浓度为6.1×106cfu/mL,直接喷雾),药剂对照(盐酸吗啉胍,800倍稀释液,3 kg/hm2),每处理4次重复,共计12个小区。各小区采取随机区组排列方式,每小区4行,每行栽烟60株。大田期共用药3次,第1次在移栽后10 d施药,第2次和第3次分别在移栽后15 d和移栽后20 d施药。施药方法:烟株正反面均匀喷雾,最后一次施药后30 d按照GB/T 23222—2008[19]调查烟草普通花叶病毒病发病情况,并计算各处理发病率、病情指数和防治效果。

1.4 发酵培养基的筛选
参考文献[12]的方法,拮抗菌株在NA培养基上平板划线,28℃恒温培养64 h后,挑取单菌落接种NB培养基,每500 mL锥形瓶中装200 mL培养基,28℃、180 r/min摇床培养64 h,得到的发酵液作为种子液用于后续试验。
基础培养基:备好装有60 mL的NB培养基、LB液体培养基和金氏液体培养基,在超净工作台中接种2 mL种子液于3种培养基上,3次重复,放置在28℃,180 r/min恒温摇床培养64 h后,发酵液用局部枯斑法进行抗病毒拮抗活性测定(方法同1.2.2节)。用平板菌落计数法来测定菌落生长情况,将培养的发酵液稀释至1×10-7,取100μL菌稀释液涂布于NA培养基,每处理3次重复,12 h后用菌落计数器计算菌落总数[12]。
最佳碳源、氮源:分别添加等量的麦芽糖、葡萄糖、蔗糖、乳糖和可溶性淀粉代替基础培养基的碳源;分别添加等量的鱼粉、蛋白胨、酵母膏、硫酸铵和硝酸铵替换基础培养基中的氮源,每处理3次重复,接种2 mL种子液后摇床培养64 h,筛选最佳碳源、氮源种类。
1.5 发酵条件的优化
参考文献[12]的方法,采用最适培养基发酵,分别对不同发酵条件进行优化筛选。发酵时间分别设置为24、36、48、60和72 h;初始pH分别设置为5.0、6.0、7.0、8.0、9.0、10.0和11.0;培养温度分别设置为20、24、28、32、36和40℃;装液量设置为250 mL的三角瓶中分别装入25、50、75、100和125 mL培养基。
以上试验每组处理接种2 mL的种子液,3次重复,确定最佳发酵条件。菌数计量方法同1.4节,菌株抗TMV活性的测定方法同1.2.2节。
1.6 数据处理
使用SPSS 17.0和Excel 2019软件对试验数据进行统计分析和制图,采用Duncan's新差复极法进行差异显著性检验。
2 结果与分析
2.1 拮抗菌株的筛选与活性鉴定
从土壤中共分离出细菌菌株64株,用局部枯斑法计算菌株抗TMV平均抑制率,筛选出5株菌株对TMV抑制率超过70%(表1),其中Z5无菌培养液对TMV拮抗效果最佳,抑制率达96.40%(图1)。

表1 分离菌株对TMV的抑制率Tab.1 Inhibition rates of isolated bacterial strains against TMV

图1 菌株Z5对TMV的拮抗活性Fig.1 Antagonistic activity of bacterial strain Z5 against TMV
2.2 拮抗菌株的鉴定分析
2.2.1 菌株形态
平板上的菌株Z5为白色不透明菌落,外表无光泽,边缘不规则,正面凸起,初期水渍、较粘,后期褶皱,呈扩散状。Z5内生芽胞,芽胞呈椭圆形,具荚膜和鞭毛,是两端钝圆的短杆状菌体。
2.2.2 生理生化试验鉴定
生理生化试验结果显示,除氧化酶试验、硫化氢试验、吲哚试验结果为阴性外,其他均为阳性(表2),结合菌落及菌体形态特征,初步鉴定菌株Z5为芽胞杆菌属(Bacillus)。

表2 菌株Z5的生理生化特性Tab.2 Physiological and biochemical characteristics of bacterial strain Z5
2.2.3 分子生物学鉴定
菌株测序结果通过NCBI比对,以NCBI中已发表的16S rDNA基因序列为基础,构建系统进化树。拮抗菌株Z5与贝莱斯芽胞杆菌(Bacillus velezensis)亲缘关系最近(图2),同源性达到99%以上。

图2 菌株Z5的16S r DNA系统进化树Fig.2 Phylogenetic tree of bacterial strain Z5 based on 16Sr DNA sequence
2.2.4 全基因组测序
通过测序和组装获得了贝莱斯芽胞杆菌Z5的基因组数据。其中包含3 913 900 bp,GC含量(质量分数)为46.5%,分布于283个contigs中。根据基因组数据,鉴定出1个5S-16S-23S操纵子、32个tRNAs和3 975个蛋白编码序列(CDSs)。
菌株Z5的基因组中含有多种合成抗菌代谢产物和抗生素(次生代谢产物)的基因簇,包括具有生物控制功能的脂肽(LP)和聚酮(polyketides)。通过antiSMASH 2.0预测,在菌株Z5中发现非核糖体肽合成酶(NRPSs),编码4'-磷酸腺苷基转移酶(phospho-pantheinyl transferase,Sfp)。Z5还包括表面活性素(surfactin)、丰原素(fengycin)、杆状肌动蛋白(bacillibactin)和杆菌霉素D(bacillomycin D)。
2.3 贝莱斯芽胞杆菌Z5的田间防治效果
田间小区试验烟苗发病情况调查结果(表3)显示,菌株Z5培养液处理的烟株发病率和病情指数较清水对照显著降低,Z5培养液对烟草普通花叶病毒病的田间防效达到50.43%,和盐酸吗啉胍800倍稀释液处理的防治效果(54.80%)差异不显著。

表3 Z5培养液对TMV的田间防效①Tab.3 Field control efficacy of Z5 culture solution against TMV
2.4 发酵培养基的筛选
培养基:Z5在3种培养基中生长情况不同,菌数差异显著,NB培养基中Z5菌数最多(5.79×1010cfu/mL),对TMV抑制率最高(98.02%)。因此,选用NB培养基进行后续发酵条件试验(图3A)。
碳源、氮源:以葡萄糖为碳源的培养基中菌株Z5菌数最多(5.68×1010cfu/mL),且发酵液抗病毒效果最好(97.18%)(图3B)。Z5在常见的氮源中生长存在明显差异,在酵母膏中的菌数最多,且病毒的抑制率最高(98.14%)(图3C)。因此,葡萄糖、酵母膏为最适碳源和氮源。

图3 培养基(A)、碳源(B)和氮源(C)对菌株Z5的菌数及其抗病毒活性影响Fig.3 Effects of culture mediums(A),carbon sources(B),nitrogen sources(C)on bacterial count and antiviral activity of bacterial strain Z5
2.5 发酵条件的优化
2.5.1 发酵时间对Z5抗TMV活性的影响
随着发酵时间的推移,菌数在稳定增长,并在培养72 h后达到最大值;同时菌株的抗病毒物质逐渐积累,48 h后抗病毒效果显著增强,60~72 h之间,逐渐稳定,病毒抑制率达94.14%,72 h时达到最大菌数4.91×1010cfu/mL(图4)。因此,选择72 h为最佳发酵时间。

图4 发酵时间对菌株Z5及其抗病毒活性的影响Fig.4 Effects of fermentation time on bacterial count and antiviral activity of bacterial strain Z5
2.5.2 初始pH对Z5抗TMV活性的影响
初始pH对菌体Z5的菌数和抗病毒效果的影响有显著差异(图5)。初始pH在7.0~10.0,较适合菌株生长,初始pH为10.0时菌数最多(6.35×1010cfu/mL),初始pH继续升高到11时,菌数骤降;对病毒抑制率也呈现相似的趋势,初始pH为7.0时抗病毒效果最好(97.14%)。综合分析认为,菌株Z5最佳发酵初始pH为7。

图5 初始p H对菌株Z5的菌数和抗病毒活性影响Fig.5 Effects of initial pH on bacterial count and antiviral activity of bacterial strain Z5
2.5.3 培养温度对Z5抗TMV活性的影响
在28℃条件下发酵,Z5的产菌数达到最大(6.98×1010cfu/mL),对病毒抑制率也最高(95.04%),低于和高于28℃时,Z5的产菌数出现了明显下降。36℃时Z5发酵液的抗病毒效果明显下降,40℃时产菌数远低于28℃,且病毒抑制率低于10%(图6)。可见,Z5的最佳发酵温度为28℃。

图6 不同温度对菌株Z5的菌数及其抗病毒活性的影响Fig.6 Effects of fermentation temperature on bacterial count and antiviral activity of bacterial strain Z5
2.5.4 装液量对Z5抗TMV活性的影响
装液量的不同对菌株的生长和病毒抑制效果有显著影响(图7)。当装液量为100 mL时,菌株Z5的产菌数达到最大(8.36×1010cfu/mL),同时对病毒抑制率达到最大(98.71%)。装液量低于或高于100 mL时,其产菌数和对病毒抑制率均有明显下降,出现了供氧不足的情况。因此,Z5的最适装液量为100 mL/250 mL。
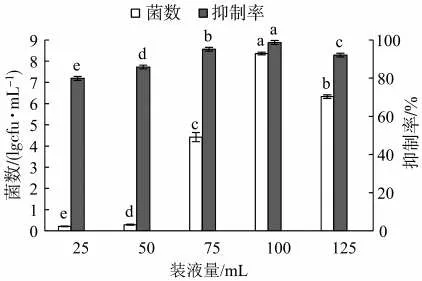
图7 不同装液量对菌株Z5的菌数及其抗病毒活性的影响Fig.7 Effects of medium volumes on bacterial count and antiviral activity of bacterial strain Z5
3 讨论
本试验中从湖南省长沙市芙蓉区耘园烟草普通花叶病发病植株根际土壤中筛选出1株对TMV拮抗效果良好的细菌菌株Z5,对TMV的枯斑抑制率高达96.40%,经形态学鉴定为贝莱斯芽胞杆菌。为增加菌株Z5的发酵产量和抗病毒活性物质产出,以Z5的菌数和对TMV的抑制率为主要评价指标,对发酵培养基和发酵条件进行优化,不同的培养基和不同的发酵条件产生的拮抗物质含量和抑制效果存在明显差异。Z5在以葡萄糖为碳源和以酵母膏为氮源的NB培养基上生长情况最好,更容易产生拮抗物质;优化试验结果表明菌株Z5的初始pH和发酵时间与多数芽胞杆菌属的试验结果一致,但培养温度和装液量有所差异[20-23],这可能是由菌株的遗传特性、生活环境或作用对象不同所致。贝莱斯芽胞杆菌Z5对TMV有明显的抑制作用,与申莉莉等[7-8]分离到的B.amyloliquefaciens菌株Ba33相似,该菌通过体外钝化、抑制侵染和诱导抗性等机制来抑制TMV的侵染。基于全基因组测序和功能预测,推测贝莱斯芽胞杆菌Z5产生的拮抗物质如表面活性素、杆菌霉素等脂肽类和聚酮类物质可能对病毒粒体的完整性造成破坏,会损伤细胞膜、细胞壁。Z5还可能会影响烟草的SA和JA信号通路,诱导系统抗性。但有关活性物质成分和作用机理、是否具有促进植物生长和其他作用等还需进一步的深入研究。此外,本试验中仅在摇床条件下对Z5培养基及发酵条件进行优化,而相关发酵工艺以及Z5发酵液与其他生物活性成分的复配等还需要进一步验证和完善。
4 结论
筛选鉴定出1株对TMV有明显抑制作用的贝莱斯芽胞杆菌Z5,对TMV抑制率为96.40%,贝拉斯芽胞杆菌Z5的最适培养基和发酵条件是采用NB培养基作为基础培养基,葡萄糖为碳源,酵母膏为氮源,初始pH 7.0,装液量100 mL/250 mL,培养温度28℃,发酵时间60~72 h。优化后菌数增长44.38%,对TMV抑制率稳定,可达到98.71%。田间小区试验对普通烟草花叶病毒病防效达到50.43%,与盐酸吗啉胍(可湿性粉剂)的防效基本相当。
