2DLC-MS/MS法测定人尿液中多环芳烃暴露生物标志物
2022-03-04王天南汪阳忠
王天南,陈 敏,汪阳忠,李 钢,费 婷,吴 达,陆 捷
上海烟草集团有限责任公司技术中心,上海市浦东新区秀浦路3733号 201315
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类重要的环境致癌化合物,被美国环境保护署(The United States Environmental Protection Agency)列为优先控制污染物[1-2]。人体PAHs暴露途径主要有吸入和摄入两大类[3],卷烟抽吸过程中的不完全燃烧会产生PAHs,为吸烟者带来暴露风险[4-7]。PAHs进入人体后会代谢生成多种羟基多环芳烃化合物(Monohydroxylated polycyclic aromatic hydrocarbons,OHPAHs)并随尿液排出[3]。尿液中OHPAHs的浓度是评价多环芳烃暴露水平的重要指标[8];其浓度通常在ng/L~μg/L水平,量极低且基质干扰严重,检测难度大。目前常用的分析方法有气相色谱-质谱联用(GC-MS)[9-10]、高效液相色谱-荧光 检 测(HPLC-FD)[11]和 液 相 色 谱-串 联 质 谱(LC-MS/MS)[12-19]法等。GC-MS法需要衍生化处理,过程繁琐、耗时长。HPLC-FD法通常用来检测尿液中浓度较高的羟基芘,难以满足其他低浓度OHPAHs的分析需求。目前,文献中报道以LC-MS/MS法为主,该方法灵敏度高、稳定性好,且不需要对样品进行衍生化处理,能够满足痕量OHPAHs的检测需求。但是由于OHPAHs的浓度低、干扰成分多,该方法需要采用液液萃取[13]、固相萃取[14]或搅拌棒吸附萃取[15]等前处理方法对目标物进行富集浓缩并降低杂质的干扰,常需要酶解、多步液液萃取、SPE小柱净化、吹干、复溶等复杂的样品前处理步骤,操作繁琐且耗时长。
因此,采用二维液相色谱-串联质谱(2DLC-MS/MS)技术[20-21],建立了尿液10种PAHs暴露生物标志物的新方法。该方法前处理简单,样品经酶解过滤后直接上机,无需萃取浓缩,目标物经一维色谱分离除杂、捕集柱富集浓缩及二维色谱梯度洗脱,实现了5种羟基菲同分异构体的基线分离,可成功应用于吸烟者和非吸烟者的尿液分析。
1 材料与方法
1.1 材料、试剂和仪器
采集6名吸烟者和6名非吸烟者的晨尿,保存于-80℃冰箱中。
1-羟基萘(1-OHNap)、2-羟基萘(2-OHNap)、2-羟基芴(2-OHFlu)、3-羟基芴(3-OHFlu)、1-羟基菲(1-OHPhe)、2-羟基菲(2-OHPhe)、3-羟基菲(3-OHPhe)、4-羟 基 菲(4-OHPhe)、9-羟 基 菲(9-OHPhe)、1-羟基芘(1-OHPyr)、2-羟基萘-d7(2-OHNap-d7)、13C6-3-羟 基 芴(13C6-3-OHFlu)、13C6-3-羟 基 菲(13C6-3-OHPhe)、1-羟 基 芘-d9(1-OHPyr-d9)(美国Cambridge Isotope Laboratories公司);β-葡萄糖醛酸酶(美国Sigma公司);乙腈、甲醇(AR,美国Tedia公司);乙酸、乙酸铵(AR,国药集团化学试剂有限公司);人工尿液(东莞创峰科技有限公司)。
1290液相色谱仪(配DAD检测器)、6495三重四极杆质谱仪(配备喷射流技术电喷雾离子源,AJS-ESI)、二元泵、六通阀、Eclipse PAH色谱柱(2.1 mm×100 mm,1.8μm)、Eclipse PAH色谱柱(2.1 mm×50 mm,1.8μm)(美国Agilent公司);Acquity UPLC BEH C18柱(2.1 mm×50 mm,1.7μm,美国Waters公司);LC-20AD单元泵(日本岛津公司);Eppendorf 5810R高速离心机(德国Eppendorf公司);Milli-Q纯水仪(美国Millpore公司);FiveEasy Plus型pH计(瑞士Mettler Toledo仪器公司)。
1.2 方法
1.2.1 标准溶液配制
标准储备液:用甲醇作溶剂,配制1-/2-OHNap的浓度均为5μg/mL、其余8种目标物的浓度均为1 μg/mL的标准储备液。
内标溶液:用甲醇作溶剂,配制2-OHNap-d7和1-OHPyr-d9的浓度均为10μg/mL、13C6-3-OHFlu和13C6-3-OHPhe的浓度均为5μg/mL的内标溶液。
系列混合标准工作溶液:用甲醇作溶剂,取标准储备液及内标溶液配制1-/2-OHNap的浓度分别为0.5、1.0、5.0、10.0、50.0和100.0 ng/mL,其余8种目标物的浓度分别为0.2、1.0、2.0、10.0、20.0和100.0 ng/mL,2-OHNap-d7及1-OHPyr-d9的浓度均为50 ng/mL,13C6-3-OHFlu和13C6-3-OHPhe的浓度均为25 ng/mL的6级混合标准工作溶液。
1.2.2 样品前处理
将预先收集的尿液样品解冻至室温,取5 mL于15 mL离心管中,依次加入30μL内标溶液、1 mL乙酸铵-乙酸缓冲液(pH=4.02)和10µLβ-葡萄糖醛酸酶,混合均匀后放入恒温槽中,37℃下避光酶解16 h。样品经0.2μm的PTFE滤膜过滤后上机分析。分析条件:
A.一维液相色谱条件。色谱柱:Acquity UPLC BEH C18柱(2.1 mm×50 mm,1.7μm);A相:水;B相:甲醇;进样量:20μL;流速:0~1.0 min 0.2 mL/min,16.0~26.0 min 0.1 mL/min,30.0 min 0.2 mL/min;梯度洗脱条件:0~5.0 min 5%B,15.0~16.0 min 50%B,25.0~30.0 min 100%B,30.1 min 5%B;柱温:30℃;DAD检测波长:280 nm。
B.二维液相色谱条件。色谱柱:Eclipse PAH柱(2.1 mm×100 mm,1.8μm);A相:水;B相:乙腈;流速:0.3 mL/min;柱温:30℃;梯度洗脱条件:0~26.0 min 5%B,30.0~65.0 min 33%B,65.1~70.0 min 95%B,70.1 min 5%B。
C.补偿流路条件。色谱柱:Eclipse PAH柱(2.1 mm×50 mm,1.8μm);流动相:水;流速:0.4 mL/min。
D.六通阀切换时间。0~19.0 min为第一维色谱分离除杂时间(阀1~阀2),19.0~26.0 min为捕集柱捕集阶段(阀1~阀6);26.0 min后回到初始状态(阀1~阀2),为第二维色谱分析时间。质谱流路在30.0 min打开,75.0 min关闭。
E.质谱条件。离子源:喷射流技术电喷雾离子源(AJS-ESI);扫描方式:负离子;监测模式:多反应监测(MRM);干燥气温度:230℃;干燥气流速:15 L/min;雾化器压力(Nebulizer):345 kPa;鞘气温度(Sheath gas temp):400℃;鞘气流速(Sheath gas flow):12 L/min;毛细管电压(Capillary):负压2 000 V;喷嘴电压(Nozzle voltage):负压2 000 V;RF高压(High pressure RF):负压210 V;RF低压(Low pressure RF):负压90 V。各物质及内标的定量离子对、碰撞能量(Collosion energy,CE)见表1。
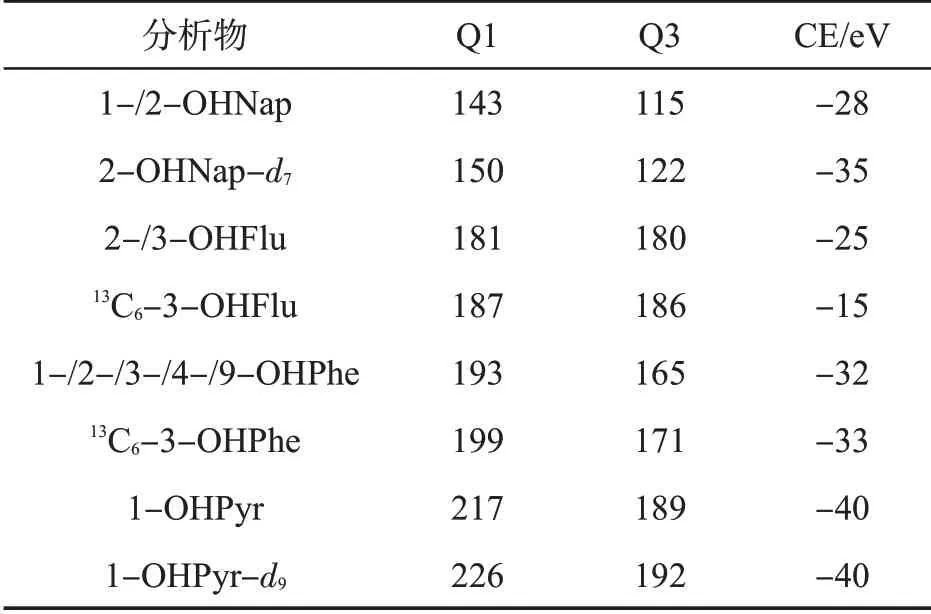
表1 OHPAHs分析的质谱参数Tab.1 MS parameters for OHPAHs analysis
2 结果与讨论
2.1 二维液相色谱串联质谱系统搭建
建立的反相-反相2DLC-MS/MS系统,两维间采用不同极性的流动相及固定相,具有良好的正交性。第一维色谱以水-甲醇体系为流动相,C18色谱柱分离除杂;第二维色谱以水-乙腈体系为流动相,PAH色谱柱分离后进入质谱仪分析;两维间通过在线稀释将目标流份切割至捕集柱保留。
系统的分析过程由捕集模式和分析模式组成,如图1所示,转移过程采用“正冲”(即洗脱的方向和富集的方向相同)的方式。捕集柱常采用第二维分析柱的保护柱(长1 cm),但由于本方法中1 cm的保护柱难以实现10种PAHs有效保留,故采用5 cm的分析柱作为捕集柱。由于分析柱有固定的流动相流进和流出方向,因此转移过程中采用“正冲”方式。

图1 2DLC-MS/MS系统中捕集模式(a)及分析模式(b)示意图Fig.1 Schematic diagrams of the trapping process(a)and analyzing process(b)in 2DLC-MS/MSsystem
2.2 一维液相色谱条件优化
标准样品和尿液样品中OHPAHs的一维液相DAD色谱图见图2。可知,通过调节一维流动相洗脱梯度,可除去绝大多数杂质,极大地降低尿液分析时的基质干扰和抑制效应。根据目标物出峰时间确定中心切割范围为19.0~26.0 min。为了平衡捕集效率和系统压力,实验中通过优化一维目标物出峰时体系流速及相应补偿泵流速比例,最终确定补偿泵流速为0.4 mL/min。

图2 尿液样品(a)和标准样品(b)中OHPAHs的一维液相DAD色谱图Fig.2 DAD chromatograms of the first dimensional LC of OHPAHs in urine sample(a)and standard sample(b)
2.3 二维液相色谱条件优化
5种羟基菲同分异构体的分离是检测的难点,目前文献报道的方法均无法对5种同分异构体分别准确定量[12-19]。本研究中通过捕集柱和二维色谱柱的选择,以及二维流动相梯度洗脱条件的优化,实现了5种羟基菲同分异构体的基线分离及准确定量。标准样品及吸烟者尿液样品中10种OHPAHs的MRM色谱图如图3所示。
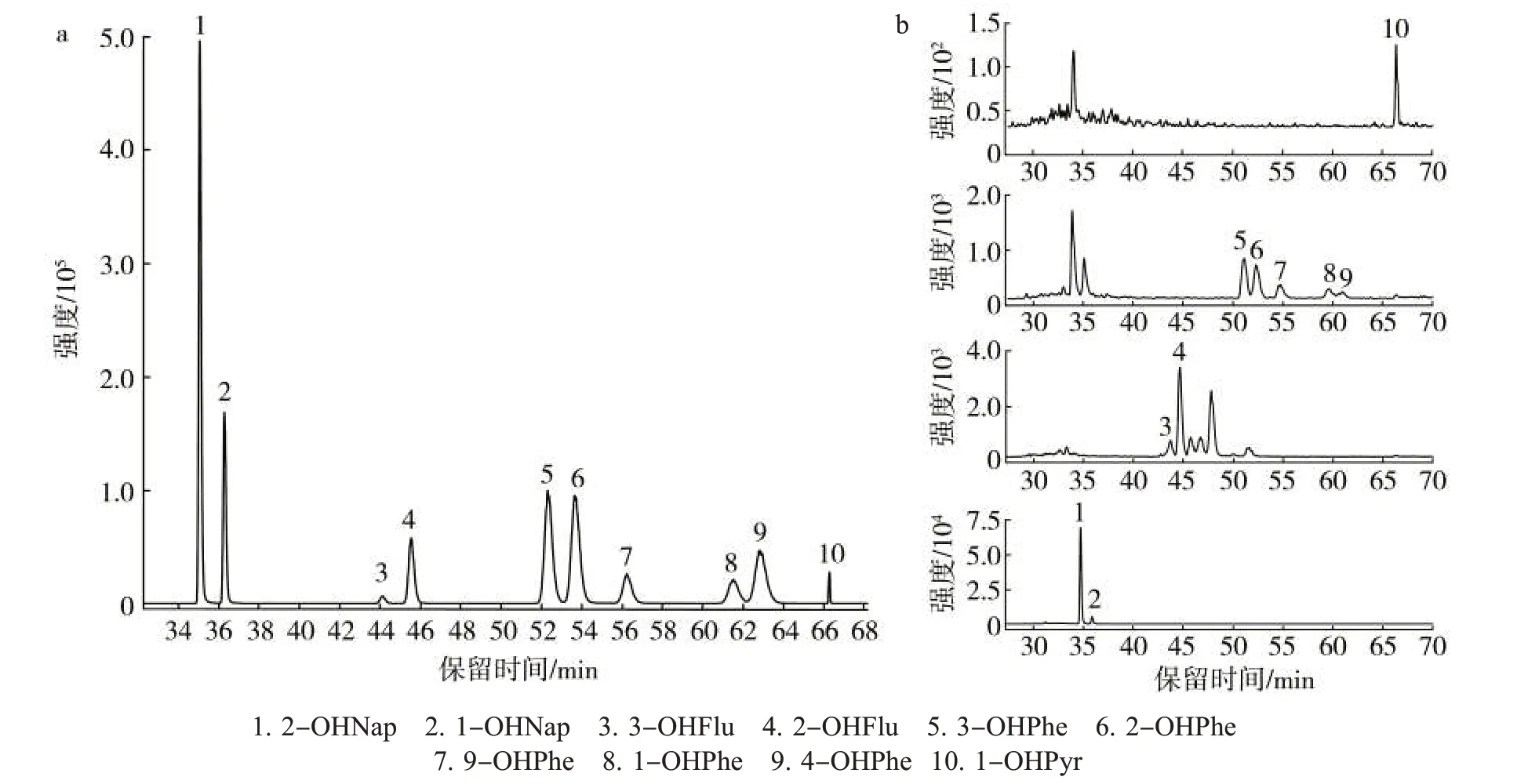
图3 标准样品(a)及吸烟者尿液样品(b)中10种OHPAHs的MRM图Fig.3 MRM chromatograms of 10 OHPAHs in standard sample(a)and smoker’s urine sample(b)
2.4 方法学验证
对标准工作溶液进行分析,以OHPAHs与对应内标的峰面积比为纵坐标,浓度比为横坐标进行线性回归,结果如表2所示,决定系数均大于0.99,线性关系良好。

表2 分析OHPAHs的线性方程、检出限及定量限Tab.2 Linear equations,LODs and LOQs for OHPAHs analysis
本方法的检出限和定量限分别为0.001~0.021和0.005~0.070 ng/mL,与文献[13-14,16]中报道的其他方法的检出限和定量限一致(表3),可满足尿液样品中痕量OHPAHs的检测需求。
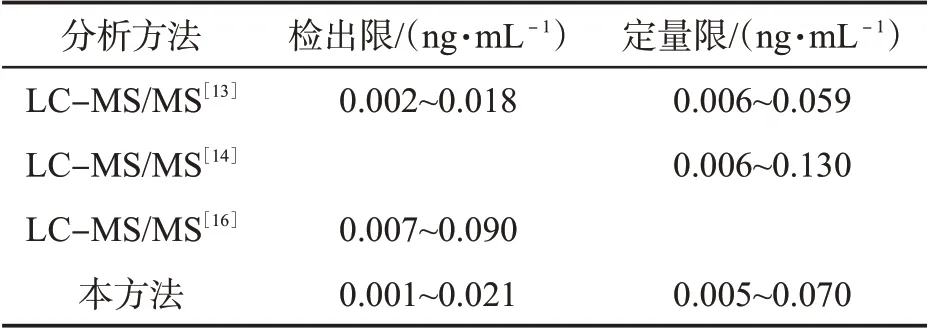
表3 本方法与其他方法检出限和定量限的比较Tab.3 Comparisons of LODs and LOQs between this method and other methods
对样品进行加标回收及日间和日内精密度考察,结果见表4。可知,尿液样品中目标物的回收率为87.9%~129.1%,样品的日内和日间RSD分别为1.1%~4.1%和1.4%~4.8%。表明方法的重复性好、稳定性高,满足日常检测需要。
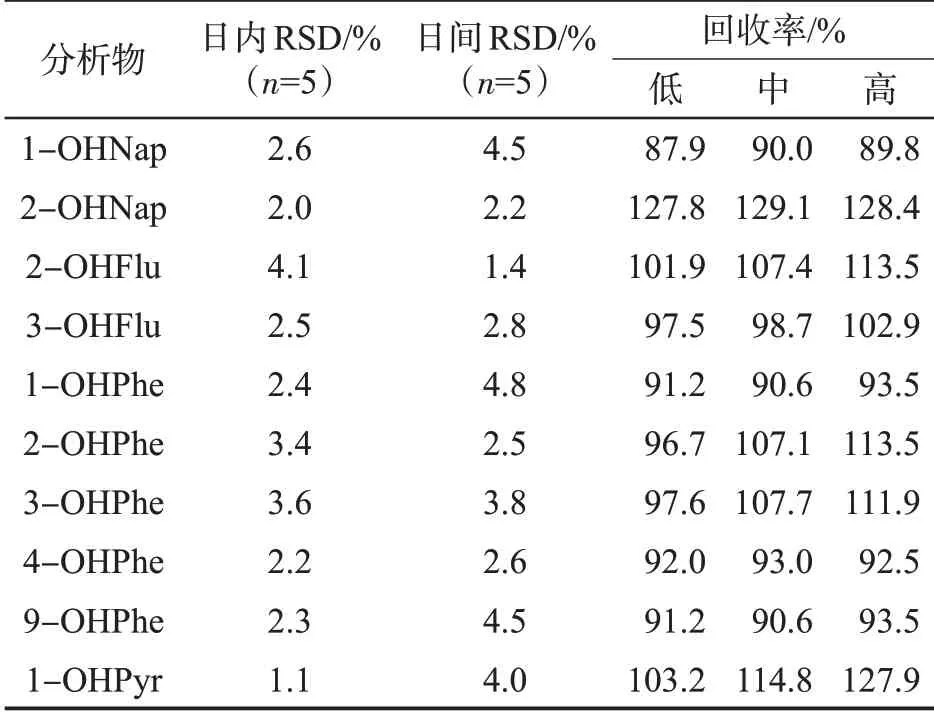
表4 方法的精密度和回收率Tab.4 Precisions and recoveries of this method
2.5 尿液样品分析
采用本方法分别对6名吸烟者、6名非吸烟者的尿液样品及5个人工尿液加标样品进行分析,结果见表5。可知,该方法能够满足不同类型尿液样品分析的需要。
由表5可知,吸烟者的分析结果存在明显的个体差异,可能与其吸烟习惯及个体代谢差异有关。此外,由于PAHs广泛存在于食品、环境、烟气及汽车尾气等中,因此非吸烟者尿液中也能检测到OHPAHs[15]。由吸烟者和非吸烟者尿液中10种OHPAHs检测结果可知,2-OHNap、1-OHNap和1-OHPry的浓度相对较高,4-OHPhe和9-OHPhe的浓度相对较低,且吸烟者与非吸烟者之间存在一定差异。本研究中吸烟者尿液中OHPAHs的浓度明显高于非吸烟者,以1-OHNap、2-OHFlu、3-OHFlu、4-OHPhe和9-OHPhe的差异最为显著。但是考虑到样本数量太少以及并未采用肌酐进行个体差异矫正,因此对吸烟者和非吸烟者尿液中OHPAHs的差异仍需进一步研究。本方法所测样品中OHPAHs的浓度范围与文献[12-15]的报道一致,可满足吸烟人群和非吸烟人群尿液中痕量OHPAHs准确测定的需求。

表5 (续)
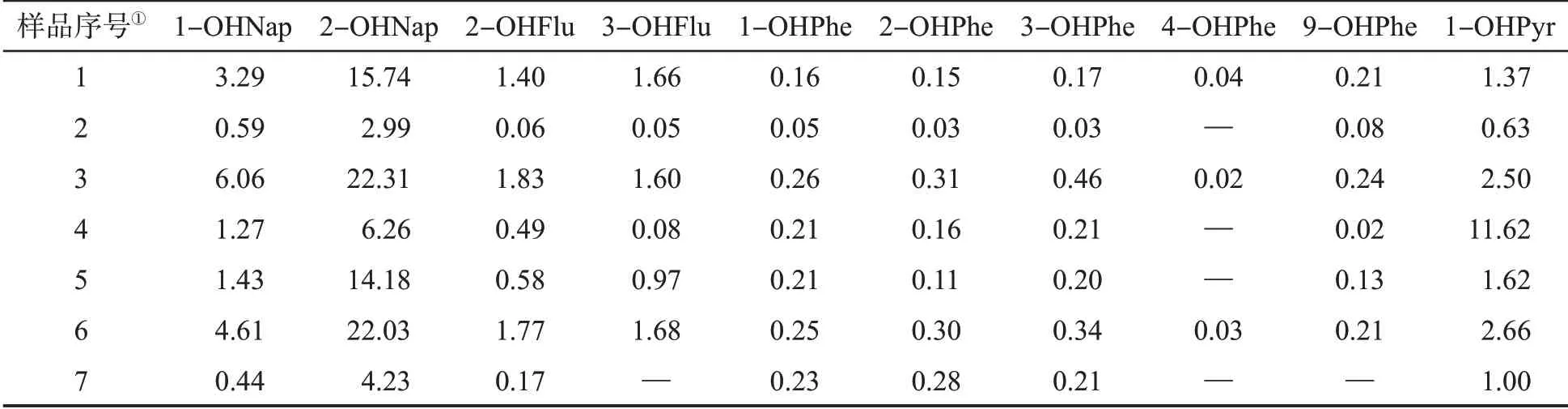
表5 尿液样品分析结果Tab.5 Analytical results of urine samples (ng·mL-1)
3 结论
①建立了人尿液中痕量多环芳烃暴露生物标志物的二维液相色谱-串联质谱分析方法,尿液样品仅需酶解过滤后可直接上机分析。②本方法无需萃取浓缩即可满足检测需求,同时有效解决了5种羟基菲同分异构体准确定量的难题,可用于吸烟者和非吸烟者尿液中OHPAHs的准确测定。③方法简单便捷、仪器全自动、结果可靠,可为烟气暴露风险评价提供更为高效、准确的技术手段,为吸烟与健康的深入研究提供有力支撑。
