老龄退行性心脏瓣膜病合并心房颤动病人血清炎性因子表达水平变化
2022-03-04齐玉婕陈伟刚谷云飞郭玉冰
齐玉婕,陈伟刚,谷云飞,郭玉冰
老龄退行性心脏瓣膜病(senile degenerative heart valvular disease,SDHVD)为临床常见心血管疾病(cardiovascular disease,CVD),是指心脏瓣膜结缔组织退行性变、纤维化、钙化而出现的瓣膜或其支架功能异常,导致瓣膜关闭不全和狭窄[1]。其患病率可随着年龄增长而增加,研究显示,我国患病率为3.5%~4.2%,而随着人口老龄化的加剧,其发生率逐年上升[2]。早期SDHVD并无明显症状,但随着年龄的增长,其损害也逐渐加重,改变心脏形态和功能、紊乱心脏血流动力学、诱发多种严重心血管系统并发症[3]。心房颤动(atrial fibrillation,AF)为SDHVD常见合并症,可加速疾病进程,影响预后。目前,临床尚无特效药物,治疗多以缓解临床症状为主。因此,研究其危险因素并给予早期干预具有重要意义。Monkebery首先发现人在自然衰老过程中可出现钙化性主动脉瓣狭窄,并认为是由退行性变导致,因此,既往研究多报道SDHVD与老化的关系[4]。但近年来研究表明,瓣膜组织对一些启动因子的反应贯穿了SDHVD整个病程,炎症反应就是其中一种[5]。本研究观察SDHVD合并心房颤动病人血清炎性因子表达水平变化,现报道如下。
1 资料与方法
1.1 一般资料 选取郑州大学附属洛阳中心医院心内科2018年1月—2019年1月收治的200例SDHVD病人,均经超声心动图确诊,根据是否合并心房颤动分为两组,心房颤动组72例,其中男48例,女24例;年龄60~82(68.19±5.23)岁;并发症:糖尿病38例,冠心病58例,高血压61例。非心房颤动组128例,其中男80例,女48例;年龄60~86(68.72±5.44)岁;并发症:糖尿病71例,冠心病105例,高血压102例。另选取同时期心内科收治的100例无心脏瓣膜钙化病人为对照组,其中男65例,女35例;年龄60~86(67.85±5.32)岁;并发症:糖尿病50例,冠心病75例,高血压78例。3组病人一般资料比较,差异均无统计学意义(P>0.05)。本研究经医院伦理委员会批准。
1.2 纳入与排除标准
1.2.1 纳入标准 SDHVD符合美国心脏协会《心脏瓣膜病病人管理指南(2017)》中的诊断标准,年龄≥60岁,近1个月无感染和抗生素使用史[6]。心房颤动经心电图确诊,符合欧洲心脏病学会《心房颤动管理指南》中的诊断标准[7]。病人及家属均签署知情同意书。
1.2.2 排除标准 慢性血液透析者;艾滋病、系统性红斑狼疮等免疫性疾病者;恶性肿瘤者;先天性心脏病、感染性心内膜炎、风湿性心脏病等其他心脏疾病者;甲状腺功能亢进、慢性肾功能不全、贫血等可导致钙磷代谢异常疾病者。
1.3 方法
1.3.1 超声心动图检查 选择飞利浦EPIQ7彩色多普勒超声诊断仪,探头频率2.5 MHz,指导受检者取左侧卧位或仰卧位,观察瓣膜钙化数量,并记录左心室射血分数(left ventricular ejection fraction,LVEF)、左心室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左心房内径(left atrial diameter,LAID)、舒张功能参数(E/A ratio)。
1.3.2 血清炎性因子水平检测 抽取病人清晨空腹静脉血5 mL,3 000 r/min离心10 min,离心半径14 cm,去底层沉淀,取上清液置于-80 ℃环境下保存,酶联免疫吸附法测定血清超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、白细胞介素-1β(interleukin 1β,IL-1β)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),试剂盒均由上海心语生物科技有限公司提供,所有操作严格按照说明书进行。

2 结 果
2.1 3组病人心功能比较 非心房颤动组LVEF、E/A均低于对照组,LVEDD、LAID均高于对照组,差异均有统计学意义(P<0.05);心房颤动组LVEF、E/A明显低于非心房颤动组,LVEDD、LAID明显高于非心房颤动组,差异均有统计学意义(P<0.05)。详见表1。
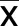
表1 3组病人心功能比较 (±s)
2.2 3组病人血清炎性因子水平比较 非心房颤动组血清hs-CRP、IL-1β、IL-8、TNF-α水平明显高于对照组,差异均有统计学意义(P<0.05);心房颤动组血清hs-CRP、IL-1β、IL-8、TNF-α水平明显高于非心房颤动组,差异均有统计学意义(P<0.05)。详见表2。
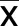
表2 3组病人血清炎性因子水平比较 (±s)
2.3 心房颤动组不同瓣膜病变数病人血清炎性因子水平比较 血清hs-CRP、IL-1β、IL-8、TNF-α水平随着瓣膜病变数增加而升高,差异均有统计学意义(P<0.05)。详见表3。
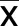
表3 心房颤动组不同瓣膜病变数病人血清炎性因子水平比较 (±s)
2.4 心房颤动组血清炎性因子水平与心功能的相关性 Pearson相关性分析显示,心房颤动组血清hs-CRP、IL-1β、IL-8、TNF-α水平与LVEF、E/A呈负相关(r=-0.489,P<0.05;r=-0.508,P<0.05;r=-0.561,P<0.05;r=-0.506,P<0.05;r=-0.674,P<0.05;r=-0.683,P<0.05;r=-0.683,P<0.05;r=-0.645,P<0.05);与LVEDD、LAID呈正相关(r=0.656,P<0.05;r=0.655,P<0.05;r=0.630,P<0.05;r=0.591,P<0.05;r=0.560,P<0.05;r=0.637,P<0.05;r=0.627,P<0.05;r=0.770,P<0.05)。
3 讨 论
SDHVD是一种与增龄相关的疾病,随着年龄的增长,人体器官会逐渐老化退变,而心脏为机体重要动力器官,其老化为必然趋势。心脏老化主要为瓣膜、膜环、心肌老化,研究显示,我国目前瓣膜病病人高达近100万人,65岁以上老年人出现主动脉瓣狭窄的概率为2%~3%,其中SDHVD为最常见致病因素[8]。SDHVD常并发多种心律失常,其中又以心房颤动最常见,主动钙化引起瓣膜关闭不全或狭窄,致使左心室增厚、肥大,进一步扩大左心房,增加其压力,损害心肌超微结构,异常增加心房肌异位起搏点兴奋性和自律性[9]。并发心房颤动后可继发心房附壁血栓,钙化斑块或栓子脱落可引起体循环栓塞,是导致病人残疾、死亡的重要原因,严重威胁老年人生命健康[10]。目前,对SDHVD的治疗尚无有效药物,而合并心房颤动后风险增加。既往研究多认为其是一个自然衰老的被动过程,但并不能完全解释SDHVD发病过程,随着研究的深入,越来越多研究表明,SDHVD并不是单纯与老龄化有关的退行性病变,还可能与瓣膜组织对某种启动因子的反应有关[11]。
Fukumoto等[12]研究显示,SDHVD的病理改变过程与动脉粥样硬化(atherosclerosis,AS)相似,是一种慢性炎症反应,炎性因子和免疫细胞参与了其发生及发展过程。一项病理组织研究发现,正常主动脉瓣膜几乎没有炎性细胞,早期瓣膜狭窄后则会引起泡沫样巨噬细胞和T淋巴细胞浸润,随着疾病的进展,钙化区域周围可出现大量T、B淋巴细胞聚集,并伴有肥大细胞(mast cells,MC)浸润,而肥大细胞本身含有中性蛋白酶、致炎因子、肝素、组胺等介质,当肥大细胞被激活时,这些介质则会参与瓣膜钙化(valvular calcification,VC)[13]。同时T、B淋巴细胞还可释放大量致炎因子,刺激内皮细胞、白细胞释放水解酶、生长因子、细胞趋化因子,缩短瓣膜钙化过程,加速病情进展[14]。C反应蛋白(CRP)为一种急性期反应蛋白,由人体肝脏合成分泌,可在白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、TNF-α等炎性因子刺激肝脏后合成。生理情况下,其血液中CRP含量极微,在手术创伤、组织损伤、炎症、细菌感染等应激反应下可显著提升,其反应水平与组织损伤程度成正比,同时还可参与炎症过程,促进巨噬细胞、粒细胞的吞噬作用,并激活补体系统,参与T淋巴细胞介导的免疫反应,随着病变消退、组织、结构、功能等恢复,其水平可逐渐恢复正常,目前已被作为预测心脑血管病的独立危险因子[15]。hs-CRP与CRP为同种物质,因其检测方法更灵敏而命名,相比CRP能更好地反映低水平CRP变化。IL-1为炎性因子级联反应始动因子,主要由白细胞介素-1α(IL-1α)和IL-1β组成,二者生物学活性相似,但IL-1α仅能于局部起作用,IL-1β则能于全身分泌并循环作用,为急性期炎性敏感和特异的指标,主要由活化的单核-巨噬细胞产生,过度分泌可促进成纤维细胞过度增殖,导致心肌纤维化,改变心肌细胞形态学,降低心肌收缩功能,还可促进TNF-α分泌,加重组织结构损伤[16-17]。白细胞介数-8(IL-8)是急性期快速反应蛋白,为趋化性细胞因子超家族成员,可激活血小板,释放颗粒,导致血小板黏附和聚集,促进血栓形成[18]。还能促进心肌细胞间黏附分子1、CD11、CD18高表达,引起级联反应,促进心肌细胞于中性粒细胞黏附,释放活性氯离子、髓过氧化酶、氧化自由基,损伤瓣膜组织和心肌细胞[19]。TNF-α为促炎细胞因子,由激活的单核-巨噬细胞分泌,可通过旁分泌和自分泌途径结合靶细胞上TNF-α受体发挥其生物学功能。生理状态下,其血清含量极低,在炎症、感染、肿瘤、组织损伤等情况下可迅速升高,能直接作用于血管内皮细胞,降低其通透性,损伤血管内皮功能,并能促进损伤局部激活释放炎症介质,诱导白细胞介素-2(IL-2)、IL-6、IL-8、细胞间黏附因子1等合成及释放强化炎性反应[20]。研究表明,成熟心肌细胞可分泌TNF-α,当心肌受损时则会大量释放,降低其收缩能力,促进心室重构,并能通过损伤血管内皮形态及功能,引起细胞器和细胞膜损害,参与心脏瓣膜钙化[21]。本研究结果显示,心房颤动组血清hs-CRP、IL-1β、IL-8、TNF-α水平明显高于非心房颤动组(P<0.05),非心房颤动组血清hs-CRP、IL-1β、IL-8、TNF-α水平明显高于对照组(P<0.05),心房颤动组不同瓣膜病变数病人血清hs-CRP、IL-1β、IL-8、TNF-α水平随着瓣膜病变数增加而升高(P<0.05),说明炎性因子参与了SDHVD发病,且随着其水平的上升,病情恶化越严重。既往研究认为,SDHVD在没有出现临床症状的亚临床阶段对瓣膜损害很小,不会出现明显血流流动力学变化[22]。但本研究结果显示,心房颤动组LVEF、E/A明显低于非心房颤动组(P<0.05),LVEDD、LAID明显高于非心房颤动组(P<0.05);非心房颤动组LVEF、E/A明显低于对照组,LVEDD、LAID明显高于对照组(P<0.05),提示早期SDHVD已出现心功能损伤,合并心房颤动后损伤进一步加重。分析心房颤动可大幅度增加心搏频率,影响心房收缩功能,降低射血量,导致心功能恶化。Pearson相关性分析显示,心房颤动组血清hs-CRP、IL-1β、IL-8、TNF-α水平与LVEF、E/A呈负相关(P<0.05),与LVEDD、LAID呈正相关(P<0.05),说明炎性因子水平变化与病人心功能有密切关系。分析是炎症反应能促进瓣膜钙化,致使瓣膜异常增厚,失去原有弹性,影响其开闭功能,最终导致心功能受损。
综上所述,SDHVD合并心房颤动病人血清炎性因子水平明显提升高,与病情严重程度相关,心功能随着炎性因子水平的升高而降低。
