黄芪多糖对慢性心力衰竭大鼠心肌细胞能量代谢的影响
2022-03-04刘莉莉王国良
刘莉莉,王国良
慢性心力衰竭(chronic heart failure,CHF)是各种心脏疾病发展的终末阶段,5年生存率与恶性肿瘤相似,且随着我国人口老龄化的加剧,CHF发病率呈逐年上升趋势,增加家庭及社会负担[1]。目前CHF的药物治疗以醛固酮拮抗剂、β-受体阻滞剂、血管紧张素转换酶抑制剂等神经内分泌抑制剂为主,尽管可取得一定临床疗效,但该病致残率及病死率仍居高不下[2-3]。研究发现,心力衰竭时心室扩大及功能异常的病理学机制可能与心肌能量代谢障碍有关,成为CHF治疗的新思路[4]。黄芪多糖(astragalus polysaccharides,APS)提取自补气中药黄芪,具有抗炎、抗氧化、增强免疫能力、降血糖、抗肿瘤等多种药理学活性[5]。近年来,有研究将APS用于糖尿病性心脏病的治疗,效果满意,且可改善脓毒症大鼠心脏功能,证明其在心脏系统疾病治疗中的作用[6-7]。然而,目前鲜有关于APS对CHF心肌细胞能量代谢的影响及相关机制的研究。鉴于此,本研究通过建立CHF模型大鼠,研究APS对其心肌细胞能量代谢的影响,并探讨相关机制。
1 材料与方法
1.1 实验动物 60只无特定病原体(SPF)级SD雄性大鼠,6周龄,体质量(200±20)g,来自华北制药股份有限公司[许可证号:SYXK(冀)2019-011]。饲养条件:温度22~26 ℃,湿度40%~60%,正常饮食、饮水。
1.2 药物、主要试剂和仪器 三磷酸腺苷(adenosine triphosphate,ATP)试剂盒(上海晶抗生物工程有限公司),凋亡细胞原位末端转移酶标记法(TUNEL)细胞凋亡原位检测试剂盒(上海通蔚生物科技有限公司),5-单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)和过氧化物酶体增殖物激活受体共激活因子-1(peroxisome proliferator-activated receptor γ coactivator-1,PGC-1α)单抗(美国Thermo Fisher Scientific公司),APS(西安明泽生物科技有限公司),AMPK抑制剂Compound C(美国Apexbio公司),卡托普利(四川太平洋药业有限责任公司),VEVO3100小动物超声成像系统(加拿大VisualSonics公司),1200高效液相色谱仪(美国Agilent公司),H-9500透射电镜(日本株式会社日立制作所),SM2010R徕卡切片机(德国徕卡显微系统贸易有限公司);IX71-F22FL/PH显微镜(日本Olympus株式会社);1658001 Mini-PROTEAN小型蛋白垂直电泳槽、ChemiDoc XRS化学发光成像分析系统(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 模型建立及分组 参照文献[8]采用腹主动脉缩窄法建立大鼠CHF模型。取60只SD大鼠,用2%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,仰卧位,用大鼠固定器固定,腹部常规剃毛、消毒,剑突下1 cm位置纵向切口,长度约2 cm,分离肾动脉上方腹主动脉,长度约1 cm。10只大鼠仅进行以上手术操作,不结扎腹主动脉,设为对照组。其余50只大鼠采用7号针头平行于腹主动脉放置,针头与腹主动脉一起结扎,结扎后抽出7号针头,抽针时以感觉到箍筋感为宜,使腹主动脉部分狭窄60%~70%。术后所有大鼠腹腔注射青霉素,每只2×105U/d,连续3 d。腹主动脉结扎后8周,如大鼠出现劳力性呼吸困难、呼吸急促、心动过速等失代偿性症状,且经小动物超声成像系统检查左室射血分数(left ventricle ejection fraction,LVEF)<50%,则提示建模成功。将建模成功的41只大鼠随机分为CHF组(10只)、挽回组(10只)、APS组(10只)、阳性药物组(11只)。
1.3.2 干预方式 APS组采用APS干预,结合前期实验研究结果及相关文献确定APS使用剂量为400 mg/kg,溶于5 mL生理盐水中灌胃给药,每天1次,药物干预后再采用生理盐水2 mL灌胃,8 h后重复采用生理盐水2 mL灌胃1次[9];挽回组采用APS+AMPK抑制剂Compound C干预,400 mg/kg APS灌胃给药,每天1次,Compound C水溶液2 mL(浓度10 μmol/L)灌胃,8 h后重复采用Compound C水溶液2 mL灌胃1次;阳性药物组采用卡托普利干预,卡托普利剂量为10 mg/kg,溶于5 mL生理盐水灌胃给药,每天1次,再采用生理盐水2 mL灌胃,8 h后重复采用生理盐水2 mL灌胃1次[10];对照组与CHF组先给予5 mL生理盐水灌胃,每天1次,再采用生理盐水2 mL灌胃,8 h后重复采用生理盐水2 mL灌胃1次。连续干预28 d。
1.3.3 超声心动图测定心功能指标 末次干预后4 h固定大鼠,采用超声心动仪测定心功能指标:LVEF、左室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular end systolic diameter,LVESD)、左心室短轴缩短率(left ventricular fraction shortening,LVFS)。
1.3.4 组织取材方式 心功能指标测定完成后脱颈处死大鼠,迅速分离其心脏,用生理盐水冲洗干净心脏表面血液,去除周围脂肪,滤纸吸干,沿房室沟减掉两心房、肺动脉、主动脉,紧贴室间隔右侧将右心室壁游离,剩余组织即为左心室。顺左心室中部横轴,取0.5 cm左右厚的左心室心肌组织用于测定ATP含量、观察心肌细胞线粒体结构、苏木精-伊红(HE)染色、TUNEL染色,剩余左心室组织保存于液氮中用于蛋白免疫印迹(Western Blot)实验。
1.3.5 测定心肌ATP含量 取左心室心肌组织,匀浆后12 000 r/min离心10 min(离心半径8 cm),取上清。以每孔50 μL置于96孔酶标板中,按照ATP试剂盒说明书要求采用高效液相色谱仪检测。采用考马斯亮蓝法(Bradford)测定样本总蛋白浓度,换算为nmol/mg·prot形式表示。
1.3.6 透射电镜观察心肌细胞线粒体结构 取左心室心肌组织,用4%戊二醛磷酸缓冲液固定30 min后,制成1.0 mm×1.0 mm×1.0 mm组织块,4 ℃固定,脱水、浸透、包埋、染色,制作成超薄切片,厚度50~70 nm,透射电镜下观察心肌细胞线粒体结构。
1.3.7 HE染色观察心肌组织病理变化 取左心室组织,采用40%多聚甲醛固定,流水冲洗30 min后乙醇脱水、二甲苯透明、浸润石蜡制作成蜡块,以病理切片机制作成5 μm连续切片,脱蜡后采用HE染色,显微镜下观察梗死区心肌组织病理变化。
1.3.8 TUNEL染色观察心肌细胞凋亡 取左心室心肌组织切片,用40%中性甲醛固定,脱水并包埋后采用病理切片机制作成连续切片,厚度4 μm,严格根据TUNEL细胞凋亡原位检测试剂盒操作要求进行,加入TUNEL反应混合液,于37 ℃湿盒中孵育,时间60 s,用磷酸缓冲盐溶液(PBS)充分冲洗,加入植物过氧化物酶(POD)转化剂,同条件继续孵育30 s,PBS充分冲洗,加入辣根过氧化物酶显色底物(DAB)溶液,常温孵育3 s,PBS溶液充分冲洗,苏木精复染,常规脱水后采用中性树胶封片,显微镜下观察心肌细胞凋亡情况。细胞核被染成不同程度棕黄色为凋亡细胞,凋亡率=阳性细胞数/细胞总数×100%。每张切片任选5个视野计数,求平均值。
1.3.9 Western Blot法检测心肌组织磷酸化腺苷酸活化蛋白激酶(p-AMPK)、AMPK、PGC-1α蛋白相对表达量 取液氮保存的心肌组织40 mg,研磨充分后转至离心管中,经裂解液冰上裂解30 min,用12 000 r/min离心10 min(离心半径8 cm),BCA蛋白定量试剂盒测定蛋白浓度,取30 μg待检测样本混合等体积上样缓冲液,沸水浴5 min,用12 000 r/min离心20 min(离心半径8 cm),取上清,12% SDS-PAGE分离,电转仪将条带转移至硝酸纤维素膜上,5%脱脂奶粉封闭2 h,加入兔抗大鼠一抗稀释液[p-AMPK、AMPK、PGC-1α单抗(1∶1 000)],4 ℃摇床孵育过夜,Tris缓冲生理盐水(TBST)洗涤,加入山羊抗兔IgG二抗(1∶10 000),室温孵育2 h,TBST洗涤。暗室显影,凝胶成像系统扫描分析条带灰度值,以p-AMPK、AMPK、PGC-1α与内参β-actin条带灰度值比值表示蛋白相对表达量。

2 结 果
2.1 各组心功能指标比较 各组LVEF、LVEDD、LVESD、LVFS比较,差异有统计学意义(P<0.05);与对照组比较,CHF组、挽回组、APS组、阳性药物组LVEF、LVFS均降低,LVEDD、LVESD均增加,差异有统计学意义(P<0.05);与CHF组比较,挽回组、APS组、阳性药物组LVEF、LVFS均升高,LVEDD、LVESD均降低,差异均有统计学意义(P<0.05);与挽回组比较,APS组、阳性药物组LVEF、LVFS均升高,LVEDD、LVESD均降低,差异均有统计学意义(P<0.05);APS组、阳性药物组LVEF、LVEDD、LVESD、LVFS比较,差异均无统计学意义(P>0.05)。详见表1。
表1 各组心功能指标比较 (±s)
2.2 各组心肌组织ATP含量比较 各组心肌组织ATP含量比较,差异有统计学意义(P<0.05);与对照组比较,CHF组、挽回组、APS组、阳性药物组心肌组织ATP含量均降低,差异有统计学意义(P<0.05);与CHF比较,挽回组、APS组、阳性药物组心肌组织ATP含量均升高,差异均有统计学意义(P<0.05);与挽回组比较,APS组、阳性药物组心肌组织ATP含量均升高,差异均有统计学意义(P<0.05);APS组、阳性药物组心肌组织ATP含量比较,差异无统计学意义(P>0.05)。详见表2。
表2 各组心肌组织ATP 含量比较(±s) 单位:nmol/mg·prot
2.3 心肌细胞线粒体结构 对照组心肌细胞线粒体结构正常,排列整齐,大小均匀;CHF组心肌细胞线粒体排列紊乱、大小不一、数量减少,可观察到明显空泡变性,肿胀线粒体嵴减少,大部分发生断裂,心肌细胞横纹、润盘模糊,间质中纤维结构数量增加,部分区域纤维溶解、断裂;挽回组、APS组、阳性药物组线粒体排列与大小变规则,数量逐渐增加,空泡变性及肿胀减轻,线粒体嵴增加,心肌横纹、润盘变清晰。3个干预组中阳性药物组改善最为明显,其次为APS组,最后为挽回组。详见图1。

图1 透射电镜观察心肌细胞线粒体结构(×20 000,标尺20 μm)
2.4 心肌组织病理变化 对照组心肌细胞排列致密、整齐,心肌横纹清晰;CHF组可观察到心肌细胞发生明显的变性及坏死,部分细胞核溶解、碎裂,部分心肌纤维变性、溶解、断裂,心肌横纹模糊或消失;挽回组、APS组、阳性药物组心肌细胞形态结构损伤有所减轻,心肌横纹较为清晰。3个干预组中阳性药物组改善最为明显,其次为APS组,最后为挽回组。详见图2。

图2 HE染色观察大鼠心肌细胞形态(×200,标尺100 μm)
2.5 各组心肌细胞凋亡情况比较 对照组、CHF组、挽回组、APS组、阳性药物组心肌细胞凋亡率分别为(3.57±0.46)%、(63.20±7.41)%、(31.97±4.58)%、(20.58±3.02)%、(12.54±1.57)%,各组凋亡率比较,差异有统计学意义(F=308.589,P<0.001)。与对照组比较,CHF组、挽回组、APS组、阳性药物组心肌细胞凋亡率均升高,差异均有统计学意义(P<0.001);与CHF组比较,挽回组、APS组、阳性药物组心肌细胞凋亡率均降低,差异均有统计学意义(P<0.001);与挽回组比较,APS组、阳性药物组心肌细胞凋亡率均降低,差异均有统计学意义(P<0.001);与APS组比较,阳性药物组心肌细胞凋亡率降低,差异有统计学意义(P<0.001)。详见图3。
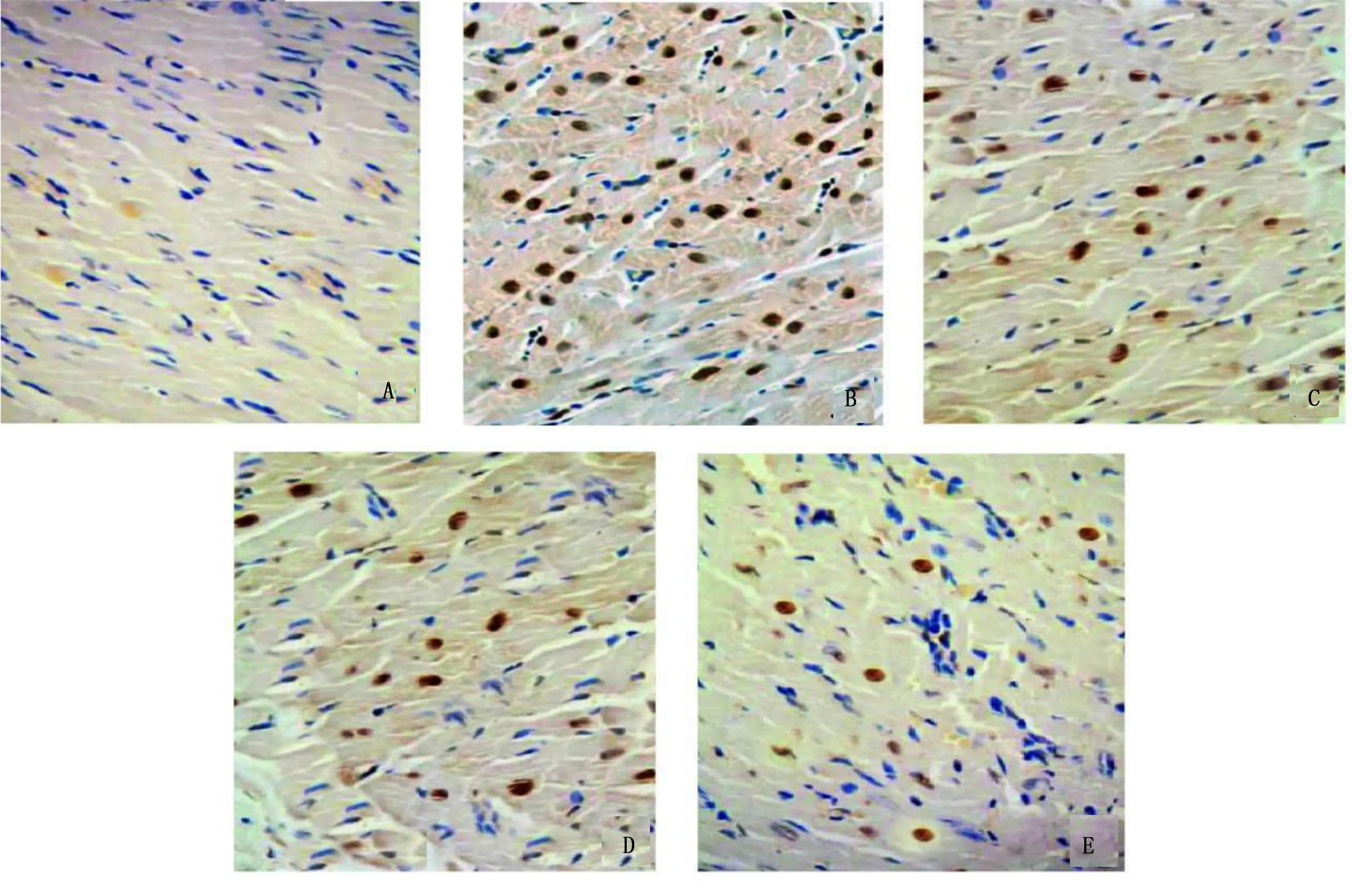
图3 TUNEL染色观察心肌细胞凋亡情况(×400,标尺50 μm)
2.6 各组心肌组织PGC-1α蛋白、p-AMPK/AMPK比较 各组心肌组织PGC-1α蛋白、p-AMPK/AMPK比较,差异均有统计学意义(P<0.05);与对照组比较,CHF组、挽回组、APS组、阳性药物组PGC-1α蛋白、p-AMPK/AMPK均降低,差异均有统计学意义(P<0.05);与CHF比较,挽回组、APS组、阳性药物组PGC-1α蛋白、p-AMPK/AMPK均升高,差异均有统计学意义(P<0.05);与挽回组比较,APS组、阳性药物组PGC-1α蛋白、p-AMPK/AMPK均升高,差异均有统计学意义(P<0.05);APS组、阳性药物组PGC-1α蛋白、p-AMPK/AMPK比较,差异无统计学意义(P>0.05)。详见表3、图4。
表3 各组心肌组织PGC-1α蛋白、p-AMPK/AMPK比较 (±s)

图4 心肌组织p-AMPK、AMPK、PGC-1α 蛋白表达条带图
3 讨 论
CHF是指心脏功能或结构异常导致心室射血能力或心室充盈受损而引发的一组临床综合征,以肺循环、体循环淤血及组织血液灌注不足为主要病理表现,最终导致心脏泵血功能降低[11]。研究显示,神经内分泌细胞因子过度激活导致的心室重构是CHF发展的基础[12]。心室重构是一种极为复杂的过程,与心肌细胞肥厚、凋亡、能量代谢、细胞外基质沉积、基因表达异常、多种基因相互作用等一系列分子、细胞机制关系密切,从而导致心肌表型、结构、功能改变[13]。随着CHF治疗从短期逆转血流动力学转变为长期、修复性策略,心室重构及心肌细胞能量代谢逐渐成为研究热点,有望为CHF治疗提供新策略。心肌收缩与舒张都需要足够能量供应,ATP是心肌组织唯一可直接使用的能源,经能量代谢途径存储在葡萄糖与脂肪酸中。心力衰竭时,ATP供应不足,导致心肌收缩-耦联障碍及收缩、舒张功能异常,从而诱发心力衰竭与能量代谢重构[14]。此外,心肌细胞凋亡在CHF中发挥重要作用,过度凋亡将导致心肌细胞数量不足,心肌收缩功能降低,引发CHF进行性恶化。本研究中,与CHF组比较,APS组LVEF、LVFS升高,LVEDD、LVESD降低,心肌组织ATP含量较高,心肌细胞线粒体结构、心肌组织病理变化较轻,心肌细胞凋亡率较低,提示APS可改善CHF大鼠心功能,改善心肌细胞能量代谢、心肌细胞线粒体结构破坏、心肌组织病理变化,减少心肌细胞凋亡。APS是中药黄芪的主要活性成分之一,除抗衰老、抗病毒、降血糖、调节免疫力、抗肿瘤等药理作用外,还具有抗血管内皮损伤、抗心律失常、抗心肌重塑及抗心肌缺血的功效,提示其可用于心血管疾病治疗[15]。陈彦等[16]研究显示,黄芪及其组分可保护心肌线粒体结构,激活生物氧化相关酶,调节肌酸激酶表达,从而发挥改善心肌能量代谢、延长心力衰竭进展的作用,本研究结果与其部分相似,提示APS在改善CHF心肌细胞能量代谢、减轻心室重构方面的优势。
AMPK/PGC-1α信号通路是新发现的缺血缺氧、能量代谢调节相关通路。AMPK是一种异源性三聚体结构,其催化亚基α亚基上第172位苏氨酸磷酸化后可激活AMPK,通过影响细胞物质代谢途径促进脂肪酸氧化及ATP生成,以维持细胞能量平衡,因此AMPK作为“能量调节器”及“细胞内燃料机”备受关注。PGC-1α是重要的能量代谢辅助调节因子,其作为AMPK下游效应分子,可被AMPK直接激活,通过促进线粒体生物合成控制心肌能量动态平衡。Quan等[17]研究发现,AMPK/PGC-1α信号通路与心肌缺血性损伤密切相关,心肌梗死后该通路表达水平明显下调,导致线粒体功能异常,心肌能量供应不足。既往动物实验发现,采用中草药混合物调节AMPK相关的葡萄糖代谢途径增加肝脏和肌肉中琥珀酸脱氢酶、苹果酸脱氢酶含量来改善糖原的储存[18]。本研究结果显示,CHF组、挽回组、APS组LVEF、LVFS依次升高,LVEDD、LVESD依次降低,心肌组织ATP含量依次升高,心肌细胞线粒体结构、心肌组织病理变化依次减轻,心肌细胞凋亡率依次降低,p-AMPK/AMPK、PGC-1α蛋白相对表达量依次升高,提示APS对CHF大鼠的治疗作用可能与激活AMPK/PGC-1α信号通路有关。
综上所述,APS可改善CHF大鼠心功能及心肌细胞能量代谢,减轻心肌细胞线粒体结构破坏及心肌组织病理变化,减少心肌细胞凋亡,推测其作用机制与激活AMPK/PGC-1α信号通路有关。
