柴胡皂苷a对颞叶癫痫神经的保护作用机制研究
2022-03-04戴其军
徐 沛,戴其军,柯 进
癫痫是以运动、感觉、自主神经或精神症状等为特征的发作性疾病。由于神经元异常放电,引起兴奋性谷氨酸及神经递质的大量释放,最终导致神经元变性坏死,其发作不仅会导致精神失常,也会诱发精神性癫痫发作[1]。而抗癫痫药物(AEDs)对一些癫痫病人有许多副作用,包括攻击性、激动性和易怒性等不良反应[2]。其中颞叶癫痫(TLE)是医学上较难治愈的一种癫痫,颞叶癫痫是最常见的手术效果较好的癫痫类型,但其对药物治疗不敏感,具有药物难治的特点[3]。研究表明,海人酸诱导的颞叶癫痫可引起血脑屏障(BBB)相关的星形胶质细胞活化及血脑屏障紧密连接(TJ)蛋白[如人血小板内皮细胞黏附分子-1(PECAM-1)、Claudin-5、紧密连接蛋白-1(ZO-1)]表达及分布的变化,这些均可能破坏血脑屏障的完整性并导致血脑屏障通透性改变[4-5]。此外,海人酸诱导的颞叶癫痫的一种标志性病理损害主要表现为海马区神经元丢失、神经胶质细胞的增殖等[6]。有研究表明,血脑屏障相关的星形胶质细胞和小胶质细胞活化,TJ相关蛋白(如PECAM-1、ZO-1和Claudin-5)表达水平的改变可能介导了海马CA3区的神经元损伤[7]。血脑屏障的完整性在海人酸诱导的颞叶癫痫引起的神经损伤中扮演着重要角色,调控TJ相关蛋白的表达,进而保护海马区神经细胞是治疗颞叶癫痫的关键[8]。近年来,柴胡皂苷a(SSa)被广泛运用于脑血管疾病的研究,它是一种来自药用植物柴胡的提取物。Hong等[9]的研究显示,在柴胡皂苷a治疗 8周后大鼠自发性复发性癫痫发作的频率和持续时间明显减少,并增加了钾离子通道互作蛋白(Kchip1)和钾离子通道Kv4.2的表达,进而上调Kv4.2介导的A型电压门控钾电流,抑制癫痫发作。在创伤性脑损伤模型(TBI)中,柴胡皂苷a通过抑制丝裂原活化蛋白激酶(MAPK)信号通路介导水通道蛋白-4(AQP-4)、基质金属蛋白酶9(MMP-9)的表达和抑制炎症反应,减弱了血脑屏障的破坏并改善了TBI后的神经功能缺损[10]。但是,关于柴胡皂苷a对于海人酸诱导的颞叶癫痫小鼠的神经损伤保护作用与血脑屏障关系的研究较少。因此,本研究利用海人酸致癫痫模型,探索柴胡皂苷a对海人酸诱导的颞叶癫痫小鼠引起的神经损伤的保护作用及与血脑屏障的关系,并找出关键靶点蛋白,为临床治疗癫痫提供依据。
1 材料与方法
1.1 实验动物 该实验符合《赫尔辛基宣言》的原则。成年雄性健康Swiss Hauschka小鼠56只,周龄16~20周,体质量25~30 g,由扬州大学比较医学中心提供,许可证编号:SYXK[苏]2017-0007,饲养环境温度22~25 ℃,相对湿度 50%~70%,自由饮食进水,分笼喂养。本实验获得海安市中医院伦理委员会批准,遵循国家卫生研究院实验室动物护理和使用指南。
1.2 主要试剂及仪器 阴离子荧光配体染料(Fluoro-Jade)(南京建成生物工程研究所),兔单克隆抗体神经元特异核蛋白[NeuN,美国CST公司],兔单克隆抗体ZO-1,ZONAB(美国赛默飞世尔科技公司),鼠单克隆抗体PECAM-1(美国Bio-Techne公司),脑立体定位仪(深圳瑞沃德生命科技),灌流机(美国Masterflex公司),全自动制冰机(佛山星星制冷设备),CM1850冰冻切片机(德国Lecia公司)。
1.3 实验方法
1.3.1 实验分组 将56只ICR小鼠随机分为对照组、海人酸组、柴胡皂苷a组、海人酸+柴胡皂苷a组,每组14只。
1.3.2 给药方法 对照组、海人酸组给予等体积的生理盐水灌胃,柴胡皂苷a组、海人酸+柴胡皂苷a组给予柴胡皂苷a灌胃:柴胡皂苷a 20 mg/kg,于术前3 d每天给药1次,连续干预3 d。末次灌胃1 h后,对照组及柴胡皂苷a组小鼠经侧脑室给予等体积生理盐水,海人酸组、海人酸+柴胡皂苷a组小鼠经侧脑室给予海人酸制备海人酸致痫模型。
1.3.3 模型制作 实验动物予以海人酸建立颞叶癫痫模型。2.5%异氟醚与70% N2O与30%O2混合气体将小鼠进行面罩麻醉后,利用2%异氟醚对其进行持续麻醉,并在此状态下进行手术。将小鼠固定在立体定位仪器中,通过立体定位仪注射海人酸至小鼠的单侧侧脑室。术后将动物放回饲养笼等待苏醒。实验动物在手术过程中体温维持在37 ℃左右,并于术后48 h取脑。
1.3.4 癫痫发作评估 Racine评分是用来评估癫痫发作的严重程度,其分数越高代表癫痫发作越严重。癫痫发作程度根据Racine评分标准进行判定:0级,无抽搐发作;Ⅰ级,耳、面部抽搐;Ⅱ级,肌阵挛,但无直立位;Ⅲ级,肌阵挛,伴直立位;Ⅳ级,全身强直阵挛发作;Ⅴ级,强直阵挛发作,并失去体位控制。
1.3.5 脑组织处理 所有实验动物根据脑组织用途不同而分为两组进行处死。第一组实验动物麻醉后进行心脏灌流并固定,脑取出后利用低温恒温组织切片机连续切取厚度为30 μm的脑组织并将其储存在磷酸缓冲盐溶液(PBS)中备用,进行免疫组织化学等染色;另一组实验动物经麻醉后直接断头取脑,并用医用手术刀取海马部分,然后储存在-70 ℃的冰箱备用。
1.3.6 F-JB荧光染色 将选好的脑组织切片放入高锰酸钾溶液中处理20 min后,再放入0.000 4% Fluoro-Jade B(Histochem,Jefferson,AR)的溶液中染色30 min,最后干燥后利用显微镜照相。注意全过程要进行避光处理。
1.3.7 免疫组织化学法 将选好的脑组织切片在0.3%过氧化氢溶液处理30 min,然后在NeuN、PECAM-1、ZO-1溶液中培养过夜;再将组织切片进行二抗及ABC处理,通过DAB进行显色。将组织贴片,脱水后,用加拿大香脂胶盖片。为了确认染色的特异性,对照染色用免疫血清来代替一抗其他步骤一致。
1.3.8 蛋白免疫印迹法(Western Blot) 取前期备好冷冻组织,提取蛋白后按照文献中提到的方法进行操作[7]。将备好的样本进行电泳后转印至聚偏二氟乙烯膜(PVDF),分别加入特异性抗体,然后加入相应的二抗,最后用化学发光法检测。用Quantity One软件对条带的密度进行分析,计算条带的平均密度值。

2 结 果
2.1 癫痫的发作程度 海人酸组Racine评分(4.70±0.58)分,海人酸+柴胡皂苷a组Racine评分(3.00±1.00)分,与海人酸组比较,海人酸+柴胡皂苷a组中小鼠癫痫发作程度明显减轻,差异有统计学意义(P<0.05)。
2.2 海马CA3区神经元细胞的表达 对照组及柴胡皂苷a组神经元细胞形态规则,排列整齐,而海人酸组海马CA3区神经元数量明显减少,排列紊乱。海人酸+柴胡皂苷a组的神经元细胞较海人酸组比较明显增多,但仍少于对照组及柴胡皂苷a组。详见图1。
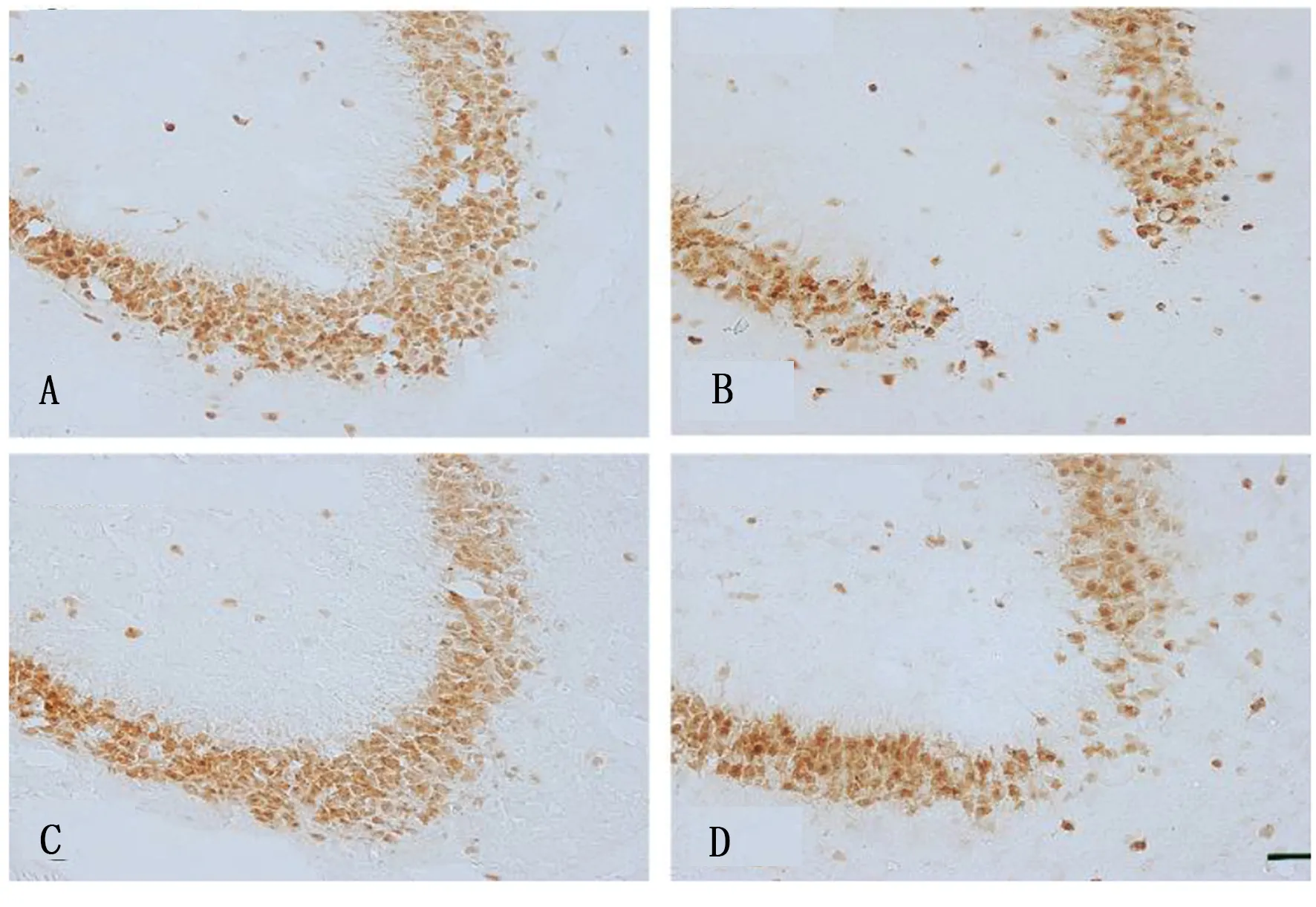
图1 海马CA3区NeuN的免疫组化
对照组NeuN数量百分比为(100.00±10.58)%,海人酸组为(48.00±5.00)%,柴胡皂苷a组为(95.00±11.36)%,海人酸+柴胡皂苷a组为(64.00±7.00)%。与对照组比较,海人酸组及海人酸+柴胡皂苷a组NeuN数量百分比明显降低,差异均有统计学意义(P<0.05);与海人酸组比较,柴胡皂苷a组及海人酸+柴胡皂苷a组NeuN数量百分比明显增加,差异均有统计学意义(P<0.05);与柴胡皂苷a组比较,海人酸+柴胡皂苷a组NeuN数量百分比明显降低,差异有统计学意义(P<0.05)。
与对照组和柴胡皂苷a组比较,海人酸组NeuN+细胞的免疫反应性明显降低,差异均有统计学意义(P<0.05)。海人酸+柴胡皂苷a组NeuN+细胞的免疫反应性与对照组和柴胡皂苷a组比较明显降低,差异有统计学意义(P<0.05),与海人酸组比较,免疫反应性明显升高,差异有统计学意义(P<0.05)。
2.3 海马CA3区神经元细胞的损伤 与对照组及柴胡皂苷a组比较,海人酸组FJ-B(+)神经元数量明显增加,而海人酸+柴胡皂苷a组FJ-B(+)神经元较海人酸组比较明显减少,但仍多于对照组及柴胡皂苷a组。详见图2。
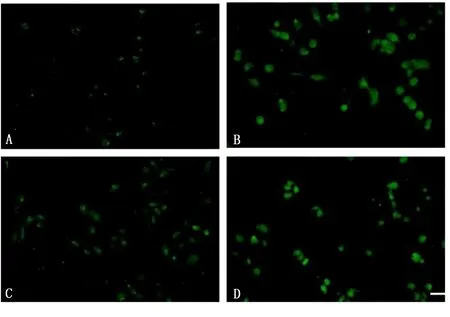
图2 各组海马CA3区FJ-B免疫组化染色
对照组FJB数量百分比为(100.00±10.00)%,海人酸组为(232.00±10.41)%,柴胡皂苷a组为(120.00±10.00)%,海人酸+柴胡皂苷a组(205.00±5.00)%。与对照组比较,海人酸组及海人酸+柴胡皂苷a组FJB数量百分比明显增多,差异有统计学意义(P<0.05);与海人酸组比较,柴胡皂苷a组及海人酸+柴胡皂苷a组FJB数量百分比明显减少,差异有统计学意义(P<0.05);与柴胡皂苷a组比较,海人酸+柴胡皂苷a组FJB数量百分比增多,差异有统计学意义(P<0.05)。
与对照组和柴胡皂苷a组比较,海人酸组损伤的神经元细胞明显增多,差异有统计学意义(P<0.05);与对照组和柴胡皂苷a组比较,海人酸+柴胡皂苷a组损伤的神经元细胞增多,差异有统计学意义(P<0.05);与海人酸组比较,海人酸+柴胡皂苷a组损伤的神经元细胞明显减少(P<0.05)。
2.4 海马CA3区PECAM-1的表达 与对照组及柴胡皂苷a组比较,海人酸组PECAM-1的免疫反应性明显升高。海人酸+柴胡皂苷a组PECAM-1免疫反应性与海人酸组比较略降低。与对照组及柴胡皂苷a组比较,其免疫反应仍升高。对照组PECAM-1免疫反应百分比为(100.00±3.46)%,海人酸组为(150.00±5.00)%,柴胡皂苷a组为(104.00±4.00)%,海人酸+柴胡皂苷a组为(120±6.08)%。与对照组比较,海人酸组及海人酸+柴胡皂苷a组PECAM-1免疫反应百分比明显升高,差异有统计学意义(P<0.05);与海人酸组比较,柴胡皂苷a组及海人酸+柴胡皂苷a组PECAM-1免疫反应百分比明显减少,差异有统计学意义(P<0.05);与柴胡皂苷a组比较,海人酸+柴胡皂苷a组PECAM-1免疫反应百分比明显升高,差异有统计学意义(P<0.05)。详见图3。
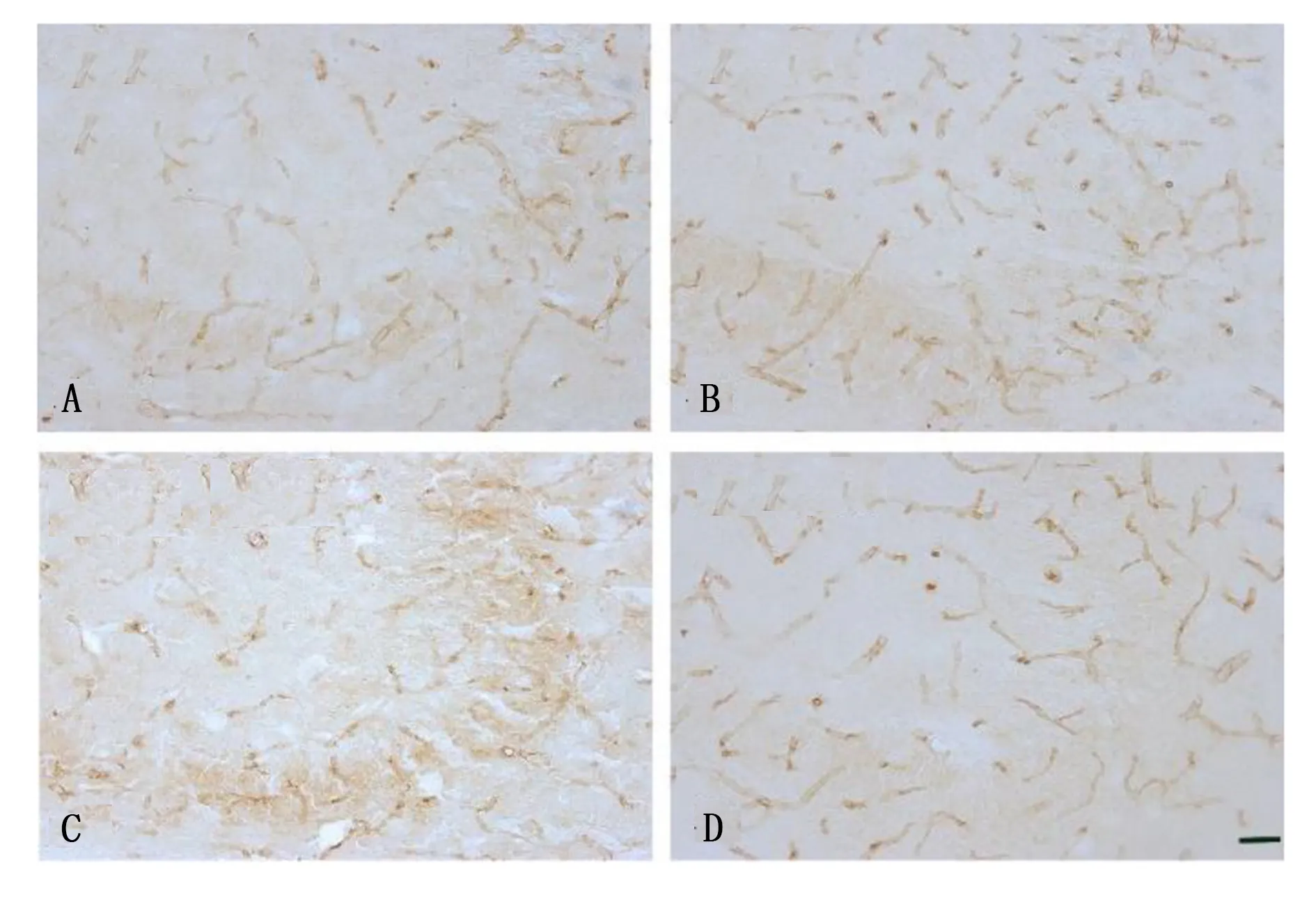
图3 各组海马CA3区PECAM-1的免疫组化
对照组及柴胡皂苷a组的海马CA3区通过免疫组化反应可检测到PECAM-1,海人酸组PECAM-1的表达较对照组和柴胡皂苷a组明显升高,差异有统计学意义(P<0.05)。与海人酸组比较,海人酸+柴胡皂苷a组海马CA3区PECAM-1免疫反应明显降低,差异有统计学意义(P<0.05);与对照组及柴胡皂苷a组比较,海人酸+柴胡皂苷a组海马CA3区PECAM-1免疫反应明显升高,差异有统计学意义(P<0.05)。
2.5 海马CA3区ZO-1的免疫反应 与对照组及柴胡皂苷a组比较,海人酸组的ZO-1的免疫反应性明显升高;海人酸+柴胡皂苷a组ZO-1免疫反应性与海人酸组比较略降低,与对照组及柴胡皂苷a组比较,其免疫反应仍升高。详见图4。
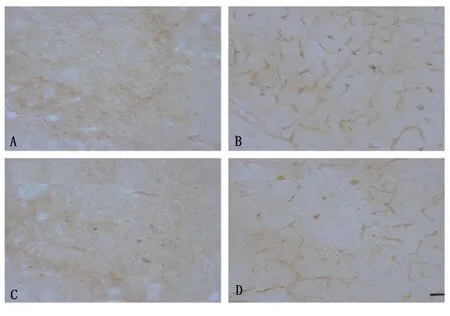
图4 海马CA3区ZO-1的免疫组化
对照组ZO-1免疫反应百分比为(100.00±4.36)%,海人酸组为(210.00±10.00)%,柴胡皂苷a组为(90.00±5.20)%,海人酸+柴胡皂苷a组为(150.00±10.00)%。与对照组比较,海人酸组及海人酸+柴胡皂苷a组ZO-1免疫反应百分比明显升高,差异均有统计学意义(P<0.05);与海人酸组比较,柴胡皂苷a组及海人酸+柴胡皂苷a组ZO-1免疫反应百分比明显减少,差异均有统计学意义(P<0.05);与柴胡皂苷a组比较,海人酸+柴胡皂苷a组ZO-1免疫反应百分比明显升高,差异均有统计学意义(P<0.05)。
与对照组和柴胡皂苷a组比较,海人酸组海马ZO-1免疫反应水平明显升高,差异有统计学意义(P<0.05)。海人酸+柴胡皂苷a组ZO-1蛋白水平与对照组和柴胡皂苷a组比较升高,差异有统计学意义(P<0.05);与海人酸组比较,海人酸+柴胡皂苷a组ZO-1蛋白水平则明显降低,差异有统计学意义(P<0.05)。
2.6 海马区蛋白印迹ZO-1及ZONAB的表达 与对照组、柴胡皂苷a组及海人酸+柴胡皂苷a组比较,海人酸组ZO-1的蛋白表达水平明显增加。与对照组、柴胡皂苷a组及海人酸+柴胡皂苷a组比较,海人酸组ZONAB的蛋白表达水平明显降低。对照组ZO-1蛋白印迹百分比为(100.00±10.00)%,海人酸组为(256.00±10.58)%,柴胡皂苷a组为(90.00±6.24)%,海人酸+柴胡皂苷a组为(120.00±6.00)%。对照组ZONAB蛋白印迹百分比为(100.00±8.00)%,海人酸组为(31.00±11.53)%,柴胡皂苷a组为(85.00±7.00)%,海人酸+柴胡皂苷a组为(149.00±13.89)%。与对照组比较,海人酸组ZO-1蛋白印迹百分比升高,差异有统计学意义(P<0.05);与海人酸组比较,柴胡皂苷a组、海人酸+柴胡皂苷a组ZO-1蛋白印迹百分比降低,差异均有统计学意义(P<0.05);与柴胡皂苷a组比较,海人酸+柴胡皂苷a组ZO-1蛋白印迹百分比升高,差异有统计学意义(P<0.05)。详见图5
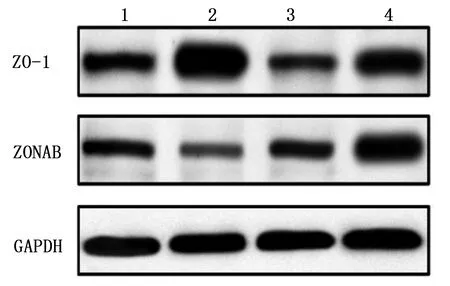
图5 海马CA3区ZO-1和ZONAB的蛋白表达条带图
与对照组和柴胡皂苷a组比较,海人酸组海马ZO-1蛋白水平明显升高,差异均有统计学意义(P<0.05)。海人酸+柴胡皂苷a组ZO-1蛋白水平相对于对照组和柴胡皂苷a组升高,差异均有统计学意义(P<0.05);与海人酸组比较,海人酸+柴胡皂苷a组ZO-1蛋白水平则是明显降低,差异有统计学意义(P<0.05)。
与对照组和柴胡皂苷a组比较,海人酸组海马ZONAB蛋白水平明显降低,差异有统计学意义(P<0.05);海人酸+柴胡皂苷a组ZONAB蛋白水平与对照组和柴胡皂苷a组比较明显升高,差异有统计学意义(P<0.05),与海人酸组比较,海人酸+柴胡皂苷a组ZONAB蛋白水平明显升高,差异有统计学意义(P<0.05)。
3 讨 论
柴胡性辛、苦,微寒,属辛凉解表药,归肝胆经,具有疏散退热、举气升阳之功效,用于治疗胸满胁痛、寒热往来[11]。现代研究表明,柴胡具有镇静、安定、镇痛、解热、镇咳等广泛的中枢抑制作用,而柴胡皂苷a具有镇静、抗抑郁和抗癫痫作用[12-13]。本研究发现,柴胡皂苷a可抑制小鼠颞叶癫痫的发作,这与以往的研究结果相一致。前期研究结果表明,海人酸诱导的颞叶癫痫其海马CA3区神经元死亡与血脑屏障损伤相关蛋白PECAM-1、ZO-1、Claudin-5早期的瞬时增加密切相关[7]。然而,很少有研究关于柴胡皂苷a对颞叶癫痫的神经损伤保护作用及与血脑屏障相关蛋白的关系。因此,本实验探讨了柴胡皂苷a对海人酸诱导的颞叶癫痫的神经损伤的保护及与血脑屏障的关系,并深入探讨了神经元损伤与血脑屏障之间的作用机制。
研究表明,颞叶癫痫病人最主要的病理学变化为海马硬化,其特征在于海马的CA1/CA3区中的选择性神经元丢失,而海人酸可以诱导强烈的去极化并最终导致细胞死亡,这与人类颞叶癫痫的病理特征相一致,且都是颞叶癫痫所具有的特殊病理表现[14-15]。Zhu等[16]研究发现柴胡皂苷a可通过抑制核转录因子-κB(NF-κB)信号通路和AQP4蛋白的表达来减轻炎症反应和脑细胞水肿,从而对大鼠急性脊髓损伤起到神经保护作用。因此,本试验通过柴胡皂苷a干预海人酸诱导的颞叶癫痫小鼠,采用NeuN及FJB免疫组化染色来观察其对颞叶癫痫小鼠的神经损伤保护作用,结果显示柴胡皂苷a干预后的颞叶癫痫小鼠海马CA3区神经元细胞损伤明显减少。
此外,研究表明,血脑屏障相关紧密连接蛋白(如ZO-1和Claudin-5)表达的早期短暂性增加以及PECAM-1表达的改变可能介导了海马CA3区中的神经元损伤。本研究结果显示,柴胡皂苷a干预后的颞叶癫痫小鼠海马PECAM-1、ZO-1表达水平较对照组明显下降。PCAM-1是血脑屏障的细胞黏附因子,在保持血管内皮细胞连接完整性和调节连接稳定性方面发挥着重要作用,并且可抑制循环血小板的活化以及维持血管内皮细胞(EC)连接的完整性[17]。研究表明,PECAM-1可能在外伤性中枢神经系统(CNS)损伤的进展中起关键作用,被认为可抑制CNS遭受免疫细胞产生的细胞毒性的破坏并预防与脑萎缩相关的持续性认知障碍的潜在治疗靶点,而ZO-1在维持TJ的稳定性、改善EC和内皮单层之间的细胞间转运具有重要作用[18-19]。ZO-1/ZONAB信号通路主要参与细胞增殖分化、器官发生与应激等病理生理过程的调控,有研究表明其可能与神经胶质细胞的增殖分化相关[20-21]。本研究结果表明,颞叶癫痫小鼠经过柴胡皂苷a干预后ZO-1蛋白的表达水平明显下降,而ZONAB的水平明显升高,其可能与维持血脑屏障的完整性及神经保护作用有关。
综上所述,柴胡皂苷a可抑制颞叶癫痫诱导的神经元损伤,并对维持血脑屏障稳定性有保护作用,其可能通过ZO-1/ZONAB信号通路所介导。
