阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌的预后分析
2022-03-04谭爱军彭新茂
谭爱军 彭新茂
[摘要] 目的 探讨阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌的预后。 方法 回顾性选取2020年1—10月湖南省脑科医院治疗的非小细胞肺癌患者98例作为研究对象,根据不同治疗方案分别纳入干预组(n=47)和对照组(n=51),对照组接受顺铂化疗,干预组接受阿替利珠单抗联合顺铂化疗,对两组的预后情况进行比较。 结果 干预组总缓解率高于对照组,差异有统计学意义(P<0.05)。干预组不良反应发生率与对照组比较,差异无统计学意义(P>0.05)。治疗后,干预组卡氏评分(KPS)、生存质量(FACT-L)评分均高于对照组,差异有统计学意义(P<0.05)。结论 阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌的疗效显著,不良反应发生较少,且可有效提高患者的生存质量。
[关键词] 阿替利珠单抗;顺铂化疗;非小细胞肺癌;预后
[中图分类号] R734.2 [文献标识码] B [文章编号] 1673-9701(2022)02-0080-04
Prognostic analysis of atezolizumab combined with cisplatin chemotherapy in the treatment of non-small cell lung cancer
TAN Aijun1, 2 PENG Xinmao2
1.Graduate School, Hunan University of Chinese Medicine, Changsha 410208, China; 2.Department of Tumor Hematology, Brain Hospital of Hunan (the Second People′s Hospital of Hunan), Changsha 410015, China
[Abstract] Objective To explore the prognosis of patients with non-small cell lung cancer (NSCLC) treated with atezolizumab combined with cisplatin chemotherapy. Methods A total of 98 patients with NSCLC who were treated in Brain Hospital of Hunan from January 2020 to October 2020 were selected retrospectively, and they were divided into the intervention group (n=47) and the control group(n=51) according to different treatment schemes. The control group received cisplatin chemotherapy, while the intervention group received atezolizumab combined with cisplatin chemotherapy. The prognosis of the two groups was compared. Results The total remission rate in the intervention group was higher than that in the control group, with statistically significant difference(P<0.05). There was no significant difference in the incidence of adverse reactions between intervention group and control group(P>0.05). After treatment, the KPS and FACT-L scores of the intervention group were higher than those of the control group, and the difference was statistically significant(P<0.05). Conclusion Atezolizumab combined with cisplatin chemotherapy is effective in the treatment of NSCLC with fewer adverse reactions, which can effectively improve the quality of life of patients.
[Key words] Atezolizumab; Cisplatin chemotherapy; Non-small cell lung cancer; Prognosis
肺癌是臨床上较常见的癌症之一,其死亡率在所有癌症中位于前列[1]。据报道指出,近年来全球范围内新增加的肺癌病例超过200万,而其中的死亡病例也超过180万。肺癌主要分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。超过80%的肺癌患者为非小细胞肺癌,且不少患者在确诊时已为晚期或已发生远处转移。既往研究表明,免疫检查点抑制剂在晚期肿瘤患者的治疗中能发挥较好的效果,而程序性死亡受体-1或其配体-1(programmed cell death-1/ligand-1,PD-1/PD-L1)是其中具有代表性的药物之一[3]。阿替利珠单抗属于PD-L1肿瘤免疫疗法,但目前国内关于阿替利珠对NSCLC的疗效及其预后的相关研究较少。本研究通过探讨阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌的预后,旨在为NSCLC患者临床用药方案提供参考,改善患者预后,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取2020年1月至2020年10月到湖南省脑科医院接受治疗的非小细胞肺癌患者98例作为研究对象,纳入标准:结合影像学和组织学检查确诊为非小细胞肺癌[2];预计生存时间超过3个月。排除标准:合并心、肝、肾等系统严重疾病者;有精神疾病史者;有本研究药物禁忌证者。根据不同治疗方案分别纳入干预组(n=47)和对照组(n=51),对照组,男28例,女23例,年龄43~74岁,平均(59.34±7.92)岁,平均病程(6.97±2.29)个月,鳞癌17例,腺癌27例,其他7例;TNM分期:Ⅲb期30例,Ⅳ期21例。干预组,男26例,女21例,年龄45~75岁,平均(60.34±8.12)岁,平均病程(7.18±2.35)个月,鳞癌15例,腺癌26例,其他6例;TNM分期:Ⅲb期27例,Ⅳ期20例。两组一般资料对比,差异无统计学意义(P>0.05)。本研究已经医院伦理委员会审核通过,患者均对本研究充分了解并签署知情同意书。
1.2 方法
对照组接受顺铂(江苏豪森药业股份有限公司,国药准字H20040813,201610063,30 mg/支)化疗,具体如下:第1天、第2天静脉注射给药,剂量75 mg/m2, 3周为1个疗程,连续治疗4个疗程。干预组接受阿替利珠单抗联合顺铂化疗,具体如下:在诱导期,第1天静脉输注阿替利珠单抗[Roche Diagnostics GmbH,S20200004,10218494,1200 mg(20 ml/瓶)],剂量为1200 mg,继之以静脉输注顺铂。第2天和第3天静脉输注顺铂,3周为1个疗程,连续治疗4个疗程。诱导期后是无化疗的维持期,在此期间每3周静脉输注一次1200 mg阿替利珠单抗。两组患者在治疗期间均给予水化、利尿等常规辅助治疗。评估两组的疗效、不良反应发生情况、卡氏评分(KPS)及治疗前后的生存质量。
1.3 观察指标及评价标准
1.3.1 总缓解率 实体瘤治疗效果评估,疗效分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。完全缓解(CR):患者临床症状全部缓解,病灶全部消失,且持续时间超过1个月;部分缓解(PR):患者临床症状有一定程度缓解,病灶最大直径及其最大垂直径和乘积减少程度超过一半,且持续时间超过1个月;疾病稳定(SD):患者临床症状改善不明显,病灶最大直径及其最大垂直径和乘积减少程度少于1/2,或增加不超过1/4;疾病进展(PD):患者临床症状加重,病灶最大直径及其最大垂直径和乘积增大程度超过1/4。总缓解率=(CR+PR)例数/总例数×100%。
1.3.2 不良反应发生情况 包括行动乏力、皮疹、骨髓抑制、间质性肺炎、免疫性肝炎、免疫性結肠炎、肾功能障碍等[4]。
1.3.3 健康状况 采用卡氏评分(Karnofsky performance score,KPS)对患者健康状态进行评估,得分为0~100分,得分越高,代表患者健康状况越好[5]。
1.3.4 生存质量 采用肺癌患者生存质量量表(FACT-L)进行评价,共36项,包括生理状况、社交及家庭状况、情感状况、功能状况、其他因素等维度,每项0~4分,得分越高,代表患者生活质量越高[6]。
1.4 统计学方法
采用SPSS 24.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,组间比较采用t检验;计数资料用[n(%)]表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
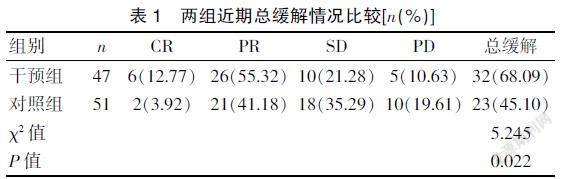
2.1 两组近期总缓解情况比较
干预组总缓解率高于对照组,差异有统计学意义(P<0.05)。见表1。
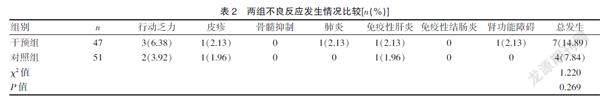
2.2 两组不良反应发生情况比较
干预组不良反应总发生率与对照组比较,差异无统计学意义(P>0.05)。见表2。
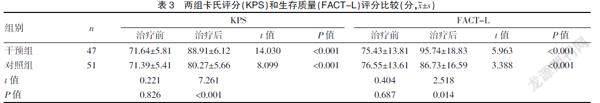
2.3 两组卡氏评分(KPS)和生存质量(FACT-L)评分比较
治疗后,干预组卡氏评分(KPS)、生存质量(FACT-L)评分均高于对照组,差异有统计学意义(P<0.05)。见表3。
3 讨论
顺铂是癌症治疗的常用药物之一,主要通过抑制癌细胞的DNA复制,从而发挥抗肿瘤的作用[7]。目前晚期NSCLC的治疗多采用以铂类为主的两种或三种的综合疗法[8]。随着医学技术发展,近年来,据徐泱等[9-10]指出,PD-1及其配体PD-L1在机体外周免疫耐受中发挥着重要的作用,而肿瘤细胞可通过PD-1/PD-L1轴,逃避T细胞对肿瘤的特异性免疫。基于此开发的PD-1/PD-L1抗体是安全有效的抗肿瘤治疗方式,而阿替利珠单抗是其中代表性药物之一[11]。本研究通过阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌的预后进行分析,为NSCLC患者的治疗方案提供参考根据。
本研究结果显示,干预组总缓解率比对照组高,差异显著,说明阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌的总缓解率明显高于单独应用顺铂的化疗,这主要由于,阿替利珠单抗能通过靶向结合肿瘤细胞及肿瘤浸润免疫细胞上的蛋白,阻断部分受体的相互作用,抑制PD-L1,从而激活T细胞,发挥抗肿瘤作用[12-13];另外阿替利珠单抗与顺铂同时发挥了其协同抗肿瘤作用,抑制肿瘤细胞DNA复制的同时也激活了T细胞的活性,提高了抗肿瘤的作用,使患者的病情有了明显的改善[14]。这也提示阿替利珠单抗有作为癌症免疫疗法、靶向药物等化疗方案的基础配伍疗法。干预组不良反应发生率与对照组比较,差异无统计学意义(P>0.05),说明阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌的不良反应发生率与单独应用顺铂化疗治疗非小细胞肺癌的不良反应发生率相比,差异无统计学意义(P>0.05)。这提示阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌不会增加不良反应的发生,安全性较高。谢建连等[15-16]的研究发现采用PD-1/PD-L1免疫检查点抑制剂对晚期非小细胞肺癌进行治疗,患者的安全性和耐受性均较好,不良反应发生较少。另外,本研究还对治疗前后阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌患者的卡氏评分(KPS)和生存质量(FACT-L)评分与单独应用顺铂化疗的患者进行了比较。结果发现,治疗后,干预组KPS评分、FACT-L评分均比对照组高,差异显著。说明阿替利珠单抗联合顺铂化疗治疗后,非小细胞肺癌患者的卡氏评分和生存质量评分均比单抗联合顺铂化疗治疗的患者高,差异显著。这提示阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌能有效改善患者的健康状况和生存质量,患者预后良好[17-18]。本研究为单中心对照,可能存在一定的局限性,其结论有待后续探讨。
综上所述,阿替利珠单抗联合顺铂化疗治疗非小细胞肺癌的疗效显著,安全性较好,可有效缓解患者病情,改善其健康状况,使其生存质量明显提高,更有效地改善患者预后。
[参考文献]
[1] Villalobos P,Wistuba II.Lung cancer biomarkers[J]. Hematol Oncol Clin North Am,2017,31(1):13-29.
[2] 李东航,姚颐,耿庆.中国临床肿瘤学会肺癌诊疗指南(2018版)更新解读[J].临床外科杂志,2019,27(1):36-39.
[3] Xia L,Liu Y,Wang Y. PD-1/PD-L1 blockade therapy in advanced non-small-cell lung cancer:Current status and future directions[J].Oncologist,2019,24(Suppl 1):S31-S41.
[4] 皋文君,刘砚燕,袁长蓉.国际肿瘤化疗药物不良反应评价系统——通用不良反应术语标准4.0版[J].肿瘤,2012,32(2):142-144.
[5] 郑文彩.基于癌毒理论探讨攻毒类中药在恶性肿瘤治疗中应用[J].中华肿瘤防治杂志,2019,26(S1):160,162.
[6] 徐力,鹿竞文,王君,等.社区综合管理方案对肺癌患者PSSS、EORTC QLQ-C30、FACT-L影响研究[J].中医临床研究,2019,11(8):1-5.
[7] Makovec T.Cisplatin and beyond:Molecular mechanisms of action and drug resistance development in cancer chemotherapy[J]. Radiol Oncol,2019,53(2):148-158.
[8] Griesinger F,Korol EE,Kayaniyil S,et al. Efficacy and safety of first-line carboplatin-versus cisplatin-based chemotherapy for non-small cell lung cancer: A meta-analysis[J]. Lung Cancer,2019,135:196-204.
[9] 徐泱,喻敏成. 抗PD-1/PD-L1抗体在肿瘤治疗中的研究[J]. 外科理论与实践,2018,23(3):227-235.
[10] Han Y,Liu D,Li L.PD-1/PD-L1 pathway:Current researches in cancer[J]. Am J Cancer Res,2020,10(3):727-742.
[11] 刘国强,康朔. 阿替利珠单抗联合标准化疗方案治疗广泛期小细胞肺癌的成本-效用分析[J].中国药房,2021, 32(1):77-81.
[12] Lee HT,Lee JY,Lim H,et al. Molecular mechanism of PD-1/PD-L1 blockade via anti-PD-L1 antibodies atezolizumab and durvalumab[J]. Sci Rep,2017,7(1):5532.
[13] Ancevski Hunter K,Socinski MA,Villaruz LC. PD-L1 testing in guiding patient selection for PD-1/PD-L1 inhibitor therapy in lung cancer[J].Mol Diagn Ther,2018, 22(1):1-10.
[14] Jotte R,Cappuzzo F,Vynnychenko I,et al. Atezolizumab in combination with carboplatin and nab-paclitaxel in advanced squamous NSCLC(IMpower131):Results from a randomized phase Ⅲ trial[J].J Thorac Oncol,2020,15(8):1351-1360.
[15] 謝建连,李瑾昱,刘哲峰. PD-1/PD-L1免疫检查点抑制剂对KRAS突变晚期NSCLC的疗效及安全性分析[J].解放军医学院学报,2020,41(6):588-592.
[16] 姜爱民,程宇.PD-1/PD-L1抑制剂治疗中晚期非小细胞肺癌疗效及安全性的meta分析[J].现代肿瘤医学,2020,28(20):3555-3560.
[17] 裴晓俊.甲磺酸阿帕替尼联合吉西他滨+顺铂化疗对晚期非小细胞肺癌患者疾病缓解率及卡氏评分的影响[J].中国药物与临床,2020,20(8):1349-1351.
[18] 何亚平,楼玮群,陈杰灵,等.病程12个月及以上非小细胞肺癌患者生活质量评估及影响因素研究[J].上海交通大学学报(医学版),2018,38(7):775-780.
(收稿日期:2021-06-15)
