癫痫清颗粒调控Sigma 1受体抑制阿尔茨海默病模型小鼠炎症小体研究
2022-03-04杨彩瑜李荧齐越明彩荣董笑博贾冬
杨彩瑜 李荧 齐越 明彩荣 董笑博 贾冬



[摘要] 目的 研究癲痫清颗粒是否通过调控Sigma 1受体的表达,抑制阿尔茨海默病(AD)模型小鼠炎症小体的活性。 方法 将小鼠随机分为假手术组、模型组、盐酸多奈哌齐组、癫痫清颗粒组、Sigma 1受体拮抗剂(BD1047)组和BD1047+癫痫清颗粒组。除假手术组外,其余各组小鼠的左侧侧脑室内注射淀粉样蛋白(Aβ25-35)制作AD小鼠模型,连续给药21 d,每日1次。第16天至第21天,Morris水迷宫试验检测小鼠的学习记忆能力,第22天,各组小鼠取材,HE染色观察脑组织病理学变化,免疫组化法及免疫印迹法检测核苷酸结合寡聚化结构域样受体蛋白1(NLRP1)、胱冬肽酶-1(caspase-1)的表达,免疫荧光法检测Sigma 1受体的表达。 结果 与模型组相比,癫痫清颗粒组可减少AD模型小鼠的游泳总路程,降低海马中NLRP1的表达,抑制caspase-1活性,增加Sigma 1受体表达。BD1047组与BD1047+癫痫清颗粒组小鼠中的游泳总路程与模型组小鼠相比,差异无统计学意义(P>0.05),NLRP1和caspase-1的蛋白表达水平升高,Sigma 1受体的表达降低。 结论 癫痫清颗粒可通过激活Sigma 1受体减少NLRP1表达,并抑制caspase-1活性,从而提高AD模型小鼠学习记忆功能。
[关键词] 癫痫清颗粒;阿尔茨海默病;炎症小体;Sigma1受体
[中图分类号] R749.16 [文献标识码] A [文章编号] 1673-9701(2022)02-0029-05
Inhibitory effect of Dianxianqing Granule on inflammasome of Alzheimer's disease model mice by regulating Sigma 1 receptor
YANG Caiyu1 LI Ying1 QI Yue1, 2 MING Cairong1 DONG Xiaobo1 JIA Dong2
1.Graduate School of Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China; 2.The Second Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110034, China
[Abstract] Objective To study whether Dianxianqing Granule inhibit the activity of inflammasome in Alzheimer's disease (AD) model mice by regulating the expression of Sigma 1 receptor. Methods The mice were randomly divided into sham operation group, model group, donepezil hydrochloride group, Dianxianqing Granule group, Sigma1 receptor antagonist (BD1047) group, BD1047+Dianxianqing Granule group. Excepted for the sham group, the AD mouse model was made by injecting amyloid (Aβ25-35) into the left lateral ventricle of mice in the other groups once daily for 21 consecutive days. From Day 16 to Day 21, the learning and memory ability of the mice was detected by the Morris water maze. On Day 22, the mice in each group were sampled. The histopathological changes were observed by HE staining. The expression of nucleotide-binding oligomerization domain-like receptor protein 1 (NLRP1) and caspase-1 was detected by immunohistochemistry and immunoblotting. The expression of the Sigma 1 receptor was detected by immunofluorescence assay. Results Compared with the model group, the Dianxianqing Granule group could reduce the total swimming distance, decrease the expression of NLRP1, inhibit caspase-1 activity and increase Sigma 1 receptor expression in the hippocampus of AD model mice. There were no statistically significant differences in the total swimming distance among the BD1047 group, the BD1047+Dianxianqing Granule group, and the model group(P>0.05). The protein expression levels of NLRP1 and caspase-1 in the BD1047 group and the BD1047+Dianxianqing Granule group were increased, and the expression of the Sigma 1 receptor was decreased. Conclusion Dianxianqing Granule can reduce NLRP1 expression and inhibit caspase-1 activity by activating the Sigma 1 receptor, thereby improving learning and memory function in AD model mice.
[Key words] Dianxianqing Granule; Alzheimer's disease; Inflammasome; Sigma 1 receptor
阿尔茨海默病(Alzheimer's disease,AD)为常见的神经系统退行性疾病,具体表现在学习记忆力的减退及认知功能损害等,除了β淀粉样蛋白(amyloid,Aβ)作为AD的主要病理特征外,近些年,学者们在研究AD发病机制的过程中普遍关注到,炎症小体产生的神经炎症反应是AD较为主要的病理变化特征[1]。大量研究可以发现,抑制炎症小体的活化可减轻AD小鼠脑组织中β淀粉样蛋白的沉积[2],改善学习记忆能力[3]。
Sigma 1受体(σ1R)在中枢神经系统内存在广泛,多位于神经元及神经胶质细胞内,是一种具有配体选择性分子伴侣。AD患者σ1R表达减少,炎症小体激活,并与学习记忆障碍密切相关。癫痫清颗粒为一种专利药(专利号:ZL 2011 1 0069494),具有熄风豁痰、通畅血脉、消散瘀滞、改善智力等疗效。前期研究表明,癫痫清颗粒可通过σ1R改善学习记忆能力,但是否与炎症小体有关,则尚不清楚。因此,本研究利用Aβ25-35诱导AD小鼠模型,并使用癫痫清颗粒和σ1R拮抗剂进行干预,观察癫痫清颗粒是否通过抑制炎症小体的活性改善AD,现报道如下。
1 材料与方法
1.1 材料来源
1.1.1 动物 选用SPF级ICR雄性小鼠[1](动物伦理审批号:SYYXY2020082702),共96只,体重为25~30 g,由辽宁长生生物技术股份有限公司提供,许可证号为SYXK(辽)2013-0009。
1.1.2 药物和试剂 ①癫痫清颗粒:由辽宁中医药大学附属第二医院提供,药品批号为20140110,规格:每克颗粒含有生药含量为5.31 g,剂型:颗粒剂,剂量:24 g/d、疗程:3个月;②盐酸多奈哌齐片:由卫材(中国)药业有限公司提供,药品批号140 606 A,规格:5 mg/片,剂型:片剂,剂量:10 mg/d,疗程:1个月;③Aβ25-35:来源于美国Sigma公司,货号;A4559;④核苷酸结合寡聚化结构域样受体蛋白1(NLRP1)抗体:由proteintech公司提供,货号:00065275;⑤胱冬肽酶-1(caspase-1)抗体:由北京Bioss生物技术有限公司提供,货号:AH11274428;⑥小鼠/兔IgG-免疫组化试剂盒:由BOSTER生物工程有限公司提供,货号:15I11BD22;⑦BD1047:由TOCRIS公司提供,货号:138356-21-5;⑧山羊抗兔IgG/辣根酶标记:由北京ZSGB-BIO生物技术有限公司提供,货号:ZB-2301,批号:141987;⑨Sigma受体蛋白抗体(Anti-OPRS1):由北京Bioss生物技术有限公司提供,货号:bs-5111R;⑩Cy3标记的羊抗兔IgG:由北京Bioss生物技术有限公司提供,货号:bs-0295G-Cy3。
1.1.3 仪器 DW-200型号脑立体定位仪(成都泰盟科技公司);10 μl微量进样器(上海高鸽微量进样器厂);MT-200型号Morris水迷宫(成都泰盟科技公司);Y迷宫(辽宁中医康复中心自制)。
1.2 方法
1.2.1 分组 96只小鼠于沈阳医学院适应性饲养5 d后,按照随机体重对照表将小鼠随机分成假手术组、模型组、BD1047组、盐酸多奈哌齐组、癫痫清颗粒组、BD1047+癫痫清颗粒组,每组小鼠各16只。
1.2.2 造模 350 mg/kg的水合氯醛麻醉小鼠后,固定,消毒。手术刀切开头部皮肤,快速找到囟门位置,以囟门为零点,向右移动1 mm,后移动0.5 mm,垂直深度为3 mm。于5 min内缓慢注入3 μl老化的Aβ25-35(1 mg Aβ25-35溶解到940 μl生理盐水中,37℃孵育120 h)。取适量青霉素钠粉末涂抹于伤口,小鼠放回笼中。
1.2.3 给药 AD模型制备后的第2天,各组小鼠按照组别分别灌胃给予相应的药物,癫痫清颗粒组(12.48 g/kg,按生药量计,每克颗粒含有5.31 g生药),盐酸多奈哌齐组(1.3 mg/kg),小鼠的给药剂量为20 ml/kg,同时,BD1047组腹腔注射给药,剂量为1 mg/kg。灌胃及腹腔注射给药均为21 d,每天1次。各组小鼠均无死亡且状态良好。假手术组和模型组同时给予等体积蒸馏水进行灌胃,BD1047组和BD1047+癫痫清颗粒组腹腔注射等体积生理盐水。
1.3观察指标及评价标准
1.3.1 Morris水迷宫定位航行实验 灌胃给药第16天,各组小鼠开始Morris 水迷宫行为学考察实验。Morris 水迷宫为圆筒状,底部直径80 mm左右、高 33 cm左右,顶部开口,将圆筒划分为4个象限中,并在桶壁上对4个象限区域进行标记。把平台放置在第一象限固定的位置。圆筒内水温保持在24~27℃,平台放置的位置应在水面1 cm以下。在实验过程中,记录小鼠从进入水中到成功登台的总距离。每只小鼠每天需要进行两次测试,每两次中间间隔的时间 3~4 h,不间断进行 5 d。
1.3.2 HE染色 第22天,每组取6只小鼠,用4%的多聚甲醛将其脑组织固定,脱蜡脱水,将切片厚度切至为4~5 μm,用常规方法对切片进行HE染色。
1.3.3 免疫组化检测NLRP1、caspase-1及免疫荧光检测σ1R表达 第22天,每组随机选6只小鼠进行免疫组化检测。5 μm的石蜡切片逐步进行脱蜡直至水化,經过3%过氧化氢灭活内源性过氧化酶后,高压方式进行抗原决定簇的暴露,封闭液封闭,加入适当浓度的一抗,4℃孵育过夜。PBS冲洗,免疫荧光实验加入相应的荧光二抗;免疫组化实验加入生物素化二抗后,用二氨基联苯胺(DAB)进行染色,阳性结果表现为沉淀于细胞内棕黄色的颗粒,各组阳性细胞平均光密度值采用JEOA801D形态学分析系统进行分析。
1.3.4 Western blot检测NLRP1 及caspase-1表达 第22天,每组取 4只小鼠快速断头,冰上分离出海马,称定质量。海马经蛋白裂解液裂取后提取出总蛋白,BSA法测定出小鼠海马组织中的蛋白浓度,灌制10%的凝胶进行电泳,100 mA,转膜时间为2 h,5%的脱脂牛奶封闭,相应浓度的一抗孵育后,4℃放置过夜。三羟甲基氨基甲烷缓冲盐溶液(TBST)洗涤后加入对应的二抗孵育,再次洗涤后加入特超敏 ECL化学发光试剂盒,采用凝胶成像系统观察相关蛋白的表达。Imaje J图像分析软件对目的条带进行灰度值分析。
1.4 统计学方法
采用SPSS 21.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示。水迷宫定位航行实验的组内不同时间比较,采用单因素重复测量方差分析;不同时间的组间比较采用多变量方差分析;组间指标变化趋势比较及组别与时间交互作用分析采用双因素重复测量方差分析。其余实验指标均采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 Morris水迷宫定位航行实验结果
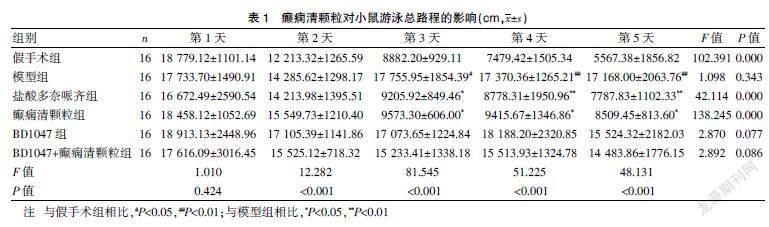
水迷宫定位航行实验双因素重复测量方差分析结果显示,组间F组别=98.613,P<0.001;时间F时间=96.522,P<0.001;交互作用F组别×时间=13.466,P<0.001,时间和组别有交互作用。见表1。
2.2 HE染色结果
与假手术组相比,模型组小鼠脑组织海马区神经元细胞排列紊乱,可见细胞水肿,细胞核淡染,核固缩。与模型组相比,癫痫清颗粒组和盐酸多奈哌齐组海马区神经元细胞排列有序,锥体细胞排列紧密,神经元细胞层数增加,部分神经元细胞的神经突触出现恢复。BD1047组及BD1047+癫痫清颗粒12.48 mg/kg组可见神经元细胞数目减少,排列疏松,核固缩较明显。见封三图1。
2.3 NLRP1和caspase-1免疫组化染色结果
与假手术组相比,模型组小鼠海马区域NLRP1和caspase-1表达明显增多;与模型组相比,癫痫清颗粒组和盐酸多奈哌齐组海马区域NLRP1和caspase-1阳性表达显著降低;BD1047组和BD1047+癫痫清颗粒组与模型组比较,差异无统计学意义(P>0.05)。见封三图2~3、表2。
2.4 σ1R表达结果
模型组小鼠海马区σ1R表达下降;与模型组相比,癫痫清颗粒组小鼠海马区域σ1R表达明显增加,BD1047组明显降低,BD1047+癫痫清颗粒组与模型组比较,差异无统计学意义(P>0.05)。见封三图4。
2.5 Western blot实验结果
与假手术组相比,模型组小鼠海马NLRP1与caspase-1的表达水平升高,差异有统计学意义(P<0.05);与模型组相比,盐酸多奈哌齐(1.3 mg/kg)组和癫痫清颗粒组小鼠脑内NLRP1与caspase-1表达明显降低,BD1047组明显升高,BD1047+癫痫清颗粒组与模型组比较,差异无统计学意义(P>0.05)。见图1、表3。
3 讨论
AD是一种破坏性神经退行性疾病,其特征在于神经元细胞的死亡和进行性痴呆的发生。目前的研究普遍认为,神经元细胞外Aβ的沉积和细胞内神经原纤维缠结的形成是AD发病的主要机制,但导致神经元功能异常的具体机制则尚不清楚。Martinon等[6]于2002年首次报道炎症小体后,炎症小体在AD中的作用引起学者们的广泛关注。组成炎症小体的受体蛋白大部分来自Nod样受体家族,包括NLRP1、NLRP3、NLRC4、NLRP6、NLRP7和NLRP12。其中NLRP1是首个报道的炎症小体。NLRP1在机体内的功能主要涉及细胞程序性死亡、慢性炎症和免疫应答反应等多方面,是机体内慢性炎症的主要参与者[7-10],并与AD神经元功能异常密切相关。NLRP1为在细胞中表达的多蛋白复合物,由细胞内模式识别受体及caspase-1前体蛋白组装而成,受外源物质刺激后,组装后的炎症小体可促使NLRP1发生自身寡聚化,激活 caspase-1,引发炎症反应[4];因此,抑制炎症小体的活化可改善AD神经元细胞的功能异常,进而改善学习记忆障碍。在APP/PS1转基因小鼠脑内,NLRP1活化后,可形成NLRP1-caspase-1级联反应通路,加速学习记忆损害[11-12],使用NLRP1炎症小体抑制剂则具有增强学习记忆能力的作用[2,3,13]。本研究结果表明,癫痫清颗粒可降低海马中NLRP1的表达,抑制caspase-1活性,增加神经元细胞数量,减少AD模型小鼠的游泳总路程,具有改善学习记忆障碍的作用。
σR最初归类于阿片类受体的亚型,因其不能与阿片受体拮抗剂(如纳洛酮)结合,这种观点随后得到了修正。随着科学家们对σR受体的深入研究,人们对σR受体有了全新的认识和理解。σR存在两种亚型:σ1R和σ2R。其中,σ1R有223个氨基酸,分子量为25.3 kDa,在中枢神经系统多个区域的神经元和神经胶质细胞中均有表达,在细胞中分布于核膜、线粒体膜和质膜区域,并在内质网和线粒体相关的内质网膜内富集。σ1R参与调节与神经退行性疾病相关的生物学机制,具有延缓记忆减退、神经保护与再生的作用,近年来得到了广泛关注。研究人员使用SA4503正电子发射断层扫描技术对AD患者脑中的σ1R定位发现,与正常人相比,AD患者脑内σ1R密度显著降低,激活σ1R则可改善学习记忆障碍[3]。
动物实验表明,转基因AD模型鼠脑中σ1R表达下降[16-17],神经元损伤,学习记忆功能障碍。σ1R作为一种具有配体选择性的分子伴侣,可通过NF-κB途径,诱导NLRP1活化[15]。由此可推测,增加σ1R的表达,可抑制NLRP1活化,保护神经元,改善学习记忆能力。在本研究給予AD模型小鼠σ1R拮抗剂BD1047后发现,BD1047组中NLRP1与caspase-1表达增强,说明σ1R与AD模型中NLRP1炎症小体活性有关。给予癫痫清颗粒后,σ1R表达增加,NLRP1与caspase-1活性降低,说明癫痫清颗粒可通过σ1R抑制AD模型小鼠中的炎症小体的活性,保护神经元,改善其学习记忆能力,发挥抗AD作用。
[参考文献]
[1] Baban S. Thawkar,Ginpreet Kaur.Inhibitors of NF-κB and P2X7/NLRP3/Caspase 1 pathway in microglia:Novel therapeutic opportunities in neuroinflammation induced early-stage Alzheimer′s disease[J].Journal of Neuroimmunology,2019,326(2018):62-74.
[2] D'Angelo C,Costantini E,Salvador N,et al. nAChRs gene expression and neuroinflammation in APPswe/PS1dE9 transgenic mouse[J]. Scientific Reports,2021,11(1):9711.
[3] Thiyagarajah MT,Herrmann N,Ruthirakuhan M,et al. Novel pharmacologic strategies for treating behavioral disturbances in Alzheimer's disease[J]. Current Behavioral Neuroence Reports,2019,6(4):72-87.
[4] Lv YC,Gao AB,Yang J,et al. Long-term adenosine A1 receptor activation-induced sortilin expression promotes α-synuclein upregulation in dopaminergic neurons[J]. Neural Regeneration Research,2020,15(4):712-723.
[5] Wang H,Wei GD,Cheng S,et al. Circulatory CD4-positive T-lymphocyte imbalance mediated by homocysteine-induced AIM2 and NLRP1 inflammasome upregulation and activation is associated with human abdominal aortic aneurysm[J]. Journal of Vascular Research,2020,57(5):276-290.
[6] Martinon F,Burns K,Tschopp J. The inflammasome:A molecular platform triggering activation of inflammatory caspases and processingof proIL-beta[J]. Mol Cell,2002, 10(2):417-426.
[7] Kim YK,Shin JS,Nahm MH. NOD-Like receptors in infection,immunity,and diseases[J]. Yonsei Med J,2016,57(1):5-14.
[8] 李庆菊,潘韵铮,张琦,等.丹酚酸B调节SIRT1信号途径抑制H2O2诱导的NLRP3炎症小体激活[J].中药新药与临床药理,2021,32(5):604-611.
[9] Yu CH,Moecking J,Geyer M,et al. Mechanisms of NLRP1-mediated autoinflammatory disease in humans and mice[J]. J Mol Biol,2017,430(2):142-152.
[10] Feria MG,Andrea TN,Hernandez JC,et al. HIV replication is associated to inflammasomes activation,IL-1β,IL-18 and caspase-1 expression in GALT and peripheral blood[J]. PLoS One,2018,13(4): e0192 845.
[11] Heneka MT,Kummer MP,Stutz A,et al.NLRP3 is activated in Alzheimer's disease and contributes to pathology in APP/PS1 mice[J]. Nature,2013,493(7434):674-678.
[12] Zhang S,Huang SY,An XB,et al. Medical histories of control subjects influence the biomarker potential of plasma Aβ in Alzheimer's disease:A meta-analysis[J]. Journal of Molecular Neuroscience:MN,2020,70(6):861-870.
[13] Heneka MT,Kummer MP,Latz E. Innate immune activation in neurodegenerative disease[J].Nat Rev Immunol,2014,14(7):463-477.
[14] Ye JZ,Zeng B,Zhong M,et al.Scutellarin inhibits caspase-11 activation and pyroptosis in macrophages via regulating PKA signaling[J].Acta Pharmaceutica Sinica B,2021,11(1):112-126.
[15] Wang L,Zhang Y,Wang CR,et al. A natural product with high affinity to sigma and 5-HT 7 receptors as novel therapeutic drug for negative and cognitive symptoms of schizophrenia[J]. Neurochemical Research,2019,44(11):2536-2545.
[16] Plácido AI,Pereira CMF,Correira SC,et al. Phosphatase 2A inhibition affects endoplasmic reticulum and mitochondria homeostasis via cytoskeletal alterations in brain endothelial cells[J]. Molecular Neurobiology,2017,54(1):154-168.
[17] 許方方,蒋淼.Cdk5/p25在APPswe/PS1dE9双转基因AD模型小鼠海马内表达与认知功能障碍的关系[J].现代医药卫生,2020,36(20):3248-3251.
(收稿日期:2021-05-25)
