猪繁殖与呼吸综合征病毒-脂多糖刺激对中性粒细胞黏附猪肺微血管内皮细胞的影响
2022-03-03王兆丽杨思宇吴艳梅宋晓晓
王兆丽,杨思宇,吴艳梅,宋晓晓,穆 祥,张 涛
(北京农学院动物科学技术学院,兽医学(中医药)北京市重点实验室,北京 102206)
微血管内皮细胞(microvascular endothelial cells,MVECs)是动物体内的功能多样性细胞[1],是调控血液内中性粒细胞(neutrophils,Neu)向炎症组织募集的枢纽性结构,Neu与MVECs的黏附及其跨内皮细胞迁移是Neu向炎症组织募集的基础[2]。研究MVECs与Neu黏附及其调控机制对阐明MVECs在相关疾病中的作用具有重要意义,可为有效发挥Neu的防御功能及控制其组织损伤作用提供试验依据。猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染仔猪常引起肺脏的弥漫性间质炎症,混合感染或继发感染细菌等病原微生物时,患猪的临床症状和肺脏病变更显著,易发生急性肺损伤而引起患猪死亡[3-4]。研究表明,Neu在急性肺损伤的发生发展中起关键作用,迁移到肺脏组织的Neu可通过氧化和非氧化机制及释放胞外诱捕网对病原体起到杀灭和清除作用[5],而其过度积累和激活又是急性肺损伤的主要病理特征[6]。MVECs损伤是诱发急性肺损伤的病理基础,这已在流感病毒[7]、禽流感病毒[8]和2019新型冠状病毒[9]的致病机制中得到证明。也有研究显示,PRRSV感染可显著增加猪肺泡灌洗液中Neu的数量[10-11]。然而,MVECs在其中的作用鲜见报道。鉴于此,本试验体外分离培养猪肺MVECs及猪外周血Neu,检测PRRSV联合脂多糖(lipopolysaccharide,LPS)刺激时,Neu与MVECs黏附的数量变化,旨在了解MVECs在PRRSV单独和继发细菌感染时肺脏募集Neu过程中的作用,以期为阐明PRRSV的致病机制提供试验依据。
1 材料与方法
1.1 PRRSV毒株及试验动物
PRRSV HN株由中国农业科学院北京畜牧兽医研究所惠赠,在Marc-145细胞上连续复壮3次后,收取病毒,测定其TCID50后,于-80 ℃保存备用。仔猪购自北京市SPF猪育种管理中心。
1.2 主要试剂及仪器
Ⅱ型胶原酶(LS004176)购自Worthington公司;DMEM高糖培养基(H2387)和胎牛血清(10099-141)均购自Gibco公司;D-Hank’s(H1040)、RPMI 1640培养基(31800)、猪外周血中性粒细胞分离液试剂盒(P4140)、脂多糖(L8880)和虎红钠盐(G8540)均购自北京索莱宝科技有限公司;瑞士染色液(C0135)和免疫染色封闭液(P0102)均购自上海碧云天生物技术有限公司;E-选择素抗体(bs-1273R)、P-选择素抗体(bs-0561R)、CD34抗体(bs-0646R)、HRP标记羊抗兔IgG(bs-0295G-HRP)及DAB染色试剂盒(C02-04001)均购自北京博奥森生物技术有限公司。
倒置荧光数码显微镜(IX71)购自Olympus公司;多功能酶标仪(Synergy 4)购自Biotek公司;二氧化碳培养箱(MCO-17AC)购自Sanyo公司。
1.3 猪外周血Neu的分离
临床健康猪血采自北京市某屠宰场,加入35 U/L肝素溶液抗凝,参照姜代勋等[12]相关方法,于黏附试验前1 d分离、提取猪外周血Neu,用含10%胎牛血清的RPMI 1640培养基重悬,调整细胞密度为5×106/mL,于37 ℃孵育、备用。
1.4 MVECs分离培养
参照Li等[13]方法分离培养MVECs,即仔猪按0.1 mL/kg BW注射速眠新Ⅱ注射液麻醉,无菌剖开胸腔取出肺脏,用预冷的D-Hank’s液洗去血污,剪取肺脏边缘组织,撕去被膜并剪碎,置于37 ℃ 0.2% Ⅱ型胶原酶溶液消化约60 min,至吹打后无大块肺脏组织,将消化液过孔径75 μm细胞筛,滤液1 000 r/min离心5 min,将沉淀重悬于含1%双抗、20%胎牛血清的DMEM完全培养基中,调整细胞浓度至5×105/mL后接种于培养板,于37 ℃、5% CO2条件下培养2 h,洗去未贴壁细胞,更换完全培养基,继续培养至亚汇合状态,用0.05%胰蛋白酶-0.005% EDTA溶液消化脱壁后传代培养,并采用CD34免疫荧光染色法鉴定。
1.5 Neu与MVECs黏附试验
Neu与MVECs黏附试验分2次,分别检测PRRSV处理和PRRSV-LPS联合处理对其影响。将MVECs接种于24孔板,生长至亚汇合状态,每孔更换为0.45 mL含2%胎牛血清的维持培养基,孵育过夜后,按照表1、2进行分组处理,每组3孔重复。

表1 PRRSV刺激对Neu黏附MVECs影响试验的分组与处理
PRRSV处理试验孵育培养18 h,或PRRSV-LPS联合处理试验继续孵育培养6 h,吸弃MVECs培养基,每孔加入0.2 mL相应处理的Neu,孵育1 h,PBS溶液洗去未黏附细胞,4%多聚甲醛溶液室温固定30 min,瑞氏染色后观察,拍照分析。
表2 PRRSV-LPS联合刺激对Neu黏附MVECs影响试验的分组及处理
1.6 选择素表达的免疫细胞化学染色
为了解MVECs表达选择素的特点,试验采用免疫细胞化学染色法检测E-选择素和P-选择素的表达。将MVECs细胞接种于预置有圆形盖玻片的培养板,加入完全培养基培养48 h,4%多聚甲醛溶液室温固定30 min。试验分为3组:阴性对照组、P-选择素组和E-选择素组,每组3个重复,阴性对照组将选择素抗体替换为PBS溶液,常规方法进行免疫细胞化学染色,苏木素复染,中性树胶封片,显微镜观察、拍照分析。
1.7 Neu与MVECs黏附中选择素的作用
为进一步研究选择素在PRRSV-LPS刺激Neu黏附MVECs过程中的作用,本试验检测了E-选择素和P-选择素的影响。将MVECs接种于96孔培养板孵育培养,生长至汇合后加入0.18 mL维持培养基,培养过夜,分组与各时间点处理见表3,每组3个重复,孵育1 h。吸弃MVECs培养基,每孔加入0.1 mL相应处理的Neu,再孵育1 h,PBS溶液洗去未黏附细胞,每孔加入0.25%虎红溶液0.1 mL,室温静置10 min,PBS洗去游离虎红,每孔加0.2 mL乙醇-PBS溶液(1∶1),室温静置1 h,用酶标仪测定D570 nm值。

表3 选择素对PRRSV-LPS致Neu黏附MVECs影响试验的分组及处理
1.8 统计分析
Neu黏附试验每组随机选择3~5个视野拍照,分别对黏附的Neu数量计数;选择素在Neu黏附MVECs中的作用试验,计数各重复孔虎红染色后酶标仪测定的D570 nm值。 试验数据均利用GraphPad Prism 8.0软件进行单因素方差分析及后续Tukey检验。结果以平均值±标准差表示。P<0.05表示差异显著。
2 结 果
2.1 MVECs体外生长特征
体外分离培养的MVECs显微镜下折光性良好,呈不规则多角形,胞质丰富,一般有2个以上长突起,传代培养约3~5 d生长至汇合状态(图1A);CD34免疫荧光染色结果显示,细胞培养物呈阳性着色,阳性细胞比率约为92%(图1B)。
A,显微形态;B,CD34免疫荧光阳性着色
2.2 PRRSV处理对Neu黏附MVECs的影响
由图2可知,正常情况下,Neu与MVECs仅有少量黏附;PRRSV HN株处理Neu和MVECs其中1种或2种细胞时,黏附MVECs的Neu数量均有增加;由图3可知,与正常对照组相比,Neu处理组与双处理组的黏附细胞数量分别显著和极显著增加(P<0.05;P<0.01),MVECs处理组无显著差异(P>0.05)。
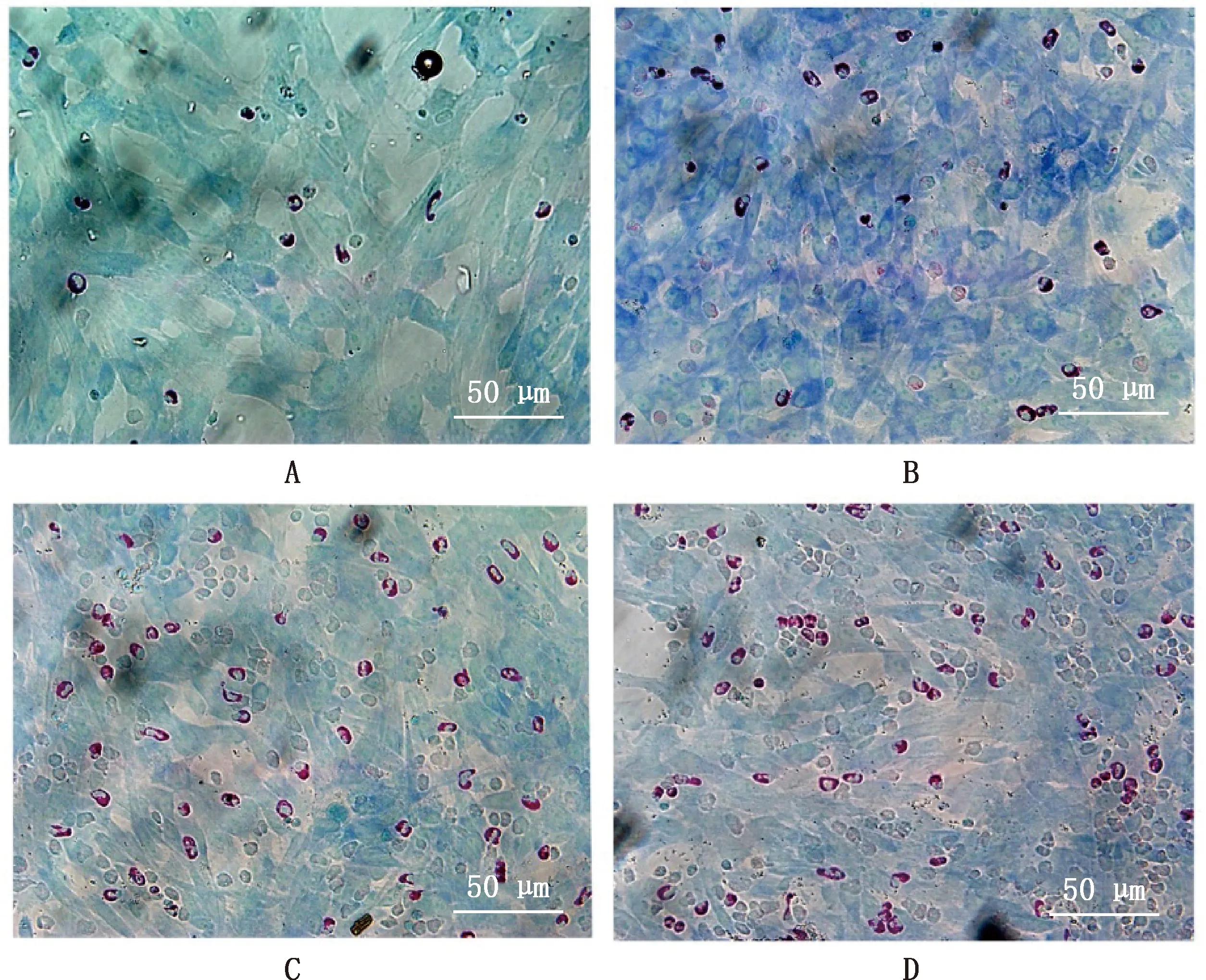
A,正常对照组;B,MVECs处理组;C,Neu处理组;D,双处理组。图3同
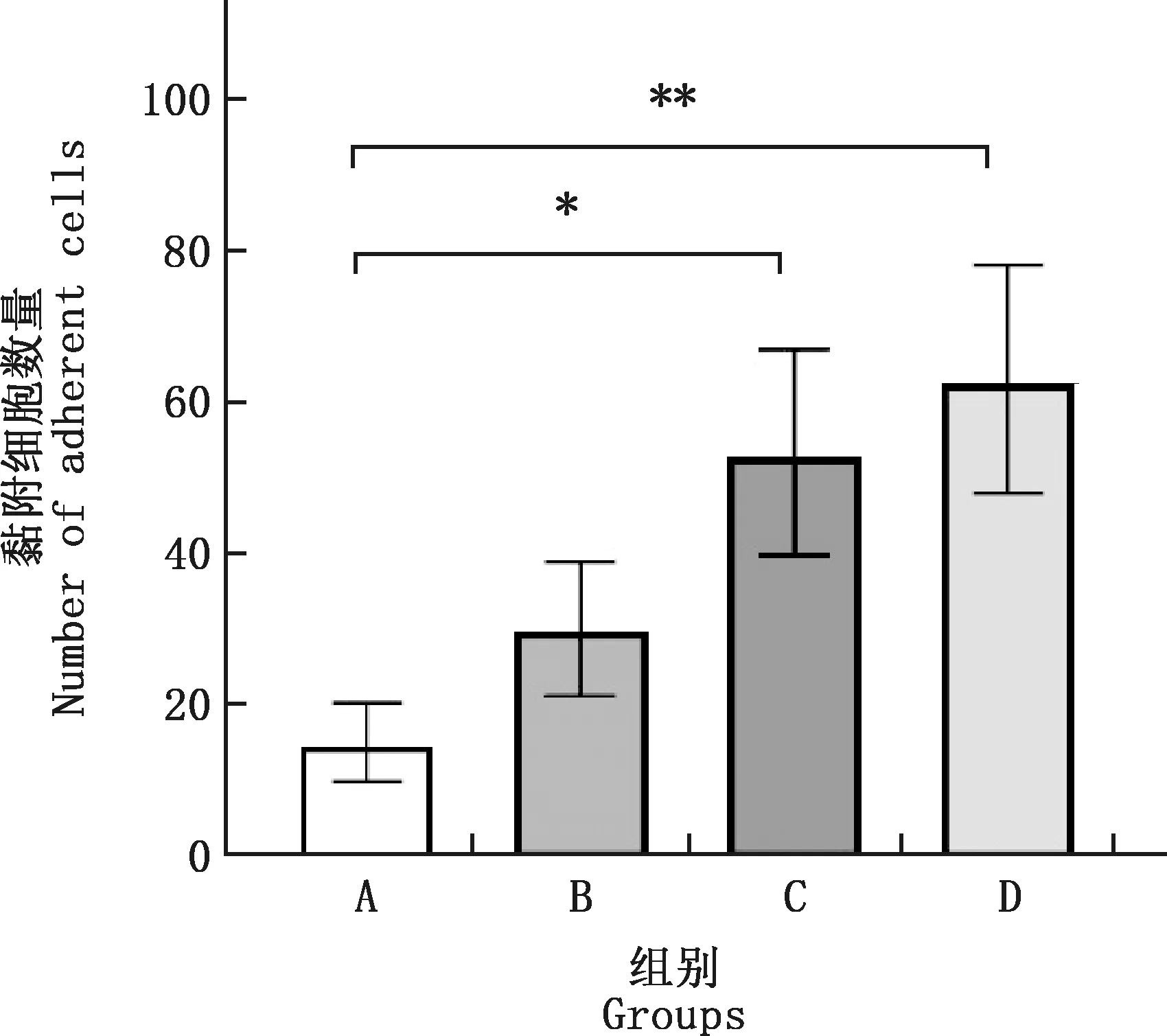
*,差异显著(P<0.05);**,差异极显著(P<0.01)。下同
2.3 PRRSV-LPS联合刺激对Neu黏附MVECs的影响
由图4可知,与LPS直接刺激相比,PRRSV HN株预先处理MVECs和/或Neu,然后再用LPS刺激时,Neu黏附数量均有不同程度增加;由图5可知,双处理组与LPS对照组有显著差异(P<0.05),而MVECs处理组和Neu处理组与LPS对照组均无显著差异(P>0.05)。
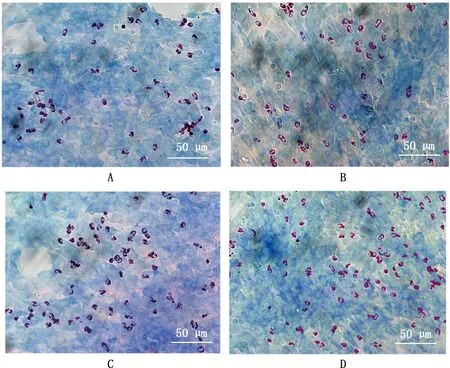
A,LPS对照组,B,MVECs处理组,C,Neu处理组,D,双处理组。图5同
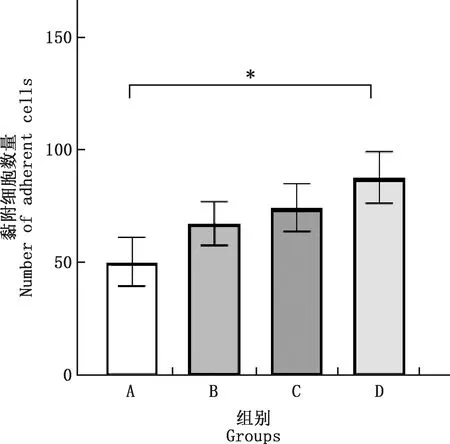
图5 PRRSV-LPS联合处理时黏附MVECs的Neu计数结果
2.4 MVECs表达选择素特点
MVECs免疫细胞化学染色结果显示,E-选择素和P-选择素均呈阳性着色,着色部位在细胞膜和细胞浆,阳性细胞率约为100%;阴性对照组以PBS替代选择素抗体时,未见明显阳性着色(图6)。
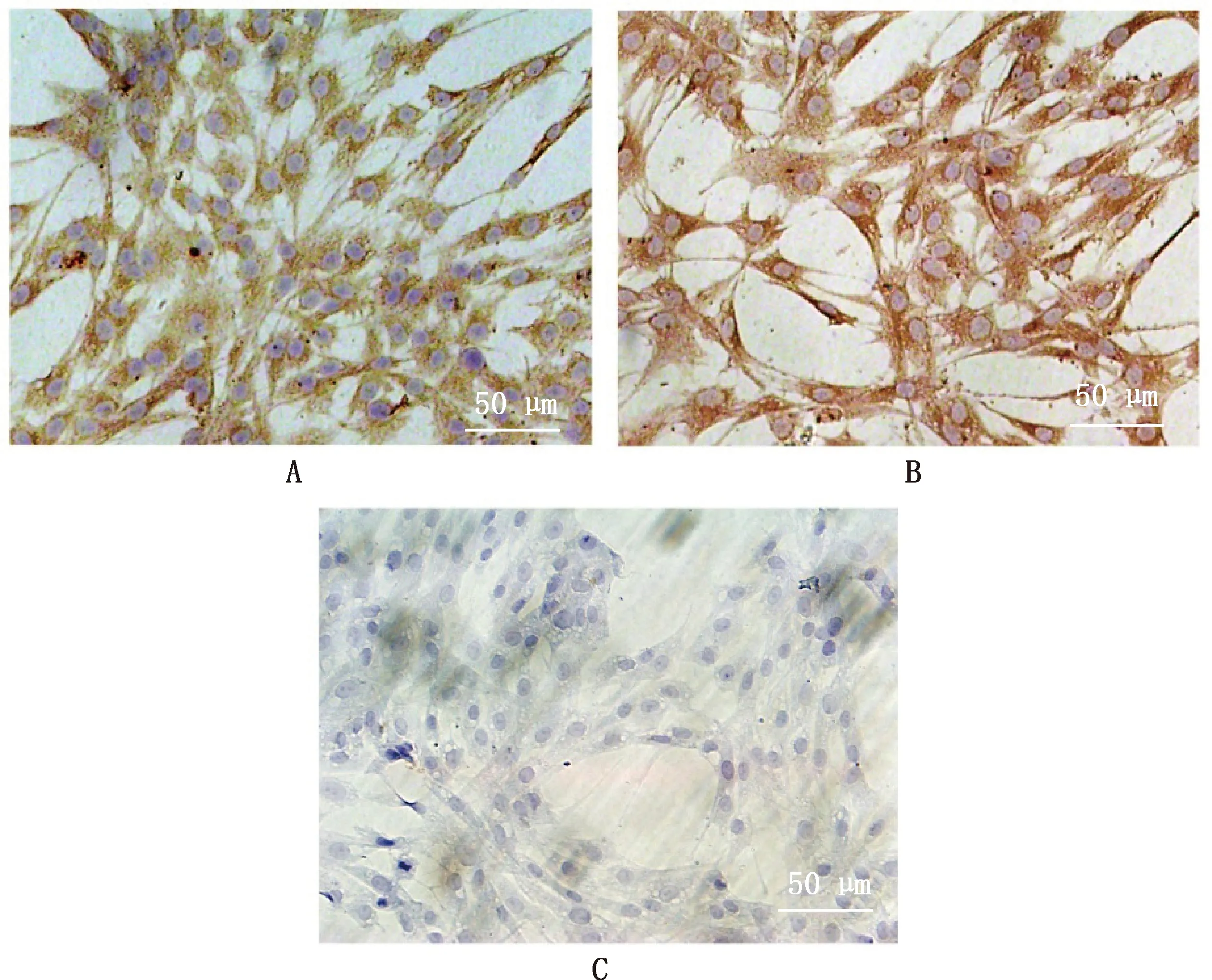
A,E-选择素组;B,P-选择素组;C,阴性对照组
2.5 选择素对PRRSV-LPS致Neu黏附MVECs的影响
由图7可知,PRRSV HN株单独处理和PRRSV-LPS共同处理时,Neu黏附数量显著或极显著增加(P<0.05;P<0.01);而E-选择素和P-选择素抗体封闭后,Neu黏附数量均有一定下降,但仍高于正常对照组,方差分析显示,E-选择素封闭时,2种处理组的Neu黏附数量下降均有显著差异(P<0.05),而P-选择素封闭时,均无显著差异(P>0.05)。

A,正常对照组;B,PRRSV组;C,PRRSV-E组;D,PRRSV-P组;E,PRRSV-LPS组;F,PRRSV-LPS-E组;G,PRRSV-LPS-P组
3 讨 论
Neu和巨噬细胞是参与急性肺损伤的主要效应细胞[14],MVECs在Neu等向组织器官募集和迁移时起着“看门人”的角色。鉴于炎症反应是PRRSV感染诱导急性肺损伤时的典型病理变化,本试验旨在明确PRRSV及联合LPS刺激时Neu与MVECs黏附的变化,结果发现,PRRSV HN株显著增加Neu黏附于MVECs的数量,并提高后继LPS刺激所致Neu与MVECs的黏附数量。PRRSV HN株对Neu黏附于MVECs的促进作用,为Neu在肺脏组织的大量募集奠定了基础,这在一定程度上解释了前述报道PRRSV感染猪肺泡灌洗液Neu数量增加的原因,此结果与流感病毒[15]、2019新型冠状病毒[16]等感染时Neu在肺脏的募集相似。
由于PRRSV感染猪常继发细菌感染,故本试验研究了PRRSV HN株处理后,再以LPS刺激时Neu的黏附情况,结果显示,LPS单独刺激时Neu与MVECs的黏附显著增加,与朱雯宇等[17]研究结果相似。值得注意的是,PRRSV处理后再用LPS刺激时,Neu的黏附数量显著高于LPS单独刺激时,这提示PRRSV继发细菌感染时,Neu在猪肺脏的募集数量可能会多于单独细菌感染。而据Labarque等[18]报道,无论有无PRRSV感染,LPS刺激时仔猪肺脏Neu的浸润数量相似,但该研究未关注Neu与MVECs黏附,亦未深入研究感染不同时间点Neu黏附数量的动态变化。Labarque等[18]及van Gucht等[19]研究报道均认为,PRRSV-LPS共同刺激时,猪肺脏组织的炎性病变和损伤均更为严重。Neu作为非特异性免疫细胞,适度募集对抵御外来病原体具有一定作用,而过度募集或清除障碍则会导致组织损伤。PRRSV促进后继LPS刺激时Neu黏附MVECs数量的结果也提示,这可能是PRRSV继发细菌感染时患猪肺组织损伤等病理反应更为严重的机制之一。
本实验室前期研究表明,MVECs感染PRRSV约72 h才能在细胞内检测到病毒核酸的显著扩增,感染约5 d时才出现致细胞病变效应[13]。本试验侧重于PRRSV感染后MVECs早期功能变化,选择了感染时间为18 h。研究结果显示,PRRSV单独感染MVECs时,Neu黏附数量的增加无统计学显著性,PRRSV作用于Neu或MVECs后再给予LPS刺激时,Neu黏附数量的增加与LPS单独刺激亦无显著差异,其原因可能与PRRSV HN株的作用时间有一定关系。另一方面,PRRSV只感染MVECs时,正常Neu的黏附数量亦有一定程度增加,这提示MVECs在其中有潜在的调控作用。
白细胞与血管内皮细胞的黏附主要由选择素介导,其成员主要有L-、E-和P-选择素3种[20]。L-选择素主要表达于白细胞表面,血管内皮细胞主要表达另外2种选择素[21]。本研究结果表明,E-选择素和P-选择素在猪肺MVECs均呈阳性表达,在PRRSV诱导的Neu黏附中均有一定作用,但E-选择素的作用更为显著,这与选择素在Neu黏附猪主动脉内皮细胞中的作用特点相似[22]。Neu渗出是多种类型黏附分子参与调控的一系列过程,黏附后的激活和渗出主要由MVECs表达的整合素和VCAM-1、ICAM-1等介导。Liu等[23]研究认为,PRRSV诱导的Neu渗出有ICAM-1依赖和非ICAM-1依赖模式。所以,MVECs在PRRSV感染诱导的Neu跨内皮迁移中黏附后阶段的作用,有待进一步深入研究。鉴于MVECs在病毒感染中的关键作用[24],通过调控MVECs对选择素的表达,在Neu跨内皮迁移的早期黏附阶段予以干预,对抑制PRRSV感染诱导的炎性损伤应具有潜在的意义。
4 结 论
PRRSV HN株处理能显著促进Neu黏附MVECs,亦能显著提高后继LPS刺激时Neu黏附数量;MVECs能表达E-选择素和P-选择素,尤以E-选择素在MVECs介导PRRSV HN株诱导Neu黏附增加中具有重要作用。本研究为PRRSV感染促进Neu在猪肺组织的募集提供了佐证,表明MVECs在PRRSV感染中具有重要作用。
