阴道微生态失衡与高危型人乳头瘤病毒相关宫颈病变的关系
2022-03-02刘颖惠
刘颖惠, 余 杨, 孙 翔
(1.新郑市疾病预防控制中心临床检验科,新郑 451199;2.河南理工大学第一附属医院 河南省焦作市第二人民医院检验科,河南 焦作 454100)
高危型人乳头瘤病毒(high-Risk human papillomavirus, HR-HPV)持续感染可导致宫颈癌和约60%的宫颈上皮内瘤病变(cervical intraepithelial neoplasia, CIN)[1-3]。这种因果关系在历史文献中已被多次报道,但HR-HPV单独感染还不足以使宿主上皮细胞永生化,进而转化为癌细胞。以往的研究[4]显示,HR-HPV持续感染伴随着其他协同和辅助因素的综合作用下,促进了宫颈上皮癌变这一进程。其中,阴道微生态的改变是辅助因素之一,它的改变对宫颈微环境产生不同程度的影响。阴道微生态是一个由阴道正常生理解剖结构、阴道微生物群、局部免疫系统和内分泌调节系统等组成的相对平衡的复杂体系。阴道微生态作为抵御病原体的第一道防线,在预防女性生殖系统感染中发挥重要作用。一旦该屏障功能被打破,外源性微生物更容易入侵并诱发阴道炎症性疾病,炎症刺激增加了罹患肿瘤的风险。
HR-HPV感染具有普遍性和自限性的特点[5]。多数情况下,HR-HPV感染可在2 a内被免疫系统清除[6]。阴道微生态失衡破坏了阴道的免疫保护,使HR-HPV易于黏附阴道壁,导致阴道上皮细胞损伤[7]。本研究通过分析HR-HPV不同感染状态下的阴道微生态,旨在探讨阴道微生态失衡与HR-HPV相关宫颈病变之间的关系,为调节阴道微生态平衡、干预宫颈病变的进展提供临床依据。
1 对象与方法
1.1 对象 选取2014年1月—2017年5月河南理工大学第一附属医院640例HR-HPV感染的宫颈病变患者(HR-HPV感染组)为研究对象,年龄30~66岁,中位年龄45.13岁。依随访结果分为持续感染组(352例)与非持续感染组(288例),按(宫颈病变组)宫颈上皮内瘤病变(cervical intraepithelial neoplasia, CIN)患者程度分为CIN Ⅰ组(n=71)、CIN Ⅱ组(n=71)、CIN Ⅲ组(n=79)及宫颈癌组(n=131)。患者知情同意,随访资料完整。纳入标准:①CIN依据WHO(2005)宫颈癌前病变的标准[8]诊断,宫颈癌按照WHO(2014)女性生殖器官肿瘤病理组织学分类标准[9]诊断。②参照《阴道微生态评价的临床应用专家共识》[10]细菌性阴道病的诊断方法,对阴道微生态进行形态学检测和功能学检测。排除标准:①妊娠期和哺乳期。②合并其他恶性肿瘤或自身免疫性疾病。③近期使用过免疫抑制类药物。④HIV阳性。⑤有放化疗史。⑥2周内接受过局部或全身抗病毒药物治疗。⑦有子宫切除或宫颈锥切病史。⑧24 h内有阴道冲洗、用药史。⑨无性生活史。
1.2 方法 采用聚合酶链式反应(polymerase chain reaction, PCR)对HR-HPV进行基因分型检测,显微镜镜检阴道微生物群的形态变化,评价微生态体系。主要仪器与试剂:PCR扩增仪是购自中山大学达安基因公司的DA7600型,HPV基因分型检测试剂盒购自广州安必平医药科技公司,阴道微生态评价系统应用江苏硕世生物科技有限公司提供的BPR-2014A阴道炎自动检测工作站及其配套的联合检测试剂盒。

2 结果
2.1 HR-HPV分型 640例HR-HPV患者共检测出16种HR-HPV主要亚型,主要为 HPV 16型(n=234)、HPV 58型(n=87)和 HPV 52型(n=81), 共402例,感染率为62.81%,其中 HPV 16型的感染率为36.56%;次要感染亚型共8种,68型(n=41),53型(n=33),33型(n=29),51型(n=26),66型(n=25),18型(n=24),39型(n=20),31型(n=19),共217例,感染率为33.91%;少见亚型有5种,59型(n=7),35型(n=6),56型(n=5),45型(n=2),82型(n=1),共21例,感染率为3.28%。
2.2 年龄构成 研究对象按年龄分为30~39岁、40~49岁、50~59岁和≥60岁,宫颈病变组和HR-HPV感染组的年龄构成比差异无统计学意义(P>0.05)。见表1。
2.3 阴道微生态失衡类别 阴道微生态失衡在不同级别的CIN差异无统计学意义(P>0.05)。菌群密集度异常在持续感染组、非持续感染组间差异无统计学意义(P>0.05);菌群多样性异常、优势菌异常、pH值异常、H2O2分泌异常、白细胞酯酶阳性等在持续感染组、非持续感染组间差异有统计学意义(P<0.05)。见表2。需氧性阴道炎(aerobic vaginosis, AV)、细胞溶解性阴道病(cytolytic vaginosis, CV)、滴虫性阴道炎(trichomonal vaginitis, TV)、外阴阴道假丝酵母菌病(vulvovaginal candidiasis, VVC)等在各组间差异无统计学意义(P>0.05)。见表3。
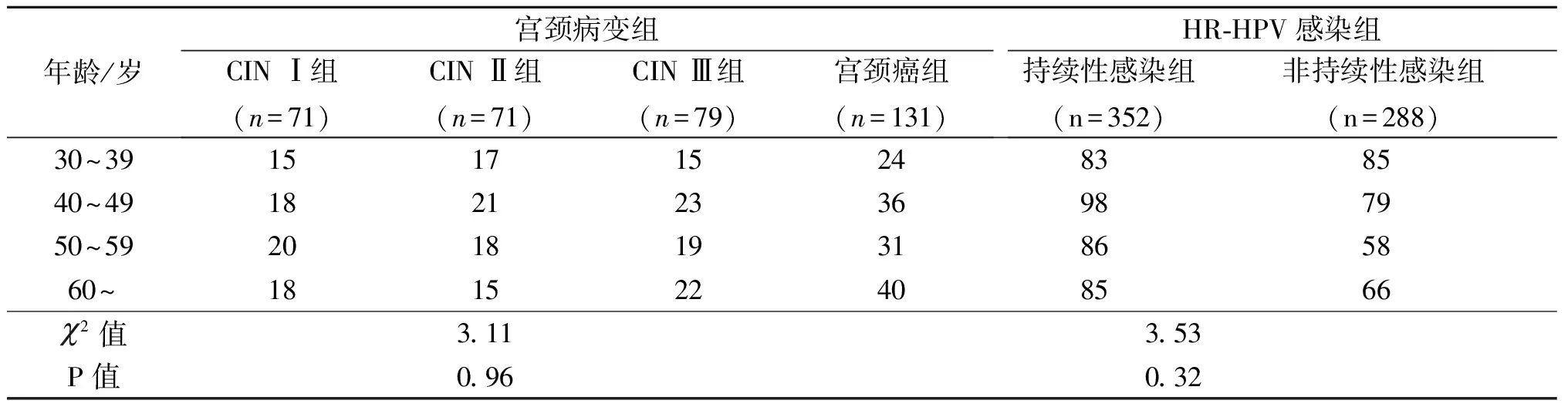
表1 HR-HPV阳性患者不同组别的年龄构成比较

表2 阴道微生态失衡类别及构成比分析[n(%)]
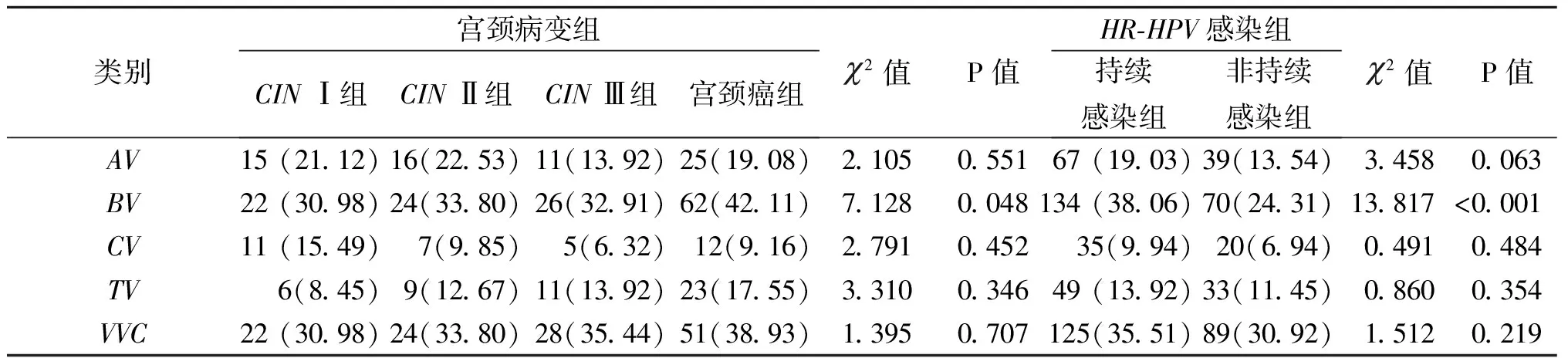
表3 不同HR-HPV阳性患者的阴道感染类型及构成比分析[n(%)]

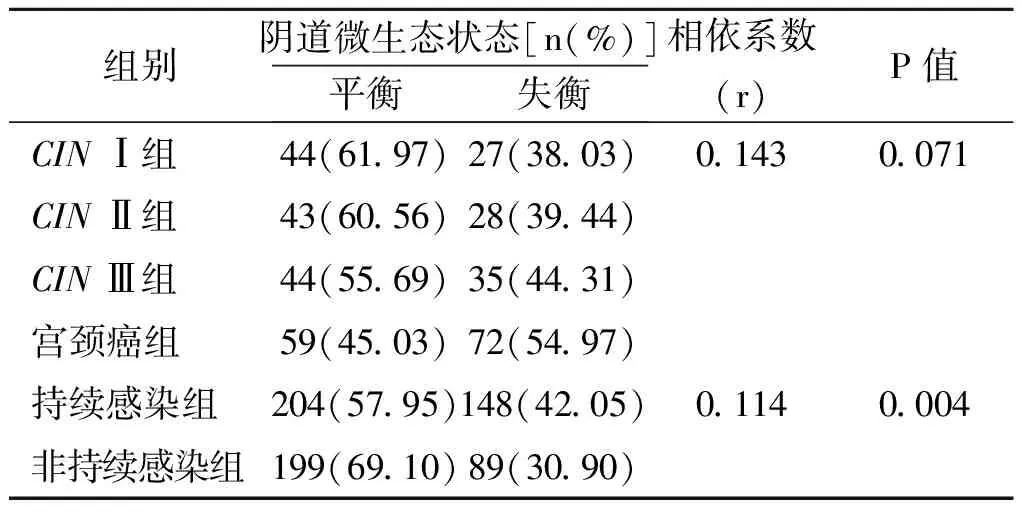
表4 阴道微生态与HR-HPV感染的相关性分析
2.5 阴道微生态与HR-HPV感染的相关性分析HR-HPV持续感染者的阴道微生态失衡率为82.29%,HR-HPV持续感染合并宫颈病变的阴道微生态失衡率为46.02%。阴道微生态失衡与HR-HPV持续感染合并的宫颈病变无关(r=0.143,P>0.05);与HR-HPV持续性感染相关(r=0.114,P<0.05),相依系数明显偏小。见表4。
3 讨论
HPV归类于乳头瘤病毒科的乳头瘤病毒属,是一种重要的DNA病毒,与宫颈癌的发生、发展有着密切关系。其在复制和装配过程中释放出的病毒颗粒不易被抗体中和。高危型HPV16型感染者的抗体检出时间是通过宫颈分泌物检出HPVDNA阳性后的6~12个月,且浓度很低[11-13]。因此人乳头瘤病毒可在细胞之间传播,更易长期存活,形成持续性感染,可不发病而长期潜伏,也可随机体内外环境的改变而发病。
本实验从HR-HPV感染出发,围绕阴道微生态展开研究,以HR-HPV感染触发的严重程度不同的宫颈病变和感染状态作为分层标志,从细胞和分子水平分析阴道微生物群的结构组成和功能变化,评估微生态指标与HR-HPV感染及其相关宫颈病变的关联。本研究数据显示,年龄构成比对宫颈病变组、HR-HPV感染组的影响无显著差异。这些数据提示,阴道微生态失衡及其相应指标在HR-HPV持续感染和HR-HPV持续感染合并宫颈病变中的作用是不平行的。年龄构成对宫颈病变、宫颈癌的影响较小。阴道微生态中正常寄生有多种菌群,形成正常的菌群多样性。菌群多样性的异常,导致某种优势菌的异常增生,进而引起pH值变化。阴道微生态乳酸杆菌数量减少,不仅在很大程度上影响阴道菌群的整体功能,而且对机体的生理病理学进程的影响也至关重要。保护性乳酸杆菌主要通过分解糖原,产生乙酸、乳酸、H2O2、乳酸菌素、硬脂酸等多种抑菌物质,维持阴道的弱酸环境[14]。这种微生态的异常变化利于HR-HPV引起宫颈的系列演变,在长时间损坏因素影响下,更易于导致癌变。
白细胞酯酶与HR-HPV持续感染及其CINⅢ和宫颈癌均密切相关,白细胞酯酶与被破坏的白细胞数量成正比,能间接反映致病微生物的增殖水平。白细胞酯酶阳性提示阴道分泌物中有大量多核白细胞被破坏从而释放该酶,阴道黏膜受损,存在炎症反应[15]。生殖道感染疾病主要分为AV、BV、CV、TV、VVC五型。BV的病理基础是阴道正常菌群的平衡失调,而不是由致病菌引起。BV感染更倾向于发生在HR-HPV持续阳性合并宫颈癌的患者。因此被称为阴道病而不是阴道炎[16]。这说明感染细菌性阴道病作为一个辅助因素,在宫颈癌变的进程中起着重要作用。VVC的病原体为白色假丝酵母菌,是一种机会性病原体,通常不会引起阴道黏膜疾病,只有当机体免疫力降低或阴道酸性环境改变时,才引发症状。尽管各型HPV的致癌潜能各不相同,但复制机制和增殖周期基本相同,其致病机制主要包括两点[17]:首先,病毒可能通过其表达的基因引起宿主细胞生长和存活的持续紊乱,或在宿主细胞中引起DNA损伤反应,从而增加宿主基因组的不稳定性;其次,病毒可能导致慢性炎症和继发性组织损伤,有利于宿主细胞中致癌过程的发展。
综上所述,以阴道优势菌作用减弱为主要变化的阴道微生态失衡增加了HR-HPV的感染机会,增强了HR-HPV的持续性感染;以炎症反应为主要变化的阴道微生态失衡不仅与HR-HPV持续性感染关系密切,而且与宫颈癌变联系紧密。因此,阴道微生态失衡增加了HR-HPV的易感性,促进宫颈上皮内瘤病变形成,进而导致宫颈癌的发生。
