神经生长因子过表达治疗帕金森病模型大鼠的效果及其分子机制*
2022-03-02崔传举王玉香李艾帆
燕 燕, 崔传举, 王玉香, 李艾帆
(郑州市第一人民医院神经内科,郑州 450000)
帕金森病(Parkinson’s disease,PD)属于中枢神经系统变性疾病,临床主要采用口服黑质多巴胺前体药物进行治疗,但长期服药治疗效果降低,还可引起运动障碍等并发症[1]。脐血干细胞(umbilical cord mesenchymal stem cells,UMSCs)中含有神经、造血等多种干细胞,并将其运用于诱导分化多巴胺能神经元,从而治疗PD[2-5]。但UMSCs是否可作为PD细胞替代治疗的理想细胞尚存在争议。神经生长因子(nerve growth factor,NGF)可参与神经细胞生长、增殖及分化等过程,并可保护间充质干细胞,从而促进其增殖及分化[6]。因此,本研究主要探究NGF过表达的UMSCs移植对PD大鼠的治疗效果,为临床中枢神经系统损伤的治疗及预防提供新方法。
1 材料与方法
1.1 材料及试剂 36只雄性SD大鼠购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京):2012-0003。UMSCs购自中国医学科学院血液学研究所;pcDNA3.1购自武汉淼灵生物科技有限公司;Lipofectamine2000购自北京索莱宝科技有限公司;杜氏改良培养基(DMEM)培养基、胎牛血清购自美国Hyclone公司;Trizol试剂购自美国Invitrogen公司;反转录试剂盒与实时荧光定量PCR试剂盒购自日本TaKaRa公司;兔抗鼠NGF抗体购自北京义翘神州科技有限公司;兔抗鼠Tribbles同源蛋白3(TRB3)抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自武汉博士德生物工程有限公司;免疫组化试剂盒购自美国CST公司。
1.2 方法
1.2.1 建立PD模型 选取9只大鼠,经腹腔注射质量分数10%水合氯醛溶液,脑部剔除毛发后消毒,切开脑部组织,选取前脑内侧束与右侧黑质致密部各一点,切开颅骨,每点注射4 μL的六羟多巴胺溶液,留针约8 min,以1 mm·min-1的速度缓慢退针,使用少量青霉素撒至脑部切口,缝合,7 d内进行伤口酒精消毒及腹腔注射青霉素,7 d后腹腔注射阿扑吗啡(APO),观察大鼠旋转圈数,向左旋转360°记为一圈,记录30 min内大鼠旋转圈数,若大鼠30 min内旋转圈数大于180圈,表明PD大鼠建模成功[7]。
1.2.2 NGF转染及UMSCs处理 UMSCs生长至80%融合时,使用PBS洗涤,加入胰蛋白酶消化,加入质量分数10%胎牛血清的培养基终止消化,制备细胞悬液,收集细胞置于离心管内,4 ℃条件下1 000 r·min-1离心5 min,弃上清,加入含有质量分数10%胎牛血清的培养基垂悬细胞,细胞按照1∶3传代培养,每隔24 h更换一次培养液。取第5代UMSCs,调整细胞密度为5×106个·L-1,接种于6孔板(每孔150 μL),加入重组人表皮生长因子(20 μg·L-1)与重组人碱性成纤维细胞生长因子(20 μg·L-1)预诱导24 h,加入全反式视黄酸(1 μmol·L-1)诱导15 min,加入胶质细胞源性神经营养因子继续诱导5 h,终止诱导。取对数期UMSCs,分别将pcDNA-NC、pcDNA-NGF转染至诱导后的UMSCs中[8],分为pcDNA-NC组和pcDNA-NGF组,转染过程参照Lipofectamine2000试剂说明书,转染48 h后收集细胞。实验设置NC组(大鼠仅进行手术,不进行注射)、PD组(PD模型)、UMSCs组(正常大鼠中经皮下注射含有pcDNA-NGF的UMSCs细胞悬液至脑部黑质区)、UMSCs+PD组(PD模型大鼠中经皮下注射含有pcDNA-NGF的UMSCs细胞悬液至脑部黑质区),每组各9只。
1.2.3 实时荧光定量聚合酶链反应(qRT-PCR)检测相关指标 采用Trizol法提取各组细胞或脑组织中的总RNA,应用紫外分光光度计测定RNA浓度。参照反转录试剂盒说明书将总RNA反转录为cDNA。NGF正向引物5’-CAGGAGCAAGCGGTCATCA-3’,反向引物5’-GGTCTTATCCCCAACCCACA-3’;GFAP正向引物5’-CACTCAATGCTGGCTTCA-3’,反向引物5’-GCGACTCAATCTTCCTCTC-3’;MAP2正向引物5’-AACACGACACAACGAACT-3’,反向引物5’-TGGAGAAGGAGGCAGATTA-3’;Tubulin正向引物5’-ACACGGATGAGACCTACT-3’,反向引物5’-TGTTCTTGCTCTGGATGG-3’;TRB3正向引物5’-GAAGAAGCAGCAAGAGAGGC-3’,反向引物5’-ACACTGCGGCGATTGTAAAA-3’;β-actin正向引物5’-TGCTGTCCCTGTATGCCTCT-3’,反向引物5’-TGATGTCACGCACGATTT-3’,引物均由上海生工生物工程股份有限公司合成。反应体系:SYBR Green Master Mix 10 μL,正反向引物0.8 μL,cDNA 1 μL,去离子水(ddH2O)补足至总体积20 μL;反应条件:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共循环40次。NGF、Nestin、神经胶质纤维酸性蛋白(GFAP)、神经元细胞内微管相关蛋白 2 (MAP2)、微管蛋白(Tubulin)、TRB3均以β-actin为内参,采用2-ΔΔCt法计算NGF、巢蛋白(Nestin)、GFAP、 MAP2、Tubulin、TRB3 mRNA的相对表达量。
1.2.4 免疫组化法检测黑质区酪氨酸羟化酶(TH)阳性细胞计数 各组大鼠培养4周后,采用脱颈法处死大鼠,使用质量分数4%多聚甲醛固定,取各组大鼠脑组织,石蜡包埋,经脱蜡、脱水处理后,加入柠檬酸缓冲液进行热抗原修复15 min,室温冷却,使用PBS缓冲液洗涤3 min,参照免疫组化试剂盒说明书进行TH染色,切片复染、脱水处理后使用中性树脂封片,置于纤维镜下观察结果,分别计数TH阳性细胞数[9],细胞质呈棕黄色颗粒记为阳性细胞。
1.2.5 观察指标 观察各组大鼠治疗4周的旋转圈数记录,记录时间为30 min。
1.2.6 蛋白免疫印迹(Western blot)检测NGF、TRB3蛋白表达 收集各组UMSCs及大鼠脑组织(黑质区),加入RIPA蛋白裂解液,冰上裂解30 min提取细胞或组织总蛋白。采用BCA法检测蛋白浓度。将30 μg蛋白样品与上样缓冲液充分混匀后点样,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜、封闭,加入NGF(1∶1 000)、TRB3(1∶1 000)一抗稀释液,4 ℃孵育过夜,TBST缓冲液洗涤,加入二抗稀释液(1∶2 000),滴加ECL显影,采用Quantityone软件检测条带灰度值,蛋白相对表达量=目的蛋白条带灰度值/内参照条带灰度值。

2 结果
2.1 各组大鼠旋转圈数和黑质区TH阳性细胞计数比较 与NC组比较,PD组大鼠旋转圈数增多(P<0.05);与UMSCs组比较,UMSCs+PD组大鼠旋转圈数增多(P<0.05);与PD组比较,UMSCs+PD组大鼠旋转圈数减少(P<0.05)。与NC组比较,大鼠黑质区TH阳性细胞计数减少(P<0.05);与PD组比较,UMSCs+PD组大鼠黑质区TH阳性细胞计数增多(P<0.05)。见表1。

表1 各组大鼠旋转圈数和TH阳性细胞计数比较
2.2 UMSCs中过表达NGF后神经谱系标志物Nestin、GFAP、MAP2、Tubulin mRNA的表达水平比较 与pcDNA-NC组比较,pcDNA-NGF组NGF mRNA及蛋白、Nestin、GFAP、MAP2、Tubulin mRNA的表达水平升高(P<0.05)。见图1。
2.3 过表达NGF的UMSCs处理PD大鼠脑组织中TRB3的表达水平 与NC组比较,PD组大鼠脑组织中TRB3 mRNA及蛋白表达水平升高(P<0.05);与PD组比较,UMSCs+PD组大鼠脑组织中TRB3 mRNA及蛋白表达水平降低(P<0.05)。见图2。

注:A:qRT-PCR检测NGF mRNA表达水平;B:qRT-PCR检测Nestin mRNA表达水平;C:qRT-PCR检测GFAP mRNA表达水平;D:qRT-PCR检测MAP2 mRNA表达水平;E:qRT-PCR检测Tubulin mRNA表达水平;F、G:Western blot检测NGF蛋白的表达。与pcDNA-NC组比较,t=13.282,10.075,7.340*,9.699,9.112,15.230,P<0.05。
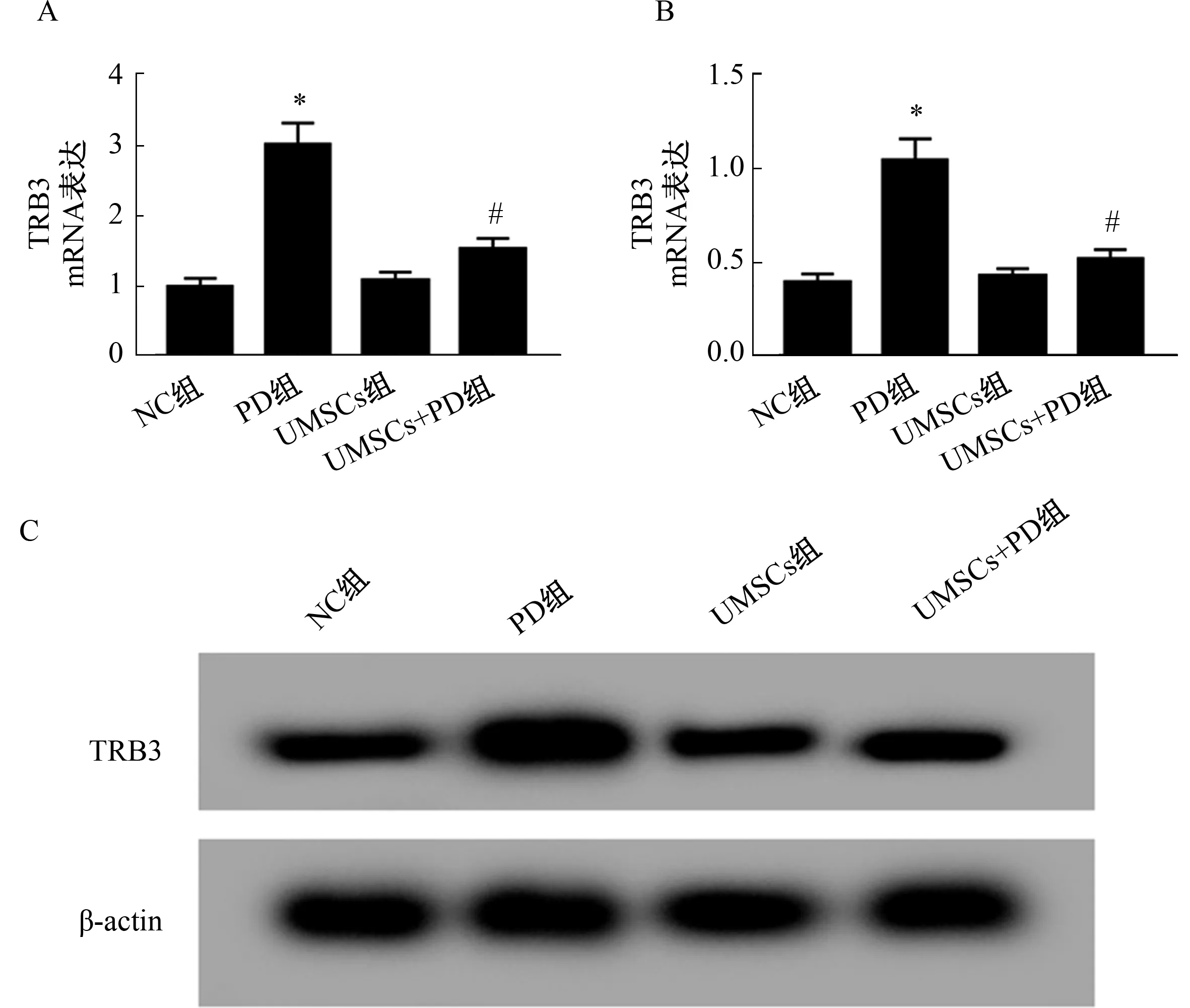
注:A:qRT-PCR检测TRB3 mRNA表达水平;B、C:Western Blot检测TRB3蛋白的表达。与NC组比较,*P<0.05;与PD组比较,#P<0.05。
3 讨论
既往研究[10]显示,骨髓间充质干细胞移植可有效改善PD模型大鼠的行为学症状。胶质源性神经营养因子基因修饰神经干细胞移植可促进细胞存活从而改善PD大鼠的运动障碍[11]。干细胞移植可抑制脑黑质部多巴胺能神经元凋亡,从而恢复神经中枢系统中多巴胺递质的水平,最终达到治疗PD的目的。因而从分子水平调控基因表达,可能会提高PD治疗效果。
NGF联合人脐带间充质干细胞移植可减轻缺血、缺氧脑损伤大鼠中枢神经系统损伤,并可恢复中枢神经功能[12]。有研究[13]表明,NGF可在体外诱导区来源神经干细胞分化为神经元。相关报道指出,NGF表达量升高可促进移植脂肪干细胞分化,并可促进动物模型脑损伤后功能的恢复[14]。本研究结果显示,UMSCs中NGF过表达后可促进神经谱系标志物Nestin、GFAP、MAP2、Tubulin mRNA的表达,提示UMSCs中NGF表达量升高可促进神经系统发育及细胞分化。有研究[15-17]表明,神经特异性蛋白Nestin、GFAP、MAP2、Tubulin在神经干细胞的分化及增殖过程中发挥重要调控作用。本研究结果显示,NGF过表达能促进UMSCs向神经元样细胞分化,UMSCs移植后PD大鼠旋转圈数减少,大鼠黑质区TH阳性细胞计数增多,提示PD模型中NGF过表达修饰的UMSCs能够促进NGF表达,从而促使多巴胺能神经元替代受损的多巴胺能神经元,并可能抑制多巴胺能神经元凋亡。有研究[18-19]表明,TRB3属于激酶类似蛋白,其可与蛋白激酶 B(protein kinase B,AKT)结合从而参与细胞凋亡过程,还可参与缺血再灌注后神经细胞内质网应激反应过程,并可有效改善大鼠胰岛素抵抗。本研究结果显示,PD模型大鼠脑组织中TRB3的表达水平升高,过表达NGF的UMSCs处理PD大鼠后,脑组织中TRB3的表达水平降低,提示UMSCs细胞可能促进NGF表达而抑制TRB3表达,减轻PD模型大鼠神经功能损伤。
综上所述,NGF过表达转染UMSCs可促进细胞向神经元样分化,并可保护受损神经元,UMSCs移植可改善PD模型大鼠的症状,NGF联合UMSCs动物体内移植的实验研究,为中枢神经损伤的修复及中枢神经系统损伤并发症的预防提供新途径,可为PD等中枢神经系统疾病的细胞治疗及基因治疗奠定理论基础。
