Ⅰ群禽腺病毒penton蛋白单克隆抗体的制备和鉴定
2022-03-02侯力丹陈晓春孔冬妮杨承槐李俊平中国兽医药品监察所北京0008中国农业大学动物医学院北京0093
侯力丹,陈晓春,薛 麒,邓 永,孔冬妮,杨承槐,刘 丹*,李俊平* (.中国兽医药品监察所,北京 0008;2.中国农业大学 动物医学院,北京 0093)
禽腺病毒(fowl adenovirus,FAd V)是可以通过种源垂直传播的常见免疫抑制病毒之一,根据抗原性不同可分为3个群,其中Ⅰ亚群FAd V(FAd V-Ⅰ)可分为5个种(A~E),12个血清型(血清型1~7、8a、8b、9~11)。2015年下半年以来,多种血清型的FAd V-Ⅰ在我国河南、河北、辽宁、吉林、黑龙江、新疆、安徽、山东、江西、湖北、江苏等省多个鸡场暴发流行,给养禽业造成巨大的经济损失[1-3]。这些感染最初主要发生在一些生物安全条件较差的小型养殖场,但随后某些大型现代化养殖场也出现了由FAd V-Ⅰ引起的鸡心包积液-肝炎综合征。SU等[4-5]对发生鸡心包积液-肝炎综合征的某大型种鸡群开展溯源分析,从其使用的鸡新城疫弱毒疫苗中同时检测到鸡传染性贫血病毒(chicken infectious anemia virus,CIAV)和FAd V-Ⅰ的混合污染,经过测序和比对发现疫苗中FAd V与我国发病鸡群中FAd V的同源性非常高。自此,对疫苗中FAd V-Ⅰ污染的监测引起越来越多企业的关注。当前,国内除了血清4型FAd V-Ⅰ外,FAd V-8a、FAd V-8b、FAd V-10及FAd V-11等血清型在我国鸡群中也均有流行和感染的报道[1-3],多血清型的流行为该病的检测和防控带来很大挑战,而国内尚无可同时检测FAd V-Ⅰ所有血清型病毒的诊断制品和方法。为此,本试验基于penton蛋白研制了可有效识别FAd V-Ⅰ所有12个血清型的单克隆抗体,为开展禽活疫苗FAd V-Ⅰ污染的检测及相关疾病诊断提供储备。
1 材料与方法
1.1参考毒株及主要试剂FAd V-Ⅰ的12个血清型参考毒株均由中国兽医药品监察所鉴定和保存,各毒株的具体信息参见表1。12个血清型参考毒株接种鸡肝癌细胞(LMH)后,按照Reed-Muench法测定其TCID50。鸡减蛋综合征病毒(EDSV,127株)、禽白血病病毒(ALV,RAV-1株)、鸡传染性喉气管炎病毒(ILTV,ILT/13株)、禽正呼肠孤病毒(ARV,Reo1133株)均由中国兽医药品监察所保存。FAd V-Ⅰ阳性血清由FAd V KR5株病毒免疫SPF获得。FITC标记山羊抗小鼠IgG购自Sigma公司。限制性内切酶购自NEB公司。

表1 FAd V的12种血清型参考毒株信息
1.2penton蛋白的表达与纯化根据GenBank上公布的FAd V-Ⅰ的序列,采用DNAStar软件对penton蛋白进行二级结构、亲疏水性、抗原性和功能区的分析,选取penton蛋白抗原表位相对集中且在FAd V-I中同源性较高的49~166aa和375~525aa蛋白序列作为表达蛋白的备选片段。根据蛋白结构分析,人工合成825 bp核酸片段并在两端加入EcoRⅠ和XhoⅠ酶切位点用于载体的克隆,序列合成由北京六合华大蛋白研发中心有限公司完成。用限制性内切酶EcoRⅠ和XhoⅠ分别对合成的序列和质粒p ET30a进行双酶切,纯化回收的片段和表达载体酶切产物用DNA Ligation Kit连接后,转化至感受态细胞BL21。从转化的平板挑单克隆到1.5 m L含相应抗性的LB液体培养基中,37℃、200 r/min培养,IPTG(0.5 mmol/L)诱导,37℃、200 r/min培养2 h。诱导菌液以常规SDS-PAGE电泳检测。
1.3基于penton蛋白的间接ELISA检测方法建立参照相关文献,以1.2纯化的penton蛋白作为包被抗原建立用于检测其抗体的间接ELISA方法[6]。首先用p H9.6的碳酸钠-碳酸氢钠缓冲液稀释纯化好的penton蛋白,终质量浓度为2 mg/L,100μL/孔,4℃过夜;后用PBST(含0.05%吐温的PBS)洗涤3次。用含2%牛奶的PBS进行封闭,200μL/孔,37℃孵箱中2 h,后用PBST(含0.05%吐温的PBS)洗涤3次。分别加入杂交瘤细胞培养上清、阴性对照(SP2/0培养上清)、空白对照(PBS)、阳性对照(阳性血清用PBS做1 000倍稀释)作为一抗,100μL/孔,37℃孵育1 h。用PBST(含0.05%吐温的PBS)洗涤3次后分别加入工作浓度的山羊抗小鼠IgG/HRP作为二抗,100μL/孔,37℃孵育1 h。再用PBST(含0.05%吐温的PBS)洗涤3次,加入显色液显色5 min,每孔加入50μL终止液(含2 mol/L硫酸)终止。在双波长(450,630 nm)下测吸光值,记录保存数据。
1.4单克隆抗体的制备用1.2纯化的penton蛋白按照常规方法[7]制备杂交瘤细胞系,并按照1.3步骤以penton蛋白包被的ELISA板进行2次筛选。筛选出的ELISA阳性的杂交瘤细胞株上清进行与全病毒的反应性检测,并按现行《中国兽药典》附录方法对制备的杂交瘤细胞株进行无菌检验、支原体检验和外源病毒检验。将培养24 h的杂交瘤细胞用秋水仙素法检查染色体数目,观察染色体特征是否符合杂交瘤细胞的染色特性,并用ELISA方法进行抗体亚类分型。将筛选出的杂交瘤细胞系按照常规方法[7]通过腹腔注射小鼠,收集腹水,并置于—40℃保存。将每株单克隆抗体的腹水从1∶1 000开始倍比稀释至1∶16 000作为一抗,用间接免疫荧光法(IFA)测定腹水效价。
1.5单克隆抗体的鉴定将表1所列FAd V-I 12个血清型毒株病毒液分别用含2%新生牛血清的DMEM培养液稀释成100 TCID50/0.1 m L,接种已长成良好LMH细胞单层的96孔板,每个毒株接种4孔,100μL/孔,同时设空白对照。37℃、5%CO2温箱中培养5 d后弃去96孔板的细胞培养液,每孔约加250μL PBS轻洗细胞表面1次,尽量弃尽PBS,然后每孔加入100μL冷甲醇,置室温固定10~15 min,弃去甲醇,自然晾干2~5 min,作为FAd V-Ⅰ阳性板备用。将1.4中制备的腹水作为一抗,采用IFA筛选与FAd V-Ⅰ12个血清型毒株全病毒具有良好反应性的细胞株,接种的4个FAd V-Ⅰ阳性病毒孔中只要1孔出现特异性绿色荧光即判为该单克隆抗体与FAd V-Ⅰ反应。同时在LMH细胞板上接种EDSV(127株)、ALV(RAV-1株)、ILTV(ILT/13株)、ARV(Reo1133株)等作为对照,观察制备的单克隆抗体与相关病毒是否存在交叉反应。
2 结果
2.1重组蛋白的表达与纯化重组表达菌小量表达后进行SDS-PAGE电泳检测,结果显示在约37 k Da处出现重组penton蛋白的特定目的条带(图1),说明penton蛋白表达成功。将表达菌扩大培养和诱导表达后,经超声破菌、离心,分别取上清和沉淀进行SDS-PAGE检测,结果在沉淀中检测到大量的目的蛋白,说明其表达形式为包涵体表达(图2)。纯化后的蛋白进行SDS-PAGE电泳,有明显蛋白条带(图3),以BSA为标准,通过SDS-PAGE凝胶扫描分析,纯化蛋白质量浓度>0.5 g/L,纯度>85%。纯化重组蛋白用FAd V-Ⅰ阳性血清进行免疫印迹试验检测,有特异性条带(图4)。

图1 蛋白小量表达检测图
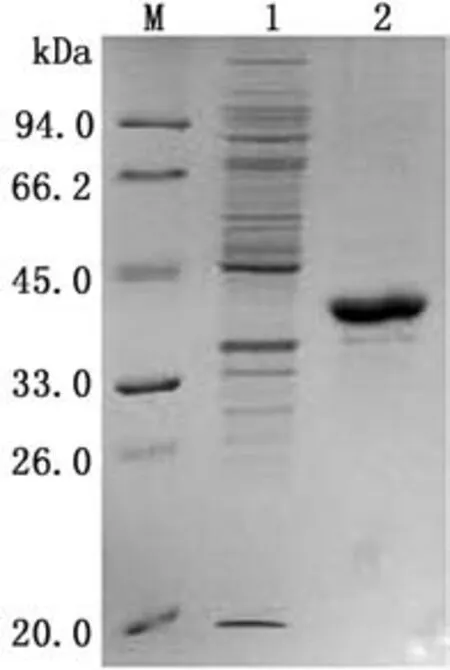
图2 蛋白大量表达检测图
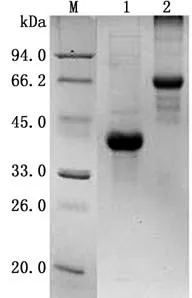
图3 蛋白大量表达纯化检测图

图4 纯化重组蛋白的免疫印迹试验检测图
2.2杂交瘤细胞的筛选和鉴定用ELISA方法对杂交瘤细胞上清中的抗体进行检测,经过1次亚克隆和筛选后,进行亚型鉴定。经过筛选后,共获得2株阳性杂交瘤细胞株,分别标识为Mab-penton-6#和Mab-penton-9#。按现行《中国兽药典》附录方法进行无菌检验、支原体检验和外源病毒检验,均无细菌污染、支原体污染和外源病毒污染。亚类鉴定均为IgG1型,轻链均为κ链。结果见表2。

表2 2株杂交瘤细胞株筛选与鉴定结果
2.3间接免疫荧光法检测单克隆抗体反应性与效价用杂交瘤细胞株Mab-penton-6#、Mab-penton-9#少量制备的小鼠腹水作为第一抗体进行IFA检测,正常细胞对照背景最暗且无特异性荧光,以阳性病毒孔出现特异性荧光最亮的一抗和二抗的工作浓度为最适浓度。根据荧光强弱,其结果可判为+(1个视野内有1个左右的特异性荧光)、++(1个视野内有1~10个特异性荧光)、+++(1个视野内有10个以上特异性荧光)。结果显示,2株单克隆抗体与FAd V-Ⅰ各血清型12株参考毒株均呈现出典型的强荧光信号,而与EDSV、ALV、ILTV、ARV等病原感染细胞均不发生反应,说明建立的IFA方法特异性良好(图5为Mab-penton-6#检测结果,Mab-penton-9#检测结果未展示)。同时,用IFA测定抗体效价,结果表明,Mab-penton-6#、Mab-penton-9#杂交瘤细胞制备的单克隆抗体腹水效价分别为1∶8 000和1∶4 000。最终选用Mabpenton-6#杂交瘤细胞大量制备单克隆抗体。

图5 Mab-penton-6#杂交瘤细胞制备单克隆抗体IFA检测
3 讨论
自2015年以来,以包涵体肝炎-心包积液综合征为主要临床症状的疾病在我国山东、河南以及其他省份陆续暴发并持续流行,该病发病时间主要集中于3~5周龄,并能引发20%~30%的病死率,给家禽养殖业造成了巨大的经济损失[8-10]。大量流行病学调查结果显示,血清4型、8b型、11型FAd V-Ⅰ是目前国内流行的主要代表血清型[11],同时还有报道指出从某些禽用弱毒疫苗中检测到血清4 FAd V-Ⅰ[5,12]。经过基因组对比分析发现,禽用弱毒疫苗中污染的血清4型FAd V-Ⅰ与野毒株具有非常高的同源性[4],提示弱毒疫苗中可能的FAd V-Ⅰ污染是该病传播途径之一。
作为常见的垂直传播性病毒之一,SPF鸡胚中一旦携带FAd V-Ⅰ便会造成生产的禽用弱毒疫苗出现污染,为该病的防控带来很大风险。现有SPF鸡微生物控制国家标准中,针对FAd V特别是Ⅲ群的EDSV已有明确的检验标准,但FAd V-Ⅰ检测控制标准缺乏系统对应技术标准。在2015年版《中国兽药典》的禽活疫苗成品外源病毒检验中还未将FAd V-Ⅰ列入正式检测项目,相应的检测技术亟待建立。作为一种疫苗中潜在外源病毒,针对FAd V-Ⅰ的检测应不仅是针对某一种或几种特定血清型,而是要确保FAd V-Ⅰ均可以被检出。针对FAd V-Ⅰ的通用型检测中,早在1998年就有报道指出,通过1对通用引物可同时检测出FAd V-Ⅰ所有的血清型[13]。这种分子生物学检测除了需要进行测序验证外,还有另一个缺陷,即仅核酸检测无法证实其中是否存在具有感染性的活病毒,在实施病毒分离鉴定时如果有高效的单克隆抗体,则可通过IFA等快速确定FAd V-Ⅰ的存在。本研究成功获得2株可识别FAd V-Ⅰ的杂交瘤细胞系,其所分泌的单克隆抗体可与FAd V-Ⅰ的12个血清型参考毒株发生特异性反应,针对FAd V-Ⅰ呈现出识别的广谱型,而对Ⅲ群FAd V(EDSV)以及其他常见禽类病毒未发生任何交叉反应,具有较好的群特异性。该单克隆抗体在IFA检测中明确易判,为实现SPF鸡胚等疫苗生产原料以及疫苗成品检验的高效检测奠定物质基础。
FAd V编码的蛋白包括结构蛋白和非结构蛋白。其中结构蛋白包括五邻体(penton)、六邻体(hexon)和纤突蛋白(fiber),fiber主要是通过识别宿主细胞上的特异受体而使病毒吸附结合在宿主细胞上,有助于病毒的侵入和内化[14-16]。hexon是主要的结构蛋白,包含主要属和亚属特异型抗原决定簇和次要型特异性抗原决定簇[17],能诱导机体产生中和抗体[18]。此前,已有针对某些血清型FAd V-Ⅰ的单克隆抗体或者多克隆抗体的相关报道。如曹洁等[19]制备了针对血清4型FAd V-Ⅰfiber 1蛋白多克隆抗体,王萍等[7]制备了抗血清4型FAd V-Ⅰfiber 2蛋白的单克隆抗体,郭浩然等[20]制备了抗血清4型FAd V-Ⅰfiber 2蛋白的多克隆抗体,路浩等[21]制备了针对血清8型FAd V-Ⅰ纤突蛋白的多克隆抗体,上述研究均关注于六邻体或纤突蛋白,主要针对某一血清型进行特异性识别。penton蛋白在不同血清型间较为保守,因此,本研究率先将FAd V-Ⅰ编码penton蛋白的基因进行了深入的同源性分析,在此基础上筛选并确定了12个血清型penton蛋白中同源性最高的2段基因以linker进行连接,以此作为免疫原制备单克隆抗体,经过试验证实本研究所制备的单克隆抗体比上述其他蛋白制备单克隆抗体具有更广泛的识别谱,可有效识别12个血清型参考毒株。
综上所述,本研究研制了可同时有效识别12个血清型FAd V-Ⅰ的单克隆抗体,灵敏度高、特异性强,为规范SPF鸡以及禽活疫苗等样品中FAd V-Ⅰ的检测奠定了基础。
