抗非洲猪瘟病毒噬菌体展示单克隆抗体的筛选及表达
2022-03-02胡永新毕玉海吴晓东尹燕博青岛农业大学动物医学院山东青岛66109中国动物卫生与流行病学中心山东青岛660青岛博隆基因生物工程有限公司山东青岛6601中国科学院微生物研究所中国科学院病原微生与免疫学重点实验室北京100101
周 昊,胡永新,常 星,孙 举,仝 舟,毕玉海*,吴晓东*,尹燕博(1.青岛农业大学 动物医学院,山东 青岛 66109;.中国动物卫生与流行病学中心,山东 青岛 660;.青岛博隆基因生物工程有限公司,山东 青岛 6601;.中国科学院 微生物研究所 中国科学院病原微生与免疫学重点实验室,北京 100101)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的猪的一种以发热和全身各脏器出血为特征的急性烈性传染病[1]。2018年非洲猪瘟首次传入我国,重创了我国生猪产业[2-5]。ASFV基因组包含150个以上开放阅读框,结构复杂,感染机制尚不明确,使疫苗和抗病毒药物的研发进程艰难[6-8]。
ASFV结构蛋白p30、p54、p72均可诱导机体产生中和抗体,其中p30参与病毒粒子与靶细胞的吸附,并且在感染时可以诱导机体产生强烈的体液免疫反应,产生部分中和抗体[9]。p54在病毒感染过程中参与对易感细胞的吸附与进入,该蛋白具有很好的抗原性,能够刺激产生具有一定保护作用的抗体[10]。p72是衣壳的重要组分,产生于病毒感染晚期,病毒感染后能够产生高滴度的抗p72抗体,且该蛋白序列保守,通常被用于血清学诊断[11]。p72是ASFV复制晚期表达的蛋白,可用于ELISA检测ASFV抗体,具有特异性好、灵敏度高的特点[12-13]。尽管ASFV感染后产生的中和抗体有时并不能完全保护动物,但这些抗体对补体系统的活化以及ADCC作用,进而裂解被感染的细胞[14]。
单链抗体是通过一段柔性短肽将重链可变区(VH)和轻链可变区(VL)连接起来的多肽片段,保留了完整的抗原结合位点,降低抗体分子的大小,同时还具备了渗透性好、免疫原性低、抗体分子半衰期长等优势[15]。通过噬菌体展示技术可以将数百万条不同单链抗体的DNA导入到噬菌体的基因组中,作为噬菌体外壳蛋白的组分展示在噬菌体表面,并能保留抗体的结构和功能[16]。与传统杂交瘤技术相比,通过基因工程方法获得的抗体文库克服了动物天然免疫存在的局限性,构建的抗体基因片段来自于天然淋巴细胞中重链与轻链基因的随机组合,使抗体文库库容量大、复杂度高,有利于筛选到特异性结合的抗体[17]。本试验构建了抗ASFV噬菌体单链抗体文库,经过3轮“吸附、洗脱、富集”过程,保留能够与ASFV特异性结合的单链抗体。
1 材料与方法
1.1菌种、质粒与试剂XLI-Blue感受态细胞购自博迈德基因技术有限公司;p Comb3XSS载体由中国科学院微生物所惠赠;限制性内切酶EcoRⅠ、XhoⅠ、SfiⅠ、T4DNA连接酶、辅助噬菌体M13K07购自美国NEB公司;TRIzol、Prime-ScriptTMⅡ1st Strand cDNA Synthesis Kit、DL2000 DNA Marker购自宝生物(大连)工程有限公司;猪外周血淋巴细胞分离液、ELISA包被液、ELISA终止液、TMB单组分显色液购自北京索莱宝科技有限公司;琼脂糖凝胶DNA回收试剂盒购自康为世纪生物技术有限公司;质粒小提试剂盒购自天根生化科技有限公司;ASF多抗原间接ELISA试剂盒购自法国IDvet公司(包被p30、p72、p62等3种蛋白);DMEM培养基、胎牛血清购自Gibico公司;去内毒素质粒提取试剂盒购自QIAGEN公司;蛋白Marker、Lipofectamine 3000购自Thermo公司;HRP标记鼠抗M13抗体购自北京义翘神州公司;HRP标记兔抗猪Ig G购自Sigma公司;FITC标记山羊抗猪IgG购自Abcam公司。
1.2抗体扩增引物由实验室先前设计的引物进行猪源抗体片段的扩增[18]。该套引物根据Gen-Bank中登录的猪抗体基因序列,设计在轻链可变区(VL)和重链可变区(VH)的保守区,其中重链5′和轻链3′引入Linker接头,重链3′和轻链5′引入SfiⅠ酶切位点,引物由北京睿博兴科生物技术有限公司合成。
1.3外周血淋巴细胞分离及总RNA提取前腔静脉采取ASF抗体阳性猪约10 m L新鲜血液与等体积的组织稀释液混匀,加入适当体积分离液提取猪外周血淋巴细胞。TRIzol法提取淋巴细胞总RNA,使用超微量分光光度计测定浓度及D260/D280比值,分析样品纯度,1.0%琼脂糖凝胶电泳分析提取RNA的完整性。
1.4VH基因和VL基因的扩增按照TaKaRa反转录试剂盒说明书操作合成cDNA,以cDNA为模板扩增VH和VL基因。反应程序:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,35个循环;72℃终延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳鉴定,胶回收纯化VH和VL片段,于—20℃保存。
1.5scFv抗体基因构建以回收纯化的VH与VL基因为模板,通过SOE-PCR方法组装成形式为VLlinker-VH的scFv单链抗体基因。将等量的VH与VL加入到PCR反应体系中进行连接反应,程序为:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸40 s,35个循环;72℃终延伸10 min。
1.6重组质粒构建将构建的scFv片段经过胶回收纯化,纯化后的产物与pComb3XSS载体分别使用SfiⅠ酶切,酶切反应体系与条件参考说明书进行,酶切产物进行胶回收纯化。将纯化回收的sc Fv构建至pComb3XSS载体。
1.7scFv抗体文库构建将20μL连接产物转化至80μL XLI-Blue感受态细胞中,参照文献[13]的方法构建噬菌体单链抗体初级文库。
1.8scFv抗体文库滴度测定取1μL scFv初级抗体文库,用无菌PBS 10倍比稀释,从10—7~10—9稀释的抗体库中各取20μL加入至180μLD600=0.5的XLI-Blue菌液中,静置感染30 min。各取20μL菌液涂在含Amp(100 mg/L)的平板上,37℃过夜培养,次日计算菌落数。
1.9scFv抗体文库筛选将原始文库加入到IDvet预包被ELISA板中,每孔加入100μL,37℃孵育1 h;PBST洗涤3次后加入洗脱液,洗脱结合在孔内的噬菌体,加入中和缓冲液调节p H值。取1μL上述液体测定抗体文库滴度,方法同1.8。剩余抗体库感染XLI-Blue进行富集,第2轮和第3轮抗体文库筛选方法同上。
1.10噬菌体抗体的鉴定随机挑选第3轮筛选到的单克隆菌落扩大培养,富集单克隆噬菌体抗体文库。将获得的所有单克隆抗体文库加入IDvet预包被ELISA板中,37℃孵育1 h;PBST洗涤3次,加入HRP标记的抗M13噬菌体酶标二抗,37℃孵育1 h;PBST洗涤5次,加入TMB显色液,37℃反应10 min;加入ELISA终止液终止反应,用酶标仪测定D450值。
1.11HEK293A细胞中瞬时表达将筛选得到的阳性噬菌体抗体序列进行比对,构建完整的抗体序列后进行密码子优化,合成基因后构建至真核表达载体p CAGGS。将纯化后的重链和轻链重组质粒共转染至HEK293A细胞,使用Lipofectamine 3000转染试剂按照说明书每孔转染3μg质粒(重链、轻链各1.5μg),转染后37℃、5%CO2培养48 h。
1.12间接免疫荧光鉴定重组抗体表达使用4%多聚甲醛将转染后的细胞室温固定20 min,以FITC标记的山羊抗猪IgG(1∶200倍稀释)为二抗进行染色,观察前进行DAPI染色,于荧光显微镜下观察。
1.13Western blot鉴定重组抗体表达将细胞样品收集到1.5 m L离心管中,加入适量5×Loading Buffer吹打混匀,进行SDS-PAGE电泳并转印至PVDF膜,以HRP标记的兔抗猪IgG(1∶10 000倍稀释)为二抗进行Western blot分析。
2 结果
2.1VH和VL基因扩增鉴定扩增的VH和VL基因经1%琼脂糖凝胶电泳分析,分别可见约400 bp和350 bp的特异性条带(图1),与目的片段大小相符。测序结果经NCBI网站Blast工具比对,证明扩增序列为猪源抗体可变区基因片段。
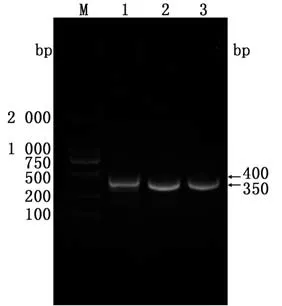
图1 V H基因和V L基因的扩增结果
2.2SOE-PCR法构建scFv基因以扩增的VH和VL基因为模板通过PCR扩增引入Linker接头构成VL-Linker-VH形式的单链抗体片段,重组scFv基因片段大小约为850 bp(图2),与预期结果相符。
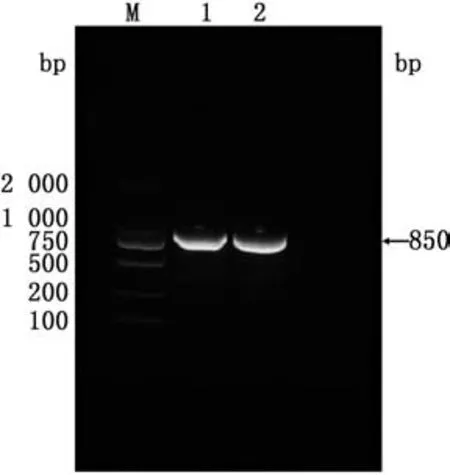
图2 scFv基因PCR扩增结果
2.3scFv抗体文库鉴定结果将连接产物转化至XLI-Blue感受态细胞中,转化后取菌液涂在含Amp(100 mg/L)的平板上,随机挑选单菌落进行PCR检测,产物经1%琼脂糖凝胶电泳分析,条带约为1 000 bp(图3),与预期条带大小相符,测序结果与猪IgG同源性为92.70%。
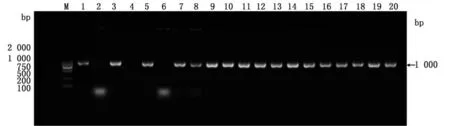
图3 菌落PCR鉴定结果
2.4scFv抗体文库滴度测定结果将构建的原始文库进行10倍比稀释,选取10—7、10—8、10—9等3个稀释度感染大肠杆菌后涂在含Amp(100 mg/L)的平板上,37℃培养过夜,根据菌落数估算单链抗体文库的库容量约为9.2×1011PFU/m L(图4)。
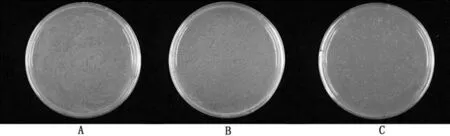
图4 单链抗体文库库容量测定结果
2.5scFv抗体文库筛选结果用IDvet间接ELISA试剂盒中预包被ELISA板对噬菌体抗体文库进行了3轮“吸附-洗脱-富集”的筛淘,并在每一轮筛淘前后测定各级抗体文库滴度。经过3轮筛选后的抗体库滴度与原始文库滴度相比提高了约65倍(表1),将能够特异性结合的噬菌体进行了有效的富集。

表1 单链抗体文库富集筛淘结果
2.6噬菌体抗体鉴定从第3轮筛淘的抗体库中随机挑选scFv阳性单克隆加入到预包被ELISA板中,以HRP标记的抗M13抗体为二抗,辅助噬菌体M13K07为阴性对照进行Phage ELISA鉴定,P/N值大于2.1即判为阳性[19]。发现1株与ASFV蛋白特异性结合的单克隆噬菌体抗体,其D450值为1.096,阴性对照D450值为0.094,P/N值为11.66。测序结果显示该单链抗体轻链、重链皆源于猪源抗体,且序列顺序为VL-linker-VH,与构建的单链抗体顺序一致。
2.7重组质粒酶切鉴定结果使用EcoRⅠ和XhoⅠ对重链和轻链重组质粒进行双酶切,并经1%琼脂糖凝胶电泳分析。结果显示重链与轻链重组质粒酶切后均有4 700 bp左右的载体条带,重链与轻链重组质粒分别在1 400,730 bp左右有明显条带,符合预期大小。测序结果与优化后序列完全一致。
2.8间接免疫荧光鉴定结果将6孔板中转染后48 h的HEK293A细胞与对照组细胞分别固定,以FITC标记的山羊抗猪IgG进行间接免疫荧光验证。结果显示,转染后的试验组中出现明显的特异性绿色荧光信号,而对照细胞未见荧光信号。图5所示免疫荧光结果证明荧光二抗可以与细胞中的表达表达产物特异性结合,初步证实了猪源重组抗体进行了有效表达。

图5 荧光显微镜下观察转染HEK293A细胞(100×)
2.9Western blot鉴定重组抗体表达向收集的细胞悬液分别加入普通Loading Buffer与不含β-巯基乙醇的Loading Buffer进行SDS-PAGE与Western blot,结果显示在约160 k Da位置处有明显的曝光条带,该条带为2条重链和2条轻链通过二硫键组成的结构正确的完整抗体(图6)。
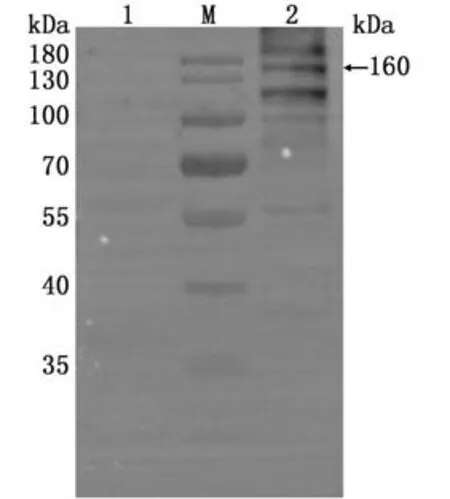
图6 Western blot鉴定结果
3 讨论
1989年,ORLANDI等[20]使用PCR方法成功扩增出小鼠抗体可变区基因,McCAFFERTY等[21]成功将上述方法与噬菌体展示技术结合构建出第一个噬菌体抗体文库。目前,常用的噬菌体展示系统主要有M13和T7等2种噬菌体展示系统,其中M13噬菌体是一种在感染和复制过程中不会裂解宿主菌的温和噬菌体,在淘选过程中纯化步骤更为简单[22],因此本试验采用M13噬菌体作为构建噬菌体抗体文库的载体。抗体可变区基因的扩增决是定抗体库构建质量的重要因素之一,通过比对Gen-Bank数据库中猪IgG抗体重链和轻链可变区基因设计1套简并引物,尽可能覆盖更多的抗体基因序列,下游引物设计在恒定区的起始部分,因而可以完整地扩增出天然的VDJ基因,尽可能保留抗体可变区的原始的结构。
抗体文库分为免疫抗体文库和天然抗体文库2种类型[23],本试验扩增的抗体基因来自于自然感染动物的淋巴细胞,属于免疫抗体库,更有利于筛选到与ASFV特异性结合的抗体。本试验采用IDvet间接ELISA检测试剂盒中预包被的微孔板进行筛淘和Phage ELISA鉴定,微孔板中包被了非洲猪瘟重组蛋白,为筛选到与ASF特异性抗体提供了基础。
本试验构建了完整的抗体序列,目的蛋白较大,在原核表达系统中不能以分泌表达的方式进行,为了保持抗体天然的生物活性,在HEK293A细胞中进行真核表达,并在构建抗体序列时添加了分泌性信号肽,使抗体蛋白直接表达在上清中,抗体蛋白正确折叠,尽可能保留原始的生物活性。本研究Western blot鉴定结果显示,除160 k Da结构正确的完整抗体目的条带外,还有2条重链构成约为110 k Da的蛋白条带和由1条重链构成约为55 k Da的蛋白条带,这些条带是由于Loading Buffer中的变性剂使部分二硫键打开导致的,这与之前报道的其他研究结果相符[24];另外,还有1条明显大于180 k Da的条带是由于重链与轻链之间形成了非共价化合物,进而影响了蛋白的迁移率所致[25]。
本研究成功构建了抗ASFV噬菌体单链抗体文库,并对噬菌体抗体文库进行筛淘,成功鉴定出1株能够与ASFV特异性结合的单链抗体,使用HEK293A细胞真核表达系统成功表达了该株抗体。本团队将进一步开展该株猪源化抗ASFV单克隆抗体的功能验证及应用研究,以期尽快用于ASFV的防控及致病机制研究。
