猪流行性腹泻病毒S蛋白多表位抗原免疫原性分析
2022-03-02马跃宇张溪妍费东亮王书全锦州医科大学畜牧兽医学院辽宁锦州121001
李 丽,唐 奇,马跃宇,张溪妍,费东亮,王书全 (锦州医科大学 畜牧兽医学院,辽宁 锦州 121001)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(PEDV)引起的猪的一种高度接触性肠道传染病,主要临床特征表现为呕吐和腹泻,是目前危害养猪业较为严重的腹泻性疾病之一,10日龄以内哺乳仔猪的病死率可高达100%。由于PEDV具有较强的变异性,疫苗的保护效果不佳,但目前疫苗接种仍是预防该病的主要手段[1]。
PEDV属于冠状病毒科、甲型冠状病毒属,为线性单股RNA病毒,其基因组长约28 kb,编码复制酶(Rep)、纤突糖蛋白(S)、基质蛋白(M)、囊膜蛋白(E)、核蛋白(N)和ORF3等6个基因。研究显示,S蛋白含有PEDV主要的抗原中和表位,包括COE(499~638 aa)、SS2(748~755 aa)、SS6(764~771 aa)、2C10(1 368~1 374 aa)[2],其中COE是其最重要的一段核心功能区域,且具有良好免疫原性。因此,S蛋白基因用于开发PEDV亚单位疫苗展现了良好的前景和潜力。此外,金黄色葡萄球菌肠毒素A(staphylococcal enterotoxin,SEA)是一种具有超抗原功能的外毒素,具有主要组织相容性复合体(MHC)结合的非限制性,能够激活刺激机体产生特异性T细胞,调节NK细胞以及刺激淋巴细胞产生TFN-α和活化Thl细胞等功效,可以用作免疫辅助佐剂或调节剂[3]。通过对国内猪流性行腹泻病毒S蛋白氨基酸序列的多重比对结果发现,其抗原表位2C10(1368GPRLQPY1374)在经典CV777毒株、减毒CV777毒株及其他中国分离毒株中均保守,表位SS2(748YSNIGVCK755)在除CH/HLJHG/2011外大部分中国分离毒株中也均保守[4]。因此,本试验尝试将PEDV S基因中编码抗原表位2C10(1368GPRLQPY1374)、SS2(748YSNIGVCK755)和SS6(764SQYGQVKI771和764LQDGQVKI771)基因区段与经典毒株S基因通过柔性连接肽(GGGGS)进行连接,并与SEA基因串联,分别构建p ET-28a-S、p ET-28a-S-SEA及p ET-28a-S-EP-SEA重组质粒,通过原核表达系统获得重组蛋白,研究其免疫原性,为进一步研制多表位亚单位疫苗提供帮助。
1 材料与方法
1.1实验动物BALB/c小鼠,购自北京维通利华实验动物有限公司(SCXK(京)2016-0011)。
1.2主要试剂与仪器猪流行性腹泻高免血清由辽宁益康生物股份有限公司舒秀伟研究员惠赠;原核表达载体p ET-28a(+),购于江苏泓讯生物科技有限公司;IFN-γ、IL-2和IL-4试剂盒购于深圳达科为生物技术有限公司;猪流行性腹泻病毒S蛋白酶联免疫分析试剂盒购于上海奥陆生物科技有限公司;PEDV弱毒疫苗(20190623)购于华派生物工程集团有限公司;载体和试剂分别购自北京全式金生物技术有限公司和大连宝生物公司。高速冷冻离心机(日本HITACHI公司);全自动凝胶成像系统(中国Tanon公司);台式低速离心机(美国Sigma公司);恒温振荡培养箱(美国BOI-Rad公司);PCR仪(英国HYBAID公司);低温连接仪(中国Tanon公司);Eppendorf蛋白核酸分析仪(德国Eppendorf公司)。
1.3多表位基因串联设计根据文献报道PEDV S蛋白抗原表位(EP):2C10(1368GPRLQPY1374)、SS2(748YSNIGVCK755)、SS6(764SQYGQVKI771及764LQDGQVKI771),分别设计S-EP-SEA和S-SEA融合基因,并通过柔性连接肽连接金黄色葡萄球菌肠毒素A基因(SEA)并在2个串联基因上下游分别设置NdeⅠ和XhoⅠ酶切位点及Bm HⅠ和HindⅢ酶切位点。
1.4基因密码子优化、合成及重组质粒pET-28a-SEP-SEA、p ET-28a-S-SEA的构建通过在线密码子优化网站(http://www.jcat.de/),根据S-EP-SEA和S-SEA基因中对大肠杆菌偏嗜性较差密码子进行优化,由江苏泓讯生物科技有限公司进行合成,并将其克隆至原核表达载体p ET-28a(+)中,获得p ET-28a-S-EP-SEA和p ET-28a-S-SEA重组质粒。
1.5重组质粒pET-28a-S的构建为获得S基因,设计1对特异性引物在其上、下游引物中分别加入EcoRⅠ和HindⅢ酶切位点。以p ET-28a-S-EP-SEA重组质粒作为PCR模板,进行PCR扩增,反应条件为:94℃预变性2 min;94℃变性45 s,57℃退火45 s,72℃延伸1 min,30个循环;72℃延伸10 min,4℃保存。PCR产物回收后,插入至原核表达载体p ET-28a。经酶切和测序鉴定正确后,获得表达S蛋白的重组质粒p ET-28a-S。
1.6重组质粒诱导表达与条件优化取10 m L含有卡那霉素的LB液体培养基,将1 m L新鲜细菌溶液接种到该培养基中,在37℃振荡器中以200 r/min振荡,将D值调节至0.6~0.8,并添加IPTG诱导表达,继续振荡培养数小时(初步诱导表达条件:IPTG 0.1 mmol/L,28℃,振荡6 h)。取出后,8 000 r/min离心3 min收集细菌,并添加300μL的PBS溶液溶解细菌。然后将细菌超声处理,并以12 000 r/min离心5 min,分离上清与沉淀,然后进行SDSPAGE蛋白电泳。
将目的蛋白诱导表达条件进行优化,分别设置IPTG终浓度梯度(0.10,0.25,0.50 mmol/L)、诱导时间梯度(1~6 h)和诱导温度梯度(25,28,32,35,37,42℃),将梯度表达产物,通过SDS-PAGE分析,确定最佳诱导表达条件,同时设置p ET-28a载体为阴性对照。
1.7表达产物的纯化和Western blot分析收集诱导培养的菌体,PBS洗涤3次后,冰浴条件下超声波破碎,然后通过Ni-NTA亲和层析柱纯化,最终获得可溶性的重组蛋白。用BCA蛋白浓度测定试剂盒测定重组蛋白浓度,蛋白于—80℃保存。将纯化后的重组蛋白,经SDS-PAGE电泳后,通过半干转印仪将蛋白条带转印至PVDF膜上,用2%BSA封闭4 h。然后,分别利用His标签单克隆抗体和PEDV阳性血清作为一抗,相应的山羊抗小鼠IgG和兔抗猪Ig G作为二抗,分别先后与PEDF膜杂交,最后ECL显色液显色,观察结果。
1.8重组蛋白免疫原性分析将25只BALB/c小鼠随机随机均分为5组,每组5只,分别为对照组(PBS)、S蛋白组、S-SEA蛋白组、S-EP-SEA蛋白组和PEDV弱毒疫苗组。经背部皮下多点注射,抗原量为100μg/只,首次接种后进行加强免疫,间隔14 d,加强免疫时各组蛋白、PBS及PEDV弱毒疫苗应与弗氏不完全佐剂乳化,抗原量为150μg/只。一免、二免后各组小鼠尾尖采血,三免后14 d眼球采血,均分离血清于—20℃保存。利用试剂盒检测特异性IgG抗体水平;取第3次免疫后血清,使用PBS稀释10倍后,使用细胞因子检测试剂盒进行IFN-γ、IL-2及IL-4的检测。
1.9数据统计分析本试验中小鼠血清中特异性IgG水平及细胞因子FN-γ、IL-2及IL-4含量检测所得数据均采用Graph Pad Prism 5.0数据统计软件进行分析,样本间显著性检验采用t检验。
2 结果
2.1多表位基因密码子优化结果利用在线密码子优化生物学 软件(http://www.jcat.de/)对SSEA基因、S-EP-SEA基因的密码子进行在线优化,优化在大肠杆菌表达系统中具有较差偏嗜性的碱基,同时优化A/T或G/C重复序列的碱基,密码子相对适应性得到显著升高,密码子适应指数(CAI)由原来的0.22增长至1.0。
2.2重组质粒构建与酶切结果以p ET-28a-S-EPSEA质粒为模板,经过PCR扩增,得到约为420 bp的条带,碱基大小与理论相符合(图1A)。对3个重组质粒分别进行双酶切鉴定,在1 132,1 143,420 bp处有清晰条带(图1 B,C,D)。然后,将重组质粒质粒pET-28a-S送至天津金唯智生物科技有限公司进行测序,与ET-28a-S-EP-SEA质粒S区段同源性100%,结果表明重组pET-28a-S质粒构建成功。

图1 PCR扩增及重组质粒的双酶切鉴定结果
2.3重组蛋白SDS-PAGE及Western blot分析结果重组质粒p ET-28a-S、p ET-28a-S-SEA和p ET-28a-S-EP-SEA分别转入BL21宿主菌后,经IPTG诱导后,进行含SDS-PAGE电泳。结果显示,分别出现蛋白相对分子质量为21,48,54 k Da的条带,与理论大小基本相符(图2~4)。此外,p ET-28a-SEP-SEA质粒最佳表达条件:温度为37℃;IPTG浓度为0.5 mmol/L;时间为6 h(图2);p ET-28a-SSEA和p ET-28a-S质粒的最佳表达条件均为:温度为28℃;IPTG浓度为0.5 mmol/L;时间为6 h(图3,4)。然后,分别以His标签抗体和PEDV高免血清分别作为一抗进行Western blot分析,结果显示3种重组蛋白在相应位置均出现特异性条带,而阴性对照组无特异性条带出现(图5),表明3种目的蛋白均获得表达。
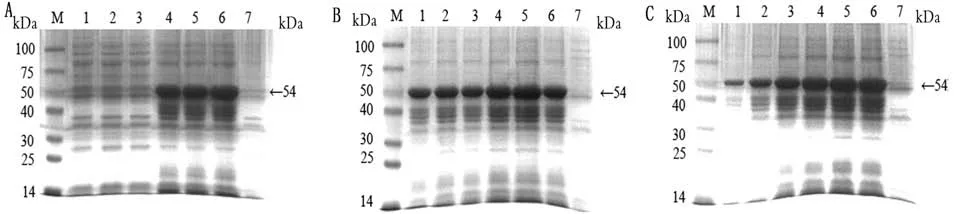
图2 p ET-28a-S-EP-SEA最佳诱导条件优化结果
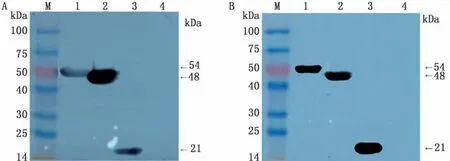
图5 Western blot结果

M.蛋白分子质量标准。A.SDS-PAGE分析及IPTG浓度筛选;A1~A3.质粒在28℃,上清诱导表达(0.10,0.25,0.50 mmol/L);A4~A6:质粒在28℃,沉淀诱导表达(0.10,0.25,0.50 mmol/L);A7.阴性对照。B.表达温度条件筛选;B1~B6.S-SEA重组蛋白(25,28,32,35,37,42℃);B7.阴性对照。C.表达时间筛选;C1~C6.S-SEA重组蛋白(1~6 h);7.阴性对照
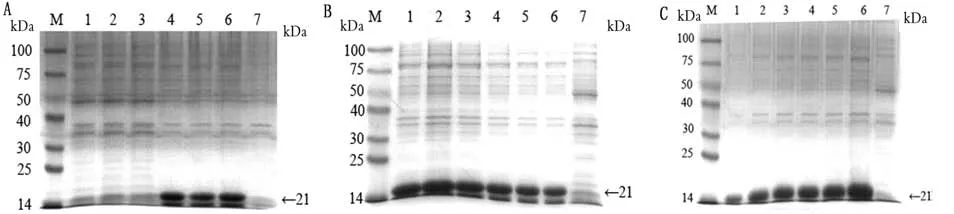
图4 p ET-28a-S最佳诱导条件优化结果
2.4小鼠血清IgG水平ELISA检测结果与对照组相比,首免、二免和三免后14 d各组小鼠血清中抗体水平均不同程度提高。三免后14 d,与对照组相比,S蛋白组和S-SEA蛋白组差异显著(P<0.05),S-EP-SEA蛋白组和弱毒疫苗组差异极显著(P<0.01)。与重组S蛋白组、S-SEA蛋白组相比,S-EP-SEA蛋白组和弱毒疫苗组差异均显著(P<0.05),且S-EP-SEA蛋白与弱毒疫苗组间比较差异不显著(P>0.05)(图6)。

图6 血清中特异性IgG抗体检测结果
2.5小鼠血清IL-2、IL-4和IFN-γ水平检测结果与对照组相比,三免之后14 d各免疫重组蛋白组小鼠血清中IFN-γ、IL-2和IL-4水平均有不同程度提高。其中,免疫S-EP-SEA蛋白组与对照组相比,小鼠血清中IL-2水平差异极显著(P<0.01),PEDV弱毒疫苗组则差异显著(P<0.05),与弱毒疫苗组相比,S-EP-SEA组差异亦显著(P<0.05)(图7 A)。与对照组相比,免疫各组小鼠血清中IL-4水平差异均极显著(P<0.01),3种重组蛋白组中S-EP-SEA组水平最高(图7 B)。与对照组相比,各重组蛋白组和PEDV弱毒疫苗组小鼠血清中IFN-γ水平差异均极显著(P<0.01),且S-EP-SEA和弱毒疫苗组间差异不显著(P>0.05)(图7 C)。

图7 细胞因子检测结果
3 讨论
据报道,病毒表面纤突蛋白S在病毒进入受体细胞内和病毒种间传播中发挥十分重要作用[5]。在PEDV侵入机体过程中,中和抗体也能够通过与S蛋白受体结合域的靶向结合来干扰病毒感染宿主这一过程[6-8]。相关报道显示,重组S蛋白能够刺激机体产生更多特异性的中和抗体,引起猪的保护性免疫且与PEDV其他蛋白相比具有更高的抗原性[9]。因此,S基因不仅可以作为PEDV的诊断基因,也往往作为开发针对PED新型疫苗的候选基因[10]。SEA作为超抗原家族中对T细胞最有效的刺激剂,在极低浓度下便可激活大量淋巴细胞活化,并刺激分泌大量的细胞因子[11]。同时,SEA能够激活淋巴细胞中的Th1细胞大量增殖,Th1细胞介导细胞免疫,在机体免疫调节过程中发挥作用[12]。本研究在对国内流行PEDV毒株序列分析基础上,选取有效且保守的线性抗原表位基因(EP),与经典毒株S基因和SEA基因连接,并柔性肽连接,以减少直接连接造成重组蛋白空间构象的改变。同时,为提高重组蛋白产量和减低成本,采用了大肠表达系统作为重组蛋白生产系统[13],并根据大肠杆菌密码子偏嗜性对基因进行了优化。将构建的3种质粒转入BL21宿主菌,经IPTG诱导后,进行SDSPAGE电泳和Western-blot分析,结果显示3种重组蛋白(S、S-SEA和S-EP-SEA)均获得高效表达,且能被PEDV阳性血清识别。此外,本研究中选择的表达载体,其所携带的His标签分子质量较小,可以获得较多高活性的重组蛋白,有利于重组蛋白的纯化及对其进行免疫原性分析[14]。由于大肠杆菌中的重组蛋白常常表达以包涵体形式存在,因此需要将包涵体蛋白质通过完全复性再在体外进行重新折叠[15]。本研究使用通过Ni-NTA亲和层析柱纯化法将以包涵体形式存在的重组蛋白进行纯化,最终成功纯化出了具有特异性条带的可溶性蛋白,满足了后续试验研究的需求。
亚单位疫苗是通过提取病原体的部分蛋白质,筛选出具有免疫原性片段,然后进一步纯化和组装而成的疫苗[16]。亚单位疫苗不但可以诱导动物机体产生体液、细胞免疫应答,且免疫时间持续较长,较传统疫苗更加稳定、安全。在本研究中,使用纯化的重组蛋白S-EP-SEA蛋白,S-SEA蛋白,S蛋白,PEDV弱毒疫苗和PBS(对照组),对6周龄的BABL/c小鼠进行了3次免疫。在初次免疫和二次免疫后,3种重组蛋白和弱毒疫苗可以诱导小鼠机体产生的特异性IgG。第3次加强免疫后的血清IgG水平显著提高,表明制备的重组蛋白均能刺激小鼠机体产生较高滴度的IgG,且S-EP-SEA组与弱毒疫苗组相比差异不显著(P>0.05),而与S-EPSEA重组蛋白组与弱毒疫苗组与PBS对照组比较差异均为显著(P<0.05)。这一结果表明,在3种重组蛋白中,重组蛋白S-EP-SEA具有更优异的免疫原性。
在动物机体中,IL-2、IL-4和IFN-γ作为重要的细胞因子,具有重要的免疫调节作用[17]。其中,IL-2和IFN-γ来源于CD4+Th1细胞,在细胞免疫反应中起关键作用,IL-2还能够刺激活化B淋巴细胞增殖并具有促进免疫球蛋白分泌的功能[18-19],IL-4则在动物机体的体液免疫过程中发挥重要作用[20]。为了研究重组蛋白对免疫小鼠细胞免疫影响,对三免后小鼠的IL-2、IL-4和IFN-γ水平进行检测,结果显示3种重组蛋白可诱导IL-2、IL-4和IFN-γ升高,其中以S-EP-SEA蛋白效果最好,与PEDV弱毒疫苗差异不大,表明重组蛋白S-EP-SEA能够刺激机体产生高水平细胞免疫。本研究初步确定了携带超抗原SEA多表位疫苗具有良好的免疫原性,但对中和抗体水平的影响极其保护作用将是今后进一步研究的课题。
