白桦BpERF98基因的遗传转化及非生物胁迫应答反应
2022-03-02闫思宇
李 麒 闫思宇 陈 肃
(林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040)
低温和盐碱是限制植物生长发育的主要非生物胁迫,这些非生物胁迫会导致植物减产而造成巨大的经济损失。据报道,甘蔗()在遭受寒冻害后发生线粒体解体且保护酶和渗透调节物质均发生变化;盐胁迫使杨树()的膜脂过氧化程度和电解质外渗率显著增加;在玉米()研究中发现低温胁迫使玉米超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等活性改变,糖、抗坏血酸、谷胱甘肽含量也发生变化。同时也有研究表明,植物可以通过调节自身的生理和形态的变化来提高对非生物胁迫下的适应性。例如,SOD、POD在非生物胁迫下被激活以抵御超氧自由基的毒害。因此,通过测量胁迫后SOD、POD活性、MDA含量以及相对电导率等生理指标可有效研究植物抗逆性,为提高林木抗性、增加苗木成活率、扩大林木栽培面积提供重要依据。
当植物遭受非生物胁迫时,体内的信号转导系统积极调控,其中不乏一些重要的调控基因,如植物中特有的AP2∕ERF 转录因子家族。根据编码AP2 结构域的数量及序列的相似性,AP2∕ERF 基因家族又被具体细分为3 个家族:AP2 亚家族(编码2 个AP2 结构域)、ERF 亚家族(编码1 个AP2 结构域)和RAV 亚家族(编码一个B3 结构域和一个AP2结构域)。AP2亚家族转录因子主要负责调控种子萌发、花器官的形成等过程;ERF 亚家族分为ERF 亚族(结合GCC-box 等顺式作用元件来调控下游靶基因的表达)和DREB 亚族(结合在启动子DRE 元件上,启动下游基因表达);RAV 亚家族分为RAV1 亚族和RAV2 亚族,可通过负调控FT 和赤霉素途径,防止植株提早开花。
ERF 亚家族在植物响应生物和非生物胁迫过程中发挥重要作用。研究发现,几种水杨酸(SA)、茉莉酸(JA)和乙烯诱导的ERF整合了不同的信号通路,以介导植物对不同病原体和疾病条件的防御反应。辣椒()基因受水杨酸、茉莉酸甲酯和乙烯胁迫诱导,特别在青枯病感染时表达量增高,在植物抵抗感染的过程中发挥正调控作用。大豆()基因在干旱、盐、脱落酸、乙烯,以及大豆花叶病毒的诱导下均应答,并且能够增强植物抗花叶病毒和链格孢菌的能力。用乙烯处理香蕉()果实,发现与表达量变化显著,经少量外源乙烯诱导可以促进两者及香蕉中乙烯合成关键基因和的表达,并促进香蕉果实合成并释放乙烯,证明ERF 类转录因子参与乙烯的生物合成及信号传导。而在小麦()、白桦()、柑橘()和番茄()中的研究则表明,基因亦响应干旱、低温、盐和各种植物激素等胁迫,具有重要的抗逆调控作用。虽然目前对于ERF 家族的研究较多,但是其在木本植物中的作用仍需要进一步探究。
白桦属于落叶乔木,树形优美,可作行道树和观赏树,且材质坚硬适合制作家具、筷子和纸浆。白桦树皮具有抗肿瘤、抗病毒等药用价值。因其在木本植物中较为经典,生长周期短且抗寒性强,故用于本实验。并且本实验室通过前期实验分析发现白桦基因(与拟南芥基因序列较为相似故命名)在处于非生物胁迫时的表达量显著上调,因此推测该基因有助于白桦植株对非生物胁迫的抵御,故克隆全长cDNA 序列,构建过表达载体,成功获得过表达的转基因株系,为研究白桦非生物胁迫形成的分子基础研究及抗性分子育种提供理论数据和研究材料。
1 材料和方法
1.1 试验材料
转基因植物受体材料为野生型白桦组培苗。组织培养室温度为24 ℃,光周期为16 h光照和8 h黑暗。选择发育状态良好的较大叶片作为遗传转化的受体。
大肠杆菌()感受态细胞TOP10购买于昂羽生物有限公司。农杆菌GV3101,植物表达载体pROKⅡ菌株为实验室保存菌种。酶和T链接酶购买自大连宝生物有限公司。
1.2 ERF98基因的多序列比对分析
白桦的基因序列:
ATGGAAAAAGAGGGGAAGGGTCAGGGCAA AGAAGATGGGGAAAAAGATGTGCGTTACAGGG GAGTGAGACGGCGGCCGTGGGGGAAATACGCG GCGGAGATTCGTGACTCCACTAGGCATGGTGCC CGGCTGTGGCTGGGGACTTTTGACAGGGCAGAA GATGCGGCTCGGGCTTATGATCGAGCCGCCTTTG CAATGAGGGGAAACATGGCCATTCTTAACTTCC CCGATGAACACCGGTCACCACCCAATGTGGATT TTCCACCTCCTTCCTCTTCCTTGGCATCATCGTCA TCATCGTCGTCCTCATCCTCTTCATCGCAGGTTG ATAGAAATAGTAGTAGGTCTGAGCTTGGGAAAG AGGTTTTTGAGTTTGAGTATTTGGACGACAAGTT GTTGGAGGAACTTCTTGATTTTGATTACAAAACAAAGAAGAACTGA
利用NCBI 网站进行同源基因的查找。在BioEdit 软件中进行蛋白质多序列比对,比较同源基因的差异性。利用MEGA 5.1 软件制作进化树,比较同源基因的亲缘性。
1.3 白桦BpERF98基因的克隆及其植物载体构建
利用RNA 试剂盒(无锡百泰克生物技术有限公司)提取白桦总RNA,利用反转录试剂盒(东洋纺)合成cDNA作为基因克隆模板。根据植物过表达载体pROKⅡ的多克隆位点和基因特征,在设计引物时在基因两端分别添加和限制性内切酶位点(见表1)。将以白桦cDNA 为模板克隆获得的基因插入到两个酶切位点中间。通过聚合酶链式反应(PCR)进行目的基因扩增(反应程序:94 ℃预变性2 min;98 ℃变性10 s;60 ℃退火30 s;68 ℃延伸1 min;30 个循环;68 ℃延伸5 min)。经1%琼脂糖凝胶电泳检测合格后,使用胶回收试剂盒(Omega)回收,回收产物使用T4 链接酶连接到pROKⅡ载体上并转入到大肠杆菌感受态细胞中,通过筛选后送至擎科测序公司进行DNA 测序。通过冻融转化法,将带有的目的基因的载体转化至农杆菌GV3101中,保存在-80 ℃备用。
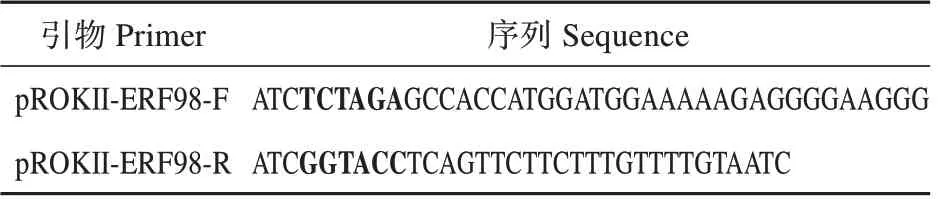
表1 BpERF98的引物序列(黑色为酶切位点)Table 1 Primer sequences used for BpERF98 clone(The balck is the restriction enzyme cutting site)
1.4 白桦BpERF98基因遗传转化及分子检测
采用叶盘转化法转化生长良好的野生型白桦叶片,获得转基因株系。对转基因株系分株,提取DNA(天根生化科技有限公司),并进行PCR 实验,使用1%琼脂糖凝胶电泳进行检测,筛选转基因株系并进行无性系繁殖。
1.5 转基因植物的非生物胁迫分析
对获得的转基因株系和野生型白桦进行大量的扩繁,待其生根后移栽至土壤中,继续培养1 个月后进行非生物胁迫处理,测量相对电导率、超氧化物歧化酶(SOD)的活性(分光法,苏州科铭生物技术有限公司)、过氧化物酶(POD)的活性(分光法,苏州科铭生物技术有限公司)和丙二醛(MDA)的含量(分光法,苏州科铭生物技术有限公司)等生理指标。进行3次生物学重复并计算平均值和标准误差,使用prisn 6.0进行多重分析。白桦植株在组织培养室和温室中培养,温度均为24 ℃,光周期均为16 h 光照和8 h 黑暗。根据生长状态选取了转基因株系L1、L4、L12、L14 和L15 进行非生物胁迫实验。
1.5.1 盐胁迫
选用生长状态相同的白桦土培苗(1 月龄植株,株高20 cm 左右),使用NaCl的等渗溶液即150 mmol·LNaCl进行胁迫实验。保持土壤的盐分水平相同,在胁迫0、1、3 和5 d 后进行取样(选取第3片到第5片功能叶片,用锡纸包裹放入液氮速冻),保存样品至-80 ℃冰箱内,并测量其生理指标。
1.5.2 低温胁迫
选用生长状态相同的白桦土培苗(1 月龄植株,株高20 cm 左右),利用低温光照培养箱(5 ℃,光周期为16 h光照∕8 h黑暗)模拟低温胁迫。在胁迫0、3和5 d后进行取样(选取第3片到第5片功能叶片,用锡纸包裹放入液氮速冻),保存样品至-80 ℃冰箱内,并测量其生理指标。
1.5.3 冻害胁迫
选用生长状态相同的白桦土培苗(1 月龄植株,株高20 cm 左右),利用零下培养箱(-5 ℃)处理5 min 后取出恢复正常培养,1 d 后进行取样(选取第3 片到第5 片功能叶片,用锡纸包裹放入液氮速冻),保存样品至-80 ℃冰箱内,并测量其生理指标。
2 结果与分析
2.1 ERF98基因的多序列比对分析
根据蛋白质序列比对结果可以看出,相似性在80%左右,不同之处可能是由于基因表达的差异。根据蛋白质多序列比对结果可以看出,白桦与拟南芥、樟子松、茶树芙蓉雷公藤枣番木瓜和草莓等的结构域相同,同属于ERF 亚家族,故而推测它们在功能上可能相似。
2.2 BpERF98基因的克隆及其植物载体构建
以野生型白桦cDNA为模板,使用特异性载体基因引物pROKⅡ-ERF98-F 和pROKⅡ-ERF98-R,利用RT-PCR进行目的基因克隆扩增(见图2)。利用和酶对pROKⅡ载体和PCR 产物进行双酶切,再使用T连接酶将目的基因与载体相连接并转化至大肠杆菌感受态中,选取阳性单克隆进行菌液PCR,测序并比对原始序列,结果符合一致即成功获得带有基因的表达载体。
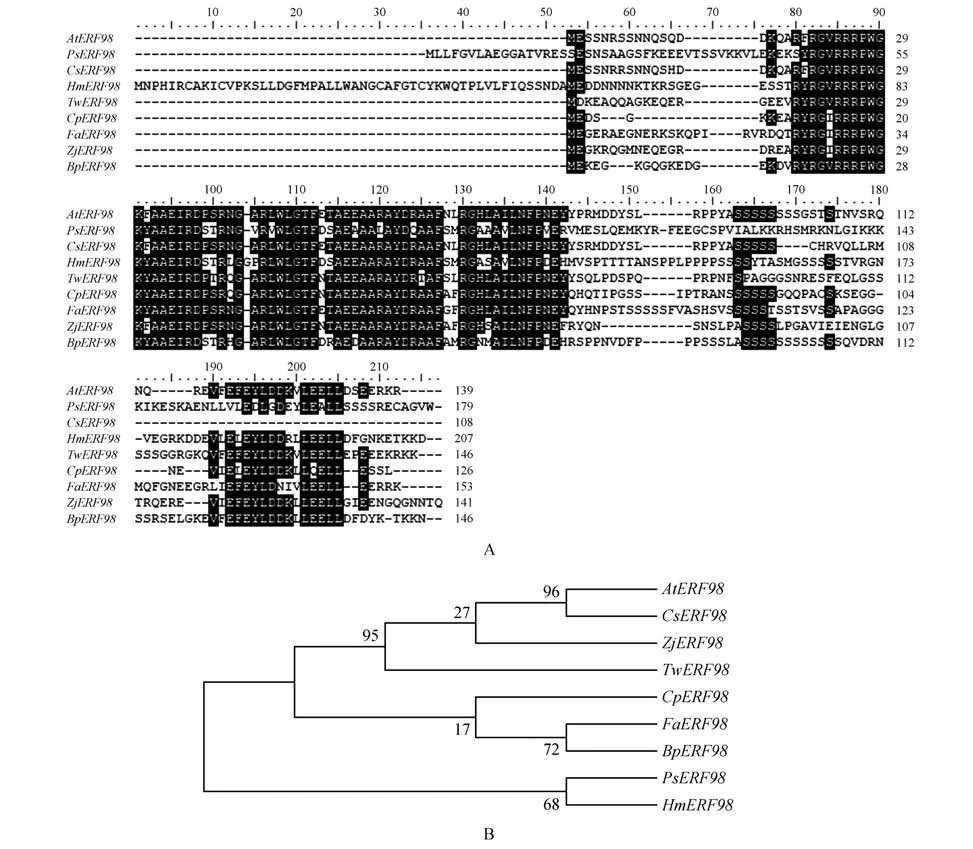
图1 多序列比对A.蛋白质序列比对;B.蛋白质进化树(AtERF98:NM_113224.3;PsERF98:XM_023017227.1;CsERF98:XM_010513891.2;HmERF98:XM_039165326.1;TwERF98:XM_038864613.1;CpERF98:XM_022042754.1;FaERF98:XM_011459695.1;ZjERF98:XM_016035968.2)Fig.1 Multiple gene sequence alignmentA. Gene sequence alignment;B. ERF98 gene evolutionary tree(AtERF98:NM_113224.3;PsERF98:XM_023017227.1;CsERF98:XM_010513891.2;HmERF98:XM_039165326.1;TwERF98:XM_038864613.1;CpERF98:XM_022042754.1;FaERF98:XM_011459695.1;ZjERF98:XM_016035968.2)
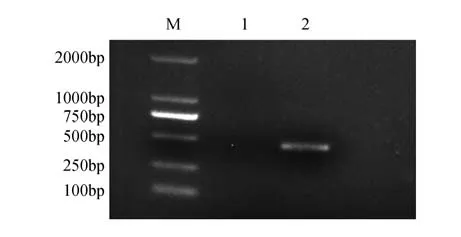
图2 BpERF98基因的克隆M.DNA Marker DL2000;1.水;2.目的基因BpERF98Fig.2 Cloning of the BpERF98 geneM.DNA Marker DL2000;1.Water;2.Vector containing BpERF98
2.3 白桦BpERF98基因遗传转化及分子检测
2.3.1 转基因株系的获得
用含有pROKⅡ-ERF98 载体的农杆菌侵染野生型白桦叶片,共培养2 d 后进行脱菌,并放置在含有30 mg·L卡那霉素、200 mg·L头孢霉素和200 mg·L特美汀的分化培养基上(WPM+0.8 mg·L,6-BA+0.02 mg·L,NAA+0.05 mg·L,GA+2%(w∕v)蔗糖,调节pH 至5.8~6.0)。培养25 d 左右可见伤口处长出愈伤组织,待长出不定芽后移栽至生根培养基中(1∕2 MS+0.02 mg·LNAA+2%(w∕v)蔗糖,调节pH至5.8~6.0),获得转基因株系。
2.3.2 转基因株系的鉴定
提取转基因株系和野生型白桦苗的基因组DNA(天根生化科技有限公司),利用载体上游引物和下游目的基因引物进行PCR 检测。使用1%的琼脂糖凝胶进行电泳(选取转基因株系L1、L3、L4、L5、L6、L7、L8、L9、L10、L11、L12、L14和L15进行DNA检测),结果显示目的条带与阳性对照位置一致(见图3),证明基因成功转入白桦基因组中。

图3 转基因株系鉴定M.DNA Marker DL2000;1~13.BpERF98转基因株系;14.阳性对照(质粒);15.野生型株系(WT);16.阴性对照(水)Fig.3 Identification of transgenic strainsM.DNA Marker DL15000;1-13.BpERF98 transgenic strain;14.Positive control(plasmid);15.Wild-type strain(WT);16.Negative control(water)
2.4 转基因植物的非生物胁迫分析
2.4.1 盐胁迫生理指标的变化
在图4 中,通过顶芽表型看出在第3 天野生型白桦边缘出现损伤,在第5天时损伤扩大。转基因株系并没有出现叶片损伤。结果表明,随着盐胁迫时间的增加,野生型白桦受到的损害越来越大,转基因株系随着时间的推移抗逆物质逐渐增多,提高了白桦对盐胁迫的耐受能力。
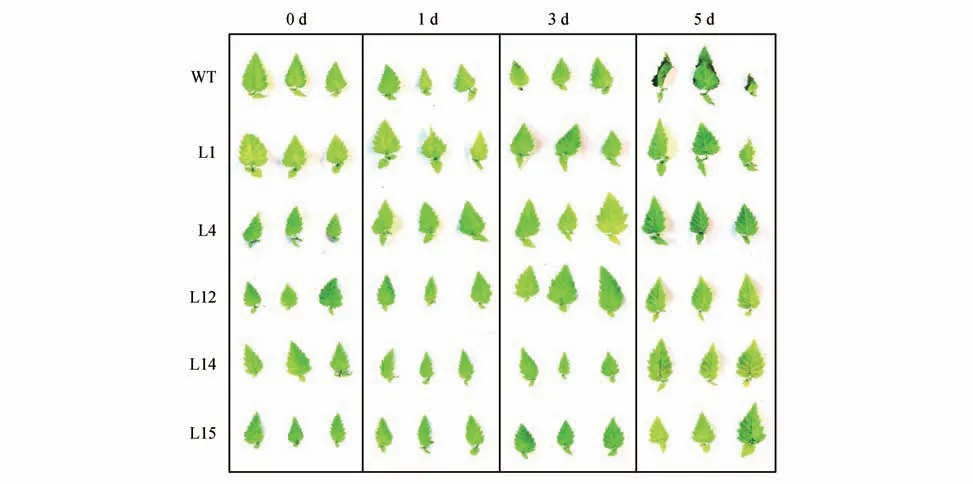
图4 盐胁迫顶芽表型Fig.4 Terminal bud phenotype under salt stress
如图5 所示,随着盐胁迫时间的加长,野生型白桦的相对电导率及MDA 含量明显升高,在第五天时达到峰值。而与野生型相比,转基因株系受到伤害程度较小,受伤害程度没有明显的起伏。转基因株系在SOD与POD活性的增长趋势较野生型白桦有大幅度提高,尤其转基因4号株系在遭受盐胁迫时酶的活性较高,在第5天时酶的活性达到最大值。
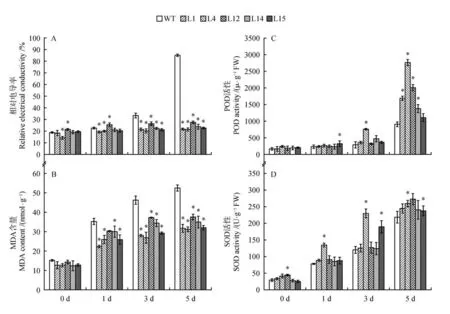
图5 盐胁迫生理指标A.相对电导率受损指标;B.丙二醛含量的积累;C.过氧化物酶活的含量;D.超氧化物歧化酶活性的含量Fig.5 Physiological indexes of salt stressA.Damage index of relative electrical conductivity;B.Accumulation of malondialdehyde content;C.Content of peroxidase activity;D.Content of superoxide dismutase activity
2.4.2 低温胁迫生理指标的变化
低温胁迫处理5 d 后,转基因1 号株系由于产生了花青素而导致叶脉变红,其他各株系顶芽表型没有明显变化(见图6)。在第10 天野生型白桦和转基因株系1号发生变黄和变红,其它转基因株系发生了主叶脉变红。结果表明,转基因株系产生了更多的抗逆物质,从而抵御了低温胁迫使植株保持良好的生长状态。

图6 低温胁迫顶芽表型Fig.6 Terminal bud phenotype under low temperature stress
在零上5 ℃的低温胁迫下白桦苗均呈现不同程度的伤害。通过图7 可以看出野生型株系的相对电导率和MDA 含量较转基因株系高,并在第5天就有了明显的增长趋势,第10天尤其明显,说明受损情况严重。转基因株系在SOD和POD的活性增长情况比野生型白桦较快。第10天酶活性增长情况比第5 天酶活性增长程度大。转基因株系4号和12号在酶的活性增长程度上较快。
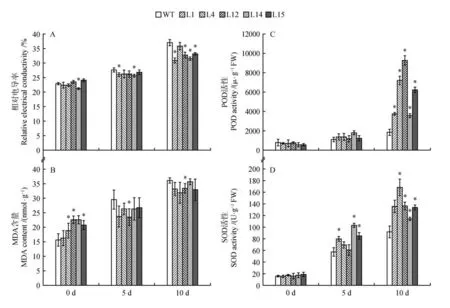
图7 低温胁迫生理指标数据A.相对电导率受损指标;B.丙二醛含量的积累;C.过氧化物酶的活性含量;D.超氧化物歧化酶的活性含量Fig.7 Physiological index data of low temperature stressA.Damage index of relative electrical conductivity;B.Accumulation of malondialdehyde content;C.Content of peroxidase activity;D.Content of superoxide dismutase activity
2.4.3 冻害胁迫生理指标的变化
在恢复培养后1 d 观察到野生型白桦苗顶芽边缘受损,第一片小顶芽均发黑枯萎(见图8),转基因株系1号部分受损,其他转基因株系叶片完好并没有受到损伤。

图8 冻害胁迫顶芽表型Fig.8 Terminal bud phenotype under freezing stress
通过模拟北方特有的倒春寒气候发现,野生型白桦苗在-5 ℃时受到的损害较转基因株系大。如图9 所示,转基因15 号株系的MDA 的含量与野生型和其他转基因株系相比积累的较少,且转基因株系的SOD与POD活性的增长情况均超过野生型白桦。其中,转基因株系1 号POD 活性增加是其他类型的2倍左右,转基因株系4号SOD 的活性增长较野生型白桦的增长情况更为显著。
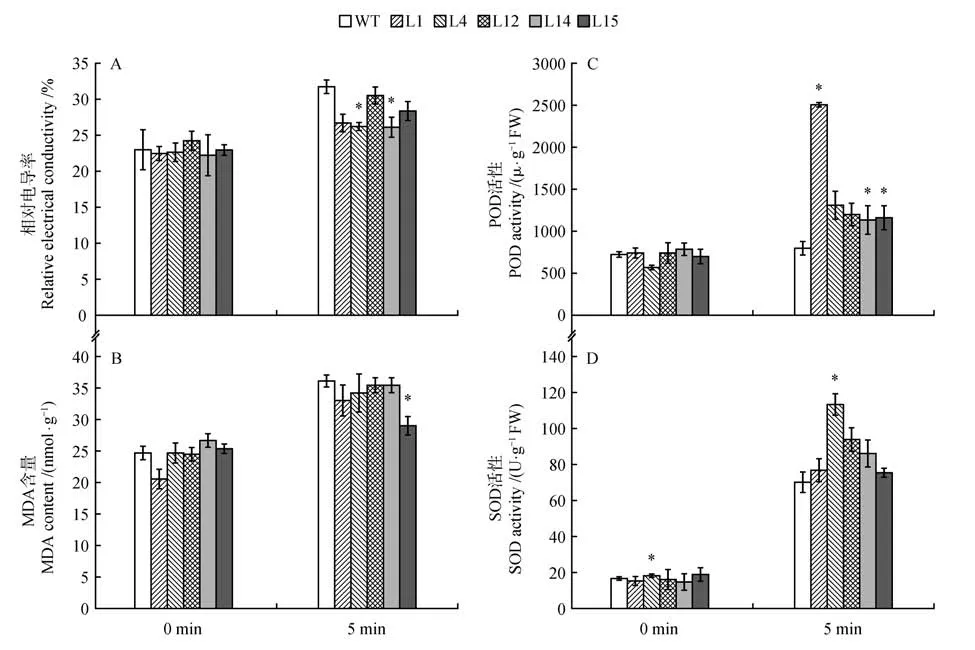
图9 冻害胁迫生理指标数据A.相对电导率受损指标;B.丙二醛含量的积累;C.过氧化物酶的活性含量;D.超氧化物歧化酶的活性含量Fig.9 Physiological index data of freezing injury stressA.Damage index of relative electrical conductivity;B.Accumulation of malondialdehyde content;C.Content of peroxidase activity;D.Content of superoxide dismutase activity
3 讨论
植物在受到胁迫刺激时,细胞内会迅速积累相应的溶质和保护剂,像渗透调节物质(包括糖、氨基酸、脂肪酸等)及抗氧化酶(包括SOD、POD 和CAT 等)。一些分子通过增加细胞的水势来帮助细胞重新建立渗透平衡,保护细胞在稳定细胞器、蛋白质和膜方面发挥关键作用。ERF 亚家族作为乙烯应答转录因子,可以特异性结合基因组上游的AGCCGCC 元件(GCC-box)从而参与乙烯应答、抗病及非生物胁迫。据已报道的ERF 家族基因多数能够响应低温、干旱、盐碱、病害和机械损伤并且能够被脱落酸(ABA)、乙烯(ET)、茉莉酸(JA)、水杨酸(SA)等内源激素诱导而参与不同的信号调节途径。植物激素信号在非生物胁迫响应发挥着关键作用,协调各种信号转导途径。在对环境胁迫的反应中,内源性ABA水平迅速升高,进而激活特定的信号通路并改变基因表达。乙烯对植物在非生物胁迫条件下的适应和生存也起着至关重要的作用。乙烯响应因子通过拟南芥中抗坏血酸合成的转录激活增强对盐的耐受性。可以调控ERF 转录因子的表达,进而在活性氧清除中发挥作用。EFE 是乙烯生成过程中非常重要的酶,已有大量的研究表明ERF 类转录因子在低温等非生物胁迫下发挥重要的作用。花烟草()基因的表达,受低钾、ABA 的强烈诱导,同时,也在转录水平上对PEG、高盐、低温及HO的胁迫有较为明显的响应。烟草()转录因子ERF 基因的过表达植株抗旱、耐高盐与低温能力较好,辣椒基因可能参与低温胁迫应答。小黑杨(×)转录因子基因的过表达植株通过细胞的渗透调节能力提高耐盐能力,葡萄()转录因子和基因通过降低MDA 的含量降低膜脂过氧化的程度,増加SOD、POD 和CAT 的活性提高去除ROS的能力来实现提高过表达植株的耐低温能力,柑橘属佛手(L.var.)基因可通过阻止活性氧的过氧化,降低丙二醛等有毒物质的积累发挥作用,使质膜受到保护等。因此,本实验中获取了过表达ERF 类转录因子的白桦苗,通过观察其顶芽形态及测量生理指标(相对电导率、MDA 含量、POD 和SOD 的活性),分析对比野生型白桦与转基因型白桦在非生物胁迫处理下的差异。
植物在逆境胁迫或衰老过程中,细胞内活性氧代谢的平衡被破坏,导致活性氧的积累。活性氧的危害是引发或加剧膜脂的过氧化作用,造成细胞膜系统的损伤,严重时会导致植物细胞死亡。丙二醛是植物器官在逆境条件下或衰老时发生膜脂过氧化作用而产生的一种有机化合物,它的产生加剧膜的损伤。因此,MDA 产生数量的多少能够代表膜脂过氧化的程度,也可间接反映植物组织的抗氧化能力的强弱。同时,相对电导率也是衡量细胞膜受损情况的一个重要指标,逆境胁迫下细胞膜受损导致电解质外渗增加,破坏细胞膜结构的完整性,从而影响植物的抗逆能力。在本实验的研究中发现,无论是在盐胁迫、低温胁迫还是冻害胁迫中,转基因型白桦植株的相对电导率及MDA 含量均低于野生型(图5,7 和9)。这些代表细胞膜损伤程度的生理指标的相对降低表明ERF 基因的过表达对于保护白桦细胞膜具有积极作用,可以通过对细胞膜伤害的降低来增加抵御非生物胁迫的能力。此外,在盐胁迫中,转基因植株的相对电导率及MDA 含量的增加显著低于野生型植株(见图5),这可能意味着ERF基因的过表达对于盐胁迫下细胞膜的保护具有更重要的意义。
SOD 广泛的存在于微生物、动物、植物和培养细胞中,SOD 不仅是超氧化物阴离子消除酶,也是HO主要生成酶,在生物抗氧化系统中具有着重要作用。SOD 是一种源于生命体的活性物质,能消除生物体在新陈代谢过程中产生的有害物质。POD 是以过氧化氢为电子受体催化底物氧化的酶。主要存在于载体的过氧化物酶体中,以铁卟啉为辅基,可催化过氧化氢,氧化酚类和胺类化合物和烃类氧化产物,具有消除过氧化氢和酚类、醛类、胺类、苯类毒性的双重作用。从本实验的结果来看,在3 种非生物胁迫中,随着胁迫时间的增加,过表达ERF 株系的POD、SOD 的活性均高于野生型植株。值得注意的是,转基因4号株系的SOD 的活性表现出了更高的优势(见图5,7,9),表明转基因4 号株系对于SOD 活性的调控可能更为重要。
4 结论
成功构建植物表达载体,获得转基因株系。进行了盐胁迫、低温和冻害胁迫的抗性实验,转基因株系在各个胁迫中表现都优于野生型株系。转基因株系中酶活性的快速增长为过表达ERF 基因的白桦维持了一个较低的受损情况,猜测其产生了大量抵御物质保卫白桦从而降低受损情况。推测基因改善了植物的耐盐和抗寒性。如何通过调控白桦的抗逆机制还需进一步深入研究。
