超薄Fe1Ni4OH纳米片电催化剂的制备及其性能
2022-03-01初园园邓柏晗谭小耀
初园园,邓柏晗,谭小耀
(天津工业大学化学与化工学院,天津 300387)
为应对全球能源形式逐渐向清洁能源转型的需求,电解水制氢气[1-3]、燃料电池[4-5]及金属空气电池[6-8]等能量转换技术得到重视。氧气析出反应(OER)作为众多能量转换技术的关键步骤,存在动力学缓慢的问题,造成过高的超电势和较低的能量转换效率,大大阻碍了这些新型能源转换技术的发展[9-10]。而目前IrO2、RuO2、Pt/C等贵金属催化剂虽然经过大量的研究已被证明具有较高的OER活性,被公认为是最先进的OER催化剂[11],然而由于贵金属稀缺且昂贵导致不利于大量生产应用,因而开发非贵金属基OER催化剂成为研究热点[12]。
在众多非贵金属催化剂中,Ni基催化剂因其卓越的OER催化性能而被广泛研究,其中包括Ni(OH)2[13]、NiO[14]、NiS[15]、NiP[16]等。然而这些催化剂的OER活性仍无法满足其商业化要求。研究发现,制备双金属Ni基催化剂是提高单金属Ni基催化剂的有效途径,特别是由铁掺杂镍基催化剂形成的含有类似α-Ni(OH)2结构的FeNi双羟基氧化物催化剂表现出了比单金属催化剂更加优异的OER催化性能。如Liu等[17]制备的非晶态NiFe-层状双氢氧化物纳米片对OER的电催化活性远高于RuO2,在10 mV/cm2时的过电位仅为241 mV。Wu等[18]制备了ZIF-67诱导NiFe-LDH纳米片(NiFe-LDH/ZIF-67),在10 mA/cm2下,NiFe-LDH/ZIF-67对OER的过电位为222 mV。然而这些催化剂的制备方法往往步骤冗杂且周期长,耗时耗力的同时必然造成制备成本的提升,一定程度上阻碍了催化剂的大规模生产。更重要的是,目前对于Fe元素的掺杂量的调控不足、因高温引起的活性位团聚导致活性位点暴露不足等问题,限制了Fe/Ni-OH类催化剂OER性能的充分发挥。因而采用简洁高效的方法进行金属离子的调控以制备出具有高效OER催化性能的非贵金属催化剂依然存在巨大挑战。
本文在常温下利用简单的一步还原反应法制备Fe掺杂α-Ni(OH)2的Fe1Ni4OH 3D超薄纳米片催化剂,利用NaBH4的强还原作用和高浓度表面活性剂CTAB的塑形功能,调控Fe元素的掺杂量制备出具有高OER催化活性的Fe1Ni4OH 3D纳米片,并研究其性能。
1 实验部分
1.1 实验材料与设备
主要材料:Fe(NO3)39H2O(AR)、Ni(NO3)36H2O,分析纯,天津市江天化工试剂有限公司产品;十六烷基三甲基溴化铵(CTAB)、NaBH4、科琴黑(KB)、无水乙醇,分析纯,天津市科密欧试剂有限公司产品;全氟磺酸(Nafion,质量分数为5%),阿法埃莎(中国)化学有限公司产品。
主要设备:CHI 760E型电化学工作站,上海辰华仪器有限公司产品。
1.2 超薄FeNiOH纳米片的制备
首先将总物质的量为2 mmol的Fe(NO3)3·9H2O和Ni(NO3)3·6H2O按照摩尔比1∶4溶解到25mL的去离子水中,再称取0.5 g的CTAB溶入上述混合溶液,磁力搅拌30 min,使其形成均匀且透明的粘稠溶液;称取0.1 g NaBH4溶入10 mL去离子水中,逐滴滴入上述混合溶液,完成上述过程后在磁力搅拌下继续反应10 min;离心分离收集沉淀物并用无水乙醇清洗3~5次,60℃下干燥6 h即可。将按不同比例所制得的样品依次命名为Ni(OH)2、Fe1Ni9OH、Fe1Ni7OH、Fe1Ni4OH、Fe1Ni3OH。
1.3 工作电极的制备
本文所用工作电极为旋转圆盘玻碳电极(0.196 2 cm2)。工作电极使用前进行清洁:圆盘电极使用氧化铝抛光粉悬浊液进行抛光后,用去离子水和乙醇反复冲洗3次,在空气中晾干备用。称取5 mg催化剂和0.6 mg KB,将其分散在500μL无水乙醇和30μL Nafion(质量分数5%)混合溶液中,超声处理30 min形成均匀的油墨,滴加8μL油墨至圆盘电极,在空气中自然晾干。
1.4 电化学性能测试
常温下,在含饱和O2的0.1 mol/L KOH的电解液中使用三电极系统进行电化学测试。以石墨棒为对电极、以Ag/AgCl电极作为参比电极、以负载有催化剂的圆盘电极作为工作电极进行测试。
使用线性伏安法(LSV)对催化剂OER性能进行测试,圆盘电极转速为1 600 r/min,扫描电压范围为0~0.9 V(相对于Ag/AgCl电极),扫描速率为5 mV/s。使用计时安培法(i-t)对催化剂进行稳定性测试,电压为0.63 V(相对于Ag/AgCl电极),时间为10 000 s。电化学阻抗EIS的交流频率范围为100 000~0.1 Hz,电压为0.6 V(相对于Ag/AgCl电极)。
根据能斯特方程对所有电压进行校正:
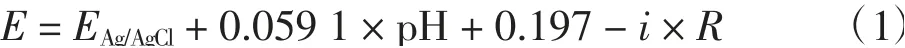
式中:0.1 mol/L KOH在常温下的pH为13.3;i为对应电压下所测电流(A);R为电解液阻抗(42Ω)。
Tafel曲线按照公式(2)、(3)和(4)所得:

式中:η表示超电位(V);j为电流密度(mA/cm2);i表示对应超电位下电流(mA);b为Tafel斜率。
TOF由公式(5)计算:

式中:i表示特定电位下电流(A);F表示法拉第常数96 485.3 C/mol;n表示工作电极表面负载的催化剂所含金属的摩尔量。
2 结果与讨论
2.1 结构与形貌表征
图1为未添加Fe元素制得的Ni(OH)2和掺杂Fe元素所制得的Fe1Ni4OH的XRD衍射图谱。
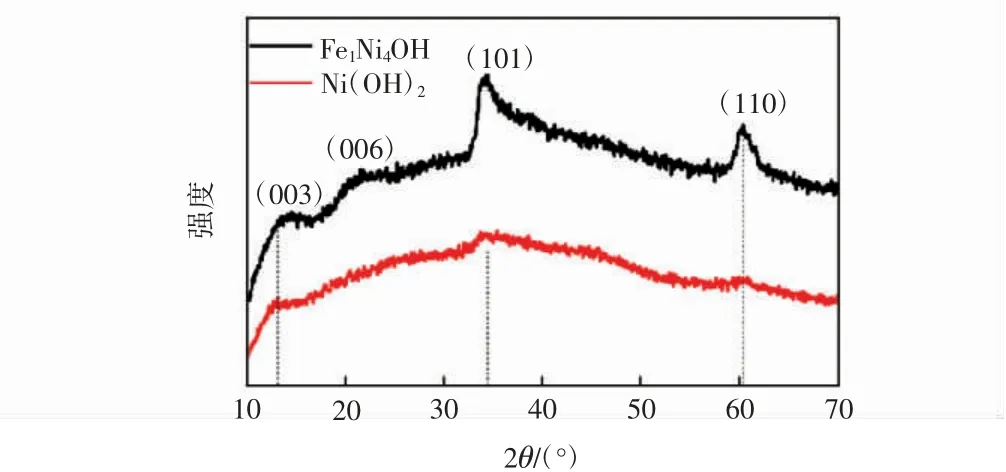
图1 Ni(OH)2和Fe1Ni4OH的XRD图谱Fig.1 XRDspectrum of Ni(OH)2 and Fe1Ni4OH
由图1可知,Ni(OH)2对应的XRD衍射图谱中,2倍衍射角在大约13.1°、21.8°、34.4°和60.4°处出现的微弱的衍射峰分别表示α-Ni(OH)2的(003)、(006)、(101)和(110)相,与之前报道的文章数据相吻合[18-19]。与此相比,Fe1Ni4OH对应的XRD衍射图谱在相同位置出现衍射峰,表明Fe1Ni4OH保留α-Ni(OH)2的晶相,而(101)与(110)所对应的衍射峰强度增强则表明α-Ni(OH)2的结晶程度的提高。
为了进一步讨论所制样品的形貌,对所制的Ni(OH)2和Fe1Ni4OH进行了扫描电镜(SEM)及透射电镜分析(TEM)。图2分别表示在相同放大倍数下的Fe1Ni4OH和Ni(OH)2的扫描电镜图、透射电镜图及高倍透射电镜图(HRTEM)。
由图2(a)、图2(b)可知,Ni(OH)2表现为由极小的纳米片堆积成的不规则纳米簇结构。由图2(c)、图2(d)可知,掺杂Fe元素后,Fe1Ni4OH表现为超薄的3D纳米片状结构,其分布相对均匀,该形貌具有较大的比表面积,进而暴露出更多的活性位点,为物质的传输提供更多的便利,对提高催化剂的OER催化性能具有重要意义。由图2(e)、图2(f)可知,Ni(OH)2与Fe1Ni4OH样品中均含有晶格间距为0.25 nm的晶相,对应于α-Ni(OH)2中的(101)[12-13],与XRD结论一致,表明Ni(OH)2与Fe1Ni4OH中均含有α-Ni(OH)2结构。

图2 Fe1Ni4OH与Ni(OH)2的SEM、TEM和HRTEM图Fig.2 Imagesof SEM,TEM and HRTEM of Fe1Ni4OH and Ni(OH)2
通过X射线能谱(XPS)对样品的元素组成及结构进行了分析,如图3所示。图3(a)、图3(b)和图3(c)分别表示Fe1Ni4OH的Fe元素2p轨道、Ni元素2p轨道和O元素1s轨道的XPS谱图,图3(d)表示Ni(OH)2的O元素1s轨道的XPS谱图。
由图3(a)可知,对应于Fe 2p3/2的位于712 eV处的衍射峰和对应于Fe2p1/2的位于724.5 eV处的衍射峰表示Fe元素主要以+3的价态存在于Fe1Ni4OH中[20-21];由图3(b)可知,对应于Ni 2p3/2的位于855.5 eV处的衍射峰和对应于Ni 2p1/2的位于873.5 eV处的衍射峰表示Ni元素主要以+2的价态存在于Fe1Ni4OH中[22];由图3(c)可知,Fe1Ni4OH的O可分为4个衍射峰,其中对应于O1的位于530.7 eV的衍射峰归属于O原子与金属Fe或Ni形成的共价键,对应于O2的位于531.7 eV的衍射峰归属于位于边缘的O原子或O空位,而大量的O空位可提高催化剂的电导率进而提高催化剂的OER性能;对应于O3的位于531.7 eV的衍射峰归属于羟基或吸附态的氧气;位于533.9 eV O4则可归属于吸附态的水[23]。同样的,由图3(d)的O1s谱图可知,Ni(OH)2中的O元素则可分为3个衍射峰,分别对应于O1、O2和O3,与图3(c)对比发现,Ni(OH)2中O2所占比例为59.95%,而Fe1Ni4OH中O2所占比例增加至63.48%,这说明,掺杂Fe元素后的Fe1Ni4OH催化剂中氧空位的数量有所增加,对提高催化剂的OER性能有重要作用[24]。
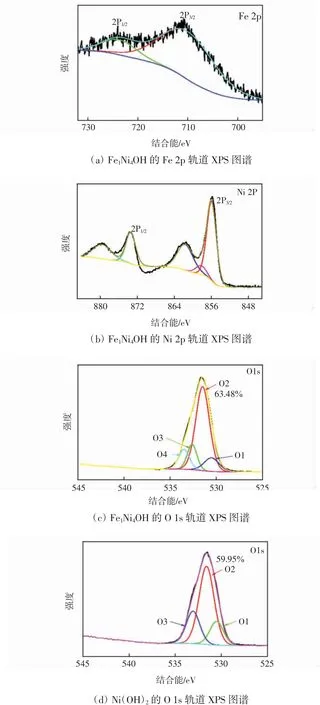
图3 催化剂的XPS图谱Fig.3 XPSspectrum of Fe1Ni4OH and Ni(OH)2
2.2 电化学性能表征
为研究催化剂的OER性能,对所制得的催化剂进行LSV测试,同时,在相同条件下对商业IrO2进行测试作为比较。
图4为各催化剂的LSV极化曲线和Tafel曲线。
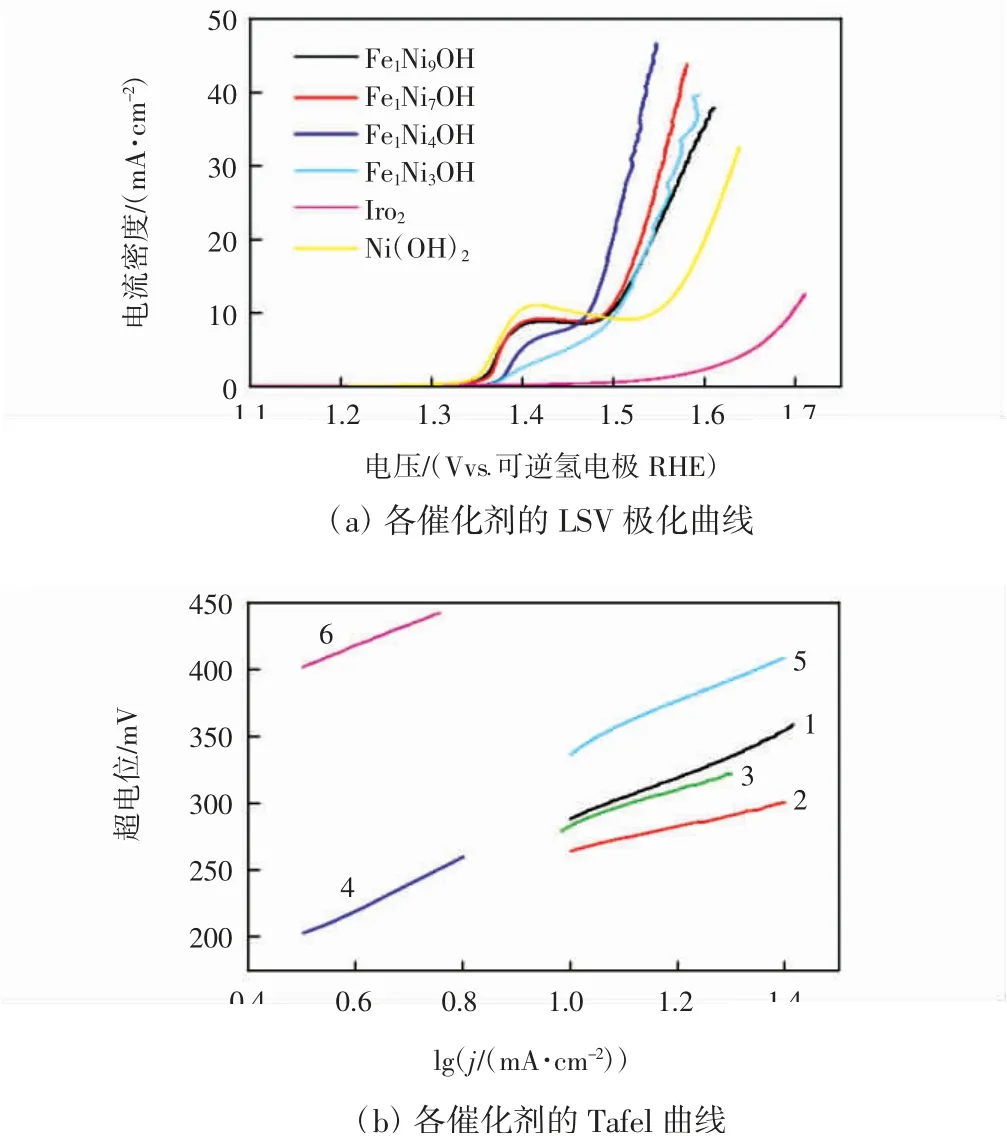
图4 不同Ni/Fe比例催化剂及商业Ir O2的LSV曲线和Tafel曲线Fig.4 LSV and Tafel curves of catalystswith different Ni/Fe ratiosand commercial Ir O2
由图4可知,在电流密度达到10 mA/cm2时,Fe1Ni4OH所对应的电位最低为1.477 V(vs.RHE),超电位为247 mV;Ni(OH)2所对应的电位为1.546 V(vs.RHE),超电位为316 mV;Fe1Ni9OH所对应的电位为1.496 V(vs.RHE),超电位为266 mV;Fe1Ni7OH所对应的电位为1.493 V(vs.RHE),超电位为263 mV;Fe1Ni3OH所对应的电位为1.502 V(vs.RHE),超电位为272 mV,IrO2所对应的电位为1.687 V(vs.RHE),即超电位为457 mV,由此可得,所制Ni(OH)2及不同Ni/Fe元素比例的FeNiOH催化剂均具有比商业IrO2更佳的OER催化性能,而经Ni/Fe元素比例调控后的Fe1Ni4OH的催化活性最高,表明Ni/Fe元素比例的调控对OER性能具有重要影响。需要注意的是,位于电压范围为1.35~1.45 V(vs.RHE)的肩峰起因于催化剂中的α-Ni(OH)2氧化为γ-NiOOH的过程[25],而γ-NiOOH的产生是促进OER反应进行的关键[26]。
Tafel曲线用于评判催化剂的OER动力学性能。由图4(b)可知,Fe1Ni4OH具有最低的Tafel斜率为87 mV/dec,IrO2的Tafel斜率为159 mV/dec,Ni(OH)2、Fe1Ni9OH、Fe1Ni7OH、Fe1Ni3OH的Tafel斜率依次为172、150、127和131 mV/dec,由此可得,Fe1Ni4OH的动力学反应活性显著提高。
图5为催化剂在相同条件下的电流密度-时间曲线与TOF值条形图。
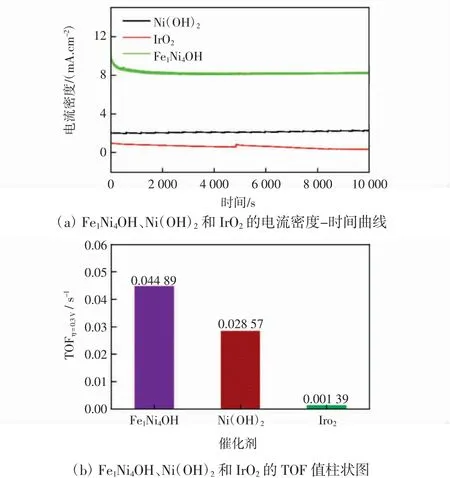
图5 Fe1Ni4OH、Ni(OH)2和Ir O2的电流密度-时间曲线和TOF值柱状图Fig.5 i-t curvesand histogramsof TOFvalueof Fe1Ni4OH,Ni(OH)2 and Ir O2
由图5(a)各样品的电流密度-时间曲线可知,在相同电压下,Fe1Ni4OH表现出最高的电流密度,约为10 mA/cm2;Ni(OH)2次之,约为2 mA/cm2;IrO2最低,约为1 mA/cm2,这与上述结论相一致,再一次证实Fe1Ni4OH具有最佳的OER催化性能。同时,在10 000 s的长期稳定性测试中,Fe1Ni4OH在前2 000 s内电流密度下降了17%,其归因于测试过程中部分催化剂脱落,但在之后的测试中维持在8.3 mA/cm2,表明Fe1Ni4OH活性维持在83%左右;Ni(OH)2则在测试后电流密度上升至2.3 mA/cm2,OER活性上升了0.15%,主要归因于Ni(OH)2老化过程中的氧化反应,产生大量的γ-NiOOH,促进了OER;而IrO2在测试过程中其电流密度逐渐下降至0.36 mA/cm2,其OER活性下降了64%。由以上分析可得,所制Ni(OH)2与Fe1Ni4OH均表现出优于商业IrO2的稳定性。
TOF值表示催化剂中活性位点的活跃程度,TOF值越大,表示催化剂内部活性越高,因此TOF值是评判催化剂的又一个重要参数。由图5(b)可知,在η=0.3 V时,Fe1Ni4OH的TOF最高为0.044 89,其次是Ni(OH)2为0.02857,IrO2最低为0.00139,表明Ni(OH)2与Fe1Ni4OH的内部活性优于商业IrO2,且Fe1Ni4OH表现出最佳的内部活性。
为进一步证明Fe1Ni4OH与Ni(OH)2的动力学活性,在1.53 V(未经iR补偿)进行了EIS测试。图6为各催化剂的EIS曲线。
由图6可知,与IrO2和Ni(OH)2相比,Fe1Ni4OH具有最小的电荷转移阻抗,这表明其具有最佳的导电性和最快的催化速率,结果与上述分析一致。
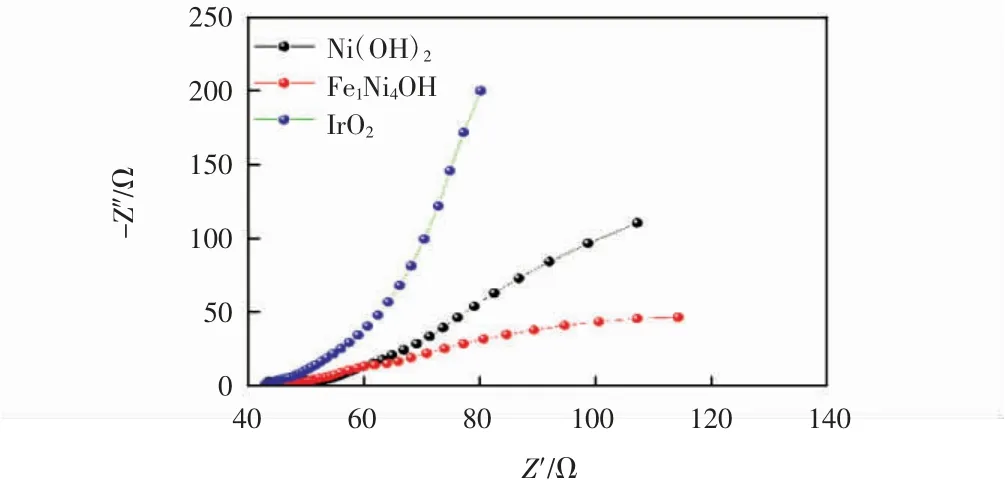
图6 Fe1Ni4OH、Ni(OH)2和Ir O2的EIS曲线Fig.6 EIScurves of Fe1Ni4OH,Ni(OH)2 and Ir O2
3 结论
本文在常温下利用简单的一步化学合成法成功制备了Fe掺杂α-Ni(OH)2的Fe1Ni4OH 3D纳米片作为OER高效催化剂,并对制备的催化剂性能进行表征。
(1)Fe1Ni4OH在电流密度达到10 mA/cm2时的超电位为247mV,远低于商业IrO2和所制备的Ni(OH)2,表现出极好的OER催化性能。
(2)与商业IrO2和所制备的Ni(OH)2相比,Fe1Ni4OH的Tafel曲线斜率最小为87 mV/dec,具有较好的动力学性能。
(3)在超电位η=0.3 V时,Fe1Ni4OH具有最大的TOF值为0.044 89,具有卓越的内部动力学性能。
(4)在10 000 s的稳定性测试中,其电流密度仅下降约17%,并长期维持在原始电流密度的83%左右,具有极佳的稳定性。
(5)在1.53 V(未经iR补偿)的EIS测式中,具有最小的电荷转移阻抗。
