NGS法检测197例非小细胞肺癌突变基因特征分析
2022-03-01曲春静白元松代恩勇
房 雪,曲春静,白元松,代恩勇
(吉林大学中日联谊医院 肿瘤血液科,吉林 长春130033)
肺癌是全球癌症致死的首位原因,占癌症致死总数的18%[1]。非小细胞肺癌(NSCLC)是最常见的肺癌组织类型,我国NSCLC患者基因变异谱不同于西方人群,高达60%的肺腺癌患者具有已知的致癌基因突变[2]。近年,多项研究[3-5]采用二代测序方法针对晚期NSCLC进行多基因检测。通过对全景基因突变的了解,能够更好的指导临床治疗,以临床实验为主体的突变分布数据可以一定程度上反映NSCLC的驱动基因分布,特别是少见及罕见基因分布的了解,有助于进一步指导临床治疗。
1 对象和方法
1.1 研究对象本研究收集了2019年12月至2021年9月就诊于吉林大学中日联谊医院的晚期NSCLC患者197例。回顾性收集患者的人口学、临床病理学、驱动基因突变状态等资料。所有患者数据均取自初诊治疗前标本(组织或外周血)的检测结果。利用第三方NGS平台行多基因突变检测,均含肺癌临床治疗指南推荐检测的肺癌9种驱动基因(EGFR、ALK、ROS1、KRAS、BRAF、ERBB2(HER-2)、RET、MET及NTRK)。
1.2 检测方法所有患者的病理组织均经常规病理确诊,癌组织量及血细胞量均足以进行基因检测,基因检测平台:Illumina(NextSeq 550AR/NovaSeq 6000),经NGS法进行多种驱动基因检测,操作方法和数据分析均遵循检测平台指南要求。
1.3 统计学方法统计学分析采用SPSS 25.0软件行χ2检验,P<0.05表示有统计学意义;绘图采用Microsoft Office Excel 2019及RStudio 4.1.1软件中R语言pheatmap包进行。
2 结果
2.1 晚期NSCLC患者驱动基因分布197例晚期NSCLC患者的基础信息见表1,驱动基因总阳性率为74.11%(146/197),EGFR为主要驱动基因,突变频率为48.22%(95/197),以常见的19外显子缺失突变(21.83%,43/197)和21外显子L858R突变(17.77%,35/197)为主,还有20外显子插入突变和T790M突变各占2.54%(5/197)。其他突变基因突变率由高到低依次为 KRAS突变(14.72%,29/197)、ALK和MET突变均为(8.12%,16/197)、ERBB2(HER-2)突变/扩增(5.58%,11/197)、ROS1(4.57%,9/197)、BRAF突变(3.55%,7/197)、NTPK突变(3.05%,6/197)、RET突变(2.54%,5/197)。同时在这些少见驱动基因中,发现典型驱动基因发生事件如下:KRAS G12C突变占7.11%(14/197)、EML4-ALK融合占4.06%(8/197)、MET扩增占2.54%(5/197)、BRAF V600E突变和RET融合各占2.03%(4/197)、ROS1融合占1.02%(2/197)、MET-14外显子跳跃突变占0.51%(1/197),见图1。
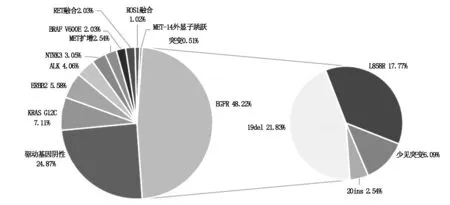
图1 197例NSCLC患者驱动基因突变频谱

表1 197例NSCLC二代测序下基因检测结果
2.2 晚期NSCLC驱动基因事件与临床特征之间的关系晚期NSCLC驱动基因突变状态与病理类型有关(P=0.002)。在入组的197例患者中,腺癌184例,非腺癌13例(鳞癌12例、肉瘤样癌1例),驱动基因阳性率为:腺癌76.63%(141/184)、非腺癌38.46%(5/13);而与性别及年龄差异无统计学意义(P>0.05),见表2。

表2 197例NSCLC患者的临床特征
2.3 共突变及互斥突变情况发生事件在这197例晚期NSCLC患者中,所有驱动基因变异不只单独出现,还检测到共突变与互斥突变事件,且全部发生在肺腺癌中。本研究中肺腺癌存在的经典的共突变:EGFR-EGFR共突变、EGFR-TP53共突变、KRAS-TP53共突变及ALK-TP53共突变,分别为9例、41例、8例、1例。在EGFR突变的91例肺腺癌中,EGFR-TP53共突变最常见,发生率为45.05%(41/91),EGFR-EGFR共突变则占9.89%(9/91)。另外,还存在互斥突变:EGFR-KRAS 2例、ALK-KRAS 1例。
2.4 各驱动基因分布状态及突变丰度的差异性本研究挑选了最近指南中可作为治疗靶点的基因变异:EGFR、ALK、ROS1、KRAS、BRAF、ERBB2(HER-2)、RET、MET及NTRK,借助热图更加直观的展现肺腺癌中上述驱动基因分布状态及突变丰度的差异性,可见不同驱动基因之间突变丰度有很大差异,同一驱动基因不同患者之间突变丰度也相差很大,突变丰度高的区域主要集中分布在EGFR、TP53,详见图2。

图2 肺腺癌中EGFR、ALK、ROS1、KRAS、BRAF、ERBB2(HER-2)、RET、MET及NTRK驱动基因分布状态及突变丰度的差异性
3 讨论
研究纳入的197例NSCLC患者中,主要检测研究了9个靶向基因(包括EGFR、ALK、ROS1、KRAS、BRAF、ERBB2(HER-2)、RET、MET及NTRK)的突变状态分布及与临床特征的关系,数据显示,大约有74%(74.11%)的患者至少有1种驱动基因突变阳性,少数患者出现了共突变或互斥突变。最常见的突变是EGFR,大约一半(48.22%)的患者检出,其次是KRAS、ALK等,与既往报道一致[6]。EGFR、KRAS突变的发生率因种族而异,EGFR突变在亚洲人患者中更为常见,而KRAS突变在白种人中更为常见。白种人中EGFR只有10%-15%的突变率,相反,最常见的致癌驱动基因突变为KRAS突变(30%)[2,7],在临床实践及临床研究中需要注意到这种差异。KRAS是继EGFR突变后的第二大突变位点,本研究中KRAS突变发生率占14.72%(29/197),KRAS突变阳性的29例患者中近一半为KRAS G12C突变(14/29),KRAS G12C是主要的突变类型,与一项来自韩国的研究报道一致[8]。随着G12C突变位点的药物研发突破,KRAS也成为了可用药靶点。ALK作为继EGFR之外研究最为久远的经典靶标,EML4-ALK是ALK融合的主要类型(4.2%),并且均为腺癌患者[9],本研究中EML4-ALK融合占4.06%。与ALK基因位点相近,ROS1基因融合在NSCLC中的发生率较低,但对于靶向治疗具有非常好的疗效。本组中ROS1融合阳性率为1.02%。此外,不同研究可能会因为检测方法和检测样本的不同导致检测结果存在一定的差异。本研究样本量较少,需要进一步扩大样本量加以证实。
目前的肺腺癌分子分型及靶向治疗主要基于单驱动基因改变,随着测序研究的深入,一些基因突变之间有很高的共发生率,定义为共突变;而另一些基因突变之间则很少甚至从不一起出现,定义为互斥突变。共同发生的基因组改变,特别是在肿瘤抑制基因如TP53和STK11中,已经成为致癌基因驱动的肺癌亚群的分子和临床异质性的核心决定因素[10]。本研究中发现了多例基因共突变的患者,EGFR-EGFR、EGFR-TP53、KRAS-TP53及ALK-TP53。在EGFR突变的91例肺腺癌中,EGFR-TP53共突变最常见,发生率为45.05%(41/91)。KIM等人的研究[8]中发现TP53是最常见的突变基因(46.9%),与之报道相符。且有研究报道[11-13]EGFR 突变型肺癌的共突变表达谱具有预后及预测意义,EGFR-TP53 共突变与 TKI 疗效相关,并发现TP53突变是一个独立的不良预后因素。TP53是一种重要的肿瘤抑制基因,也是大多数癌症中最常见的突变基因,这一点已被公认。另外,既往报道[14-15]认为EGFR、ALK与KRAS为互斥突变,即EGFR、ALK和KRAS突变在NSCLC中是相互排斥的,尽管在包括中国在内的一些亚洲人中,已经报道了一些EGFR、ALK和KRAS突变共同存在的病例[16-18],且都提示预后不佳。HU等人进行的一项研究中得出结论:存在共突变的患者较单一EGFR突变患者的无进展生存期(PFS)明显缩短(6.0个月 vs 10.9个月,P=0.002),然而对总生存期(OS)没有显著影响(17.6个月 vs 21.0个月,P=0.17)[19]。本研究中发现EGFR-KRAS 2例、ALK-KRAS 1例,相关预后问题还待进一步研究。
近年来,随着基因检测技术的进步,越来越多的致癌驱动基因被发现,推动了NSCLC靶向药物的研发和临床应用,但是靶向耐药问题不可避免,传统检测方法已不能满足目前的临床需求,全面的肿瘤分子测序方法成为刚需。目前国内外已发表多个NGS检测技术指南,2020年中国肺癌杂志发布的《二代测序技术在NSCLC中的临床应用中国专家共识(2020版)》[20]旨在为我国NSCLC临床诊疗规范提供了技术指引。此外,在常规的NSCLC患者分子谱分析中应用NGS技术的可行性和成本效益已在研究中[21]证实,可节省相当的周转时间和检测成本,并可检测具有潜在预后和预测意义的共突变。在肺癌精准治疗的时代,NGS将发挥越来越重要的作用。
