初诊原发性甲状腺淋巴瘤临床病理因素分析
2022-03-01王凌宇孟令俊顾桂颖毕林涛
王凌宇,韩 冷,孟令俊,周 迪,顾桂颖,毕林涛
(吉林大学中日联谊医院 肿瘤血液科,吉林 长春130033)
原发性甲状腺淋巴瘤(PTL)极为罕见,发病率仅占甲状腺恶性肿瘤的1%-5%,占结外淋巴瘤的3%[1],年发病率约为2/100万[2]。由于PTL发病率极低,临床特征不明显,易误诊为甲状腺炎或甲状腺癌。该疾病临床表现及组织学表现均具有异质性,大多数 PTL 是 B 细胞来源的非霍奇金淋巴瘤,其中弥漫大B细胞淋巴瘤(DLBCL)为最常见的组织学类型,其次是边缘区和滤泡性淋巴瘤[1]。对于甲状腺DLBCL,最常用的治疗方法是以【CHOP】方案为代表的多药联合化疗,化疗基础上联合利妥昔单抗将取得更佳的疗效,也可根据病情采取手术切除和放射治疗等治疗手段[3]。在目前治疗方案下,PTL 的总体预后良好,中位生存期为11.6年[4]。死亡风险的增加可能与年龄、病理分型为DLBCL、更高的疾病分期相关[4]。文献显示,关于原发性甲状腺淋巴瘤的报道多为小样本的回顾性分析,且相关临床数据、病理因素、是否经规范诊治方面仍存在不足[5-8]。本文旨在通过分析吉林大学中日联谊医院肿瘤血液科PTL患者的临床病理特征、诊治方案和预后情况,进一步提高对该疾病的认识,减少误诊及漏诊,为规范化诊疗及更好的判断预后提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2011年9月-2020年12月就诊于吉林大学中日联谊医院的13例PTL患者的临床资料,其中男性4例(30.77%),女性9例(69.23%),年龄分布41-82岁,中位年龄为61岁。所有病例均经活检病理确诊,临床分期依据Ann-Arbor系统。回顾性分析所有患者的性别、年龄、临床表现、伴随症状、实验室检查、影像学检查、病理类型、免疫组化、临床分期、治疗方案和预后等。
1.2 临床表现
13例患者中所有患者均伴有颈部肿块、甲状腺肿大,其中单侧局限性肿块者1例(1/13),双侧多个肿块12例(12/13)。由原发肿块所致的压迫等伴随症状者中,1例(1/13)合并咳嗽,11例(11/13)合并气短、呼吸困难,6例(6/13)合并进食困难。有B症状者2例(2/13),其中1例为盗汗,另1例为体重减轻。外周血淋巴细胞比值减少者6例(6/13),比值正常者7例(7/13)。13例患者中10例(11/13)LDH增高,2例(2/13)正常。β2微球蛋白升高者5例(5/13),7例(7/13)正常,另有1例数据缺失,见表1。

表1 PTL的实验室检查资料
基金项目:吉林省财政厅吉林省卫生科研人才专项(2018SCZ031,2019SCZ055);吉林省卫生计生委吉林省卫生技术创新项目(3D517ED43430);吉林省科技发展计划项目(20180101124JC)
*通讯作者;#共同第一作者
1.3 影像学及其他检查
本组病例均行甲状腺彩超检查,多提示甲状腺腺体体积增大,内部回声粗糙不均匀减低、团块状的异常回声区。上述表现与桥本氏甲状腺炎难以鉴别,缺乏诊断的特异性,见图1。行PET-CT检查者7例(7/13),多表现为甲状腺局部或弥漫性糖代谢异常增高,与周围软组织分界不清,见图2。行颈部CT者3例(3/13),多表现为甲状腺局部或弥漫性肿大,其内部密度不均匀。

图1 1例DLBCL患者甲状腺彩超见甲状腺右叶回声不均匀,多个边界不清的低回声区,较大者约2.2*0.8 cm。

图2 1例DLBCL患者PET-CT显示双侧甲状腺及峡部弥漫性增大,最大SUV值为36.28
1.4 病理及诊断
1.4.1确诊方法 13例患者中12例行超声引导下甲状腺细针穿刺(FNAC),1例行甲状腺肿物部分切除术病理确诊。病理切片均采用HE染色,显微镜下见大细胞弥漫性增生,提示组织内部有异型细胞巢,其间可见核分裂像。13例均为CD20阳性,提示为B细胞来源。其中11例(11/13)为弥漫性大B细胞淋巴瘤(DLBCL),根据HANS模型分类DLBCL中3例患者(3/11)为Non-GCB起源,其余8例(8/11)提示GCB起源。1例(1/13)为滤泡性淋巴瘤(FL)。1例(1/13)表现为低级别黏膜相关结外边缘区淋巴瘤(MALT)。
1.4.2误诊 PTL发病率较低,临床及影像学等表现不具有特异性,加之临床医生认识不足,因此误诊、漏诊率高,本组病例13例中有2例(2/13)患者误诊,其中1例(1/13)误诊为良性甲状腺结节,另外1例(1/13)误诊为桥本氏甲状腺炎。
1.5 治疗与结局
13例患者病理免疫组化均为CD20表达,均可应用抗CD20单抗-利妥昔单抗靶向治疗,但仅有11例(11/13)行上述治疗,2例(2/13)因经济因素未行上述靶向治疗。利妥昔单抗联合化疗者10例(10/13),利妥昔单抗联合来那度胺者1例(1/13)。全身化疗者12例(12/13)。单纯化疗者2例(2/13)。化学治疗方案的患者中采用CHOP方案者7例(7/13),CVP者4例(4/13),CHOPE者1例(1/13)。见表2。
所有患者均规律随访,通过门诊随诊、电话联络的方式了解患者生存状况及后续治疗等情况。随访时间为1个月-109个月,中位随访时间为20个月,截止至2020年12月。存活11例,2例因疾病复发进展分别于2014年2月份及2019年6月份死亡。
1.6 预后
13例PTL患者的预后评分均采用NHL国际预后指标(IPI评分)分层[9]。13例患者中<60岁者6例(6/13),≥60岁者7例(7/13),按照上述评分标准,低危者4例(4/13),中低危者4例(4/13),高中危者3例(3/13),高危者2例(2/13),见表2。
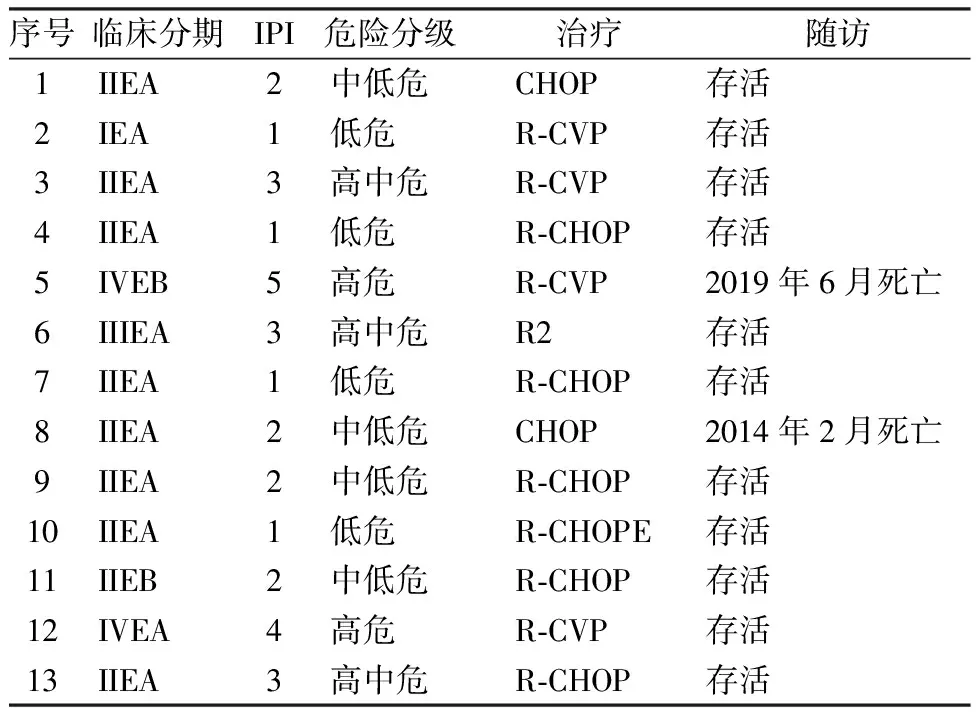
表2 PTL的临床分期、治疗及随访
2 讨论
PTL多发于60岁以上的人群,文献显示发病中位年龄为65.8岁[4]。PT女性发病率高于男性,男女比率为1∶3-1∶8[4],有学者认为这种差异归因于女性慢性甲状腺炎的患病率明显高于男性[4],但具体原因尚待进一步研究。本组病例资料患病性别以女性为主,发病中位年龄为61岁,与文献报道相近。但男女发病率比为4∶9,考虑与样本量小有关。
桥本氏甲状腺炎即慢性淋巴细胞性甲状腺炎(又称自身免疫性甲状腺炎)为患PTL的高危因素。虽然自身免疫性甲状腺炎患者患PTL的风险较正常人群增高40-80倍[10],但最终只有极少数的患者会发展为PTL(0.6%)[11]。Chai等[3]报道的38例PTL患者中,合并桥本甲状腺炎者高达86.6%。有学者认为,自身免疫疾病引发淋巴细胞分泌自身抗体,进而刺激增生的淋巴组织出现变异、克隆性增殖,最终发展为淋巴瘤[3,11]。
另有研究显示PTL与EB病毒感染相关,但具体机制不明[11]。本组病例中仅有2例患者进行EB病毒检测,均为阴性,其中1例为肾移植术后患者,有临床研究显示肾移植术后淋巴瘤发生可能和长期免疫制剂使用后的EB病毒感染、淋巴细胞增殖失调、T细胞功能受损相关[12],提示长期免疫抑制状态下的患者需注意淋巴瘤发生的可能。
PTL患者在疾病早期,常表现为迅速增大的颈部肿块,同时由于肿物较大可出现局部压迫症状,这对临床诊断有很大的意义。另有部分患者伴有不同程度的甲状腺功能减退(约1/3)[1]。本组病例在诊断时均有颈部肿块,其中大部分有局部压迫症状。伴有甲状腺功能减退者5例(5/13)。
对肿物行病理穿刺活检是PTL诊断的金标准。临床中常采用超声引导下细针穿刺(FNAC)、粗针穿刺(CNB)、外科切除病理确诊。研究表明,FNAC对DLBCL的诊断阳性率较高,50%-90%的PTL患者经细针穿刺病理检查可确诊[13-16]。CNB是确诊PTL的另一个重要方法,能够取得足够的组织来确诊淋巴瘤。据报道,CNB的敏感性可达87.5%-100%,阳性预测率可达100%[17-18]。甲状腺恶性肿瘤诊断的特异性和敏感性分析显示,CNB 和 FNAC之间无显著统计学差异[19]。本组病例DLBCL患者的诊断均为经FNAC确诊。由于桥本氏甲状腺炎与PTL,特别是MALT淋巴瘤的形态学相似,与传统的外科切除术中活检比较,FNAC和CNB仍存在一定的弊端,取材通常较局限,不易取得典型病变导致判断困难或误诊,本组病例中,1例患者经FNAC未确诊,最终为经外科部分切除活检病理确诊FL,虽手术不为常规诊断手段,但当FNAC或CNB病理未明确诊断但高度怀疑PTL时,应外科配合进行二次取材活检来明确诊断,以免延误病情。
另外,文献报道高达95%的PTL患者血清抗甲状腺球蛋白抗体升高,1/3的患者血清乳酸脱氢酶水平升高[20-21]。影像学方面,超声是观察甲状腺和颈部淋巴结的最基本的诊断技术,有助于鉴别和排除其他快速增长的病变,如出血和亚急性甲状腺炎[15]。但PTL在超声上常表现为明显的低回声肿块或结节[17],因此应与亚急性甲状腺炎、局灶性慢性甲状腺炎、部分甲状腺癌和转移性甲状腺癌相鉴别。根据超声内部回声、边界、后回声特点,甲状腺淋巴瘤可根据其后方回声与之鉴别,但仍缺乏诊断的特异性[22]。彩超为主的影像学检查可对颈部包块、桥本氏甲状腺炎患者进行长期监测,当出现迅速增长的颈部肿块或伴有压迫症状的桥本氏甲状腺炎患者,应尽快行活检病理明确诊断。另外,18F-FDG PET/CT全身显像能够提供淋巴瘤侵犯脏器的病灶数目、大小及范围,以便进一步确定临床分期,从而制定诊治计划,评估预后,PET/CT与其他影像学检查对比更具有优势[23]。本组病例中有2例误诊。1例为MALT患者,误诊为桥本甲状腺炎,1例为DLBCL患者,误诊为良性甲状腺结节,考虑与临床表现不特异及医务工作者对PTL认识不足相关。
治疗方面,因该病发病率极低而缺少大样本的临床研究,最为有效的PTL治疗方案尚存在争议,总体上以病理分型和患者一般状态为基础。IE期局限性、惰性淋巴瘤考虑单纯放射治疗[24],而DLBCL或非局限性MALT淋巴瘤应接受免疫治疗、化疗和放疗[25]。对于CD20+的患者,联合利妥昔单抗是一线治疗。
该病预后与病理类型、临床分期密切相关。DLBCL侵袭性较强,5年生存率仅为 45%-75%[18]。MALT、FL因其惰性特征,对治疗反应较好,5 年生存率可达 62%-96%[5]。有研究显示患者预后受多种因素影响,除病理分型及临床分期外,免疫组化特征、病变大小、恶性程度、脉管是否受累、上纵膈是否受侵、IPI指数、β2-微球蛋白以及治疗方式等因素也与预后相关[16,26-28]。本组病例2例死亡均为DLBCL患者,其中1例为Non GCB起源,1例为GCB起源;治疗方案分别为CHOP和R-CVP。其原因可能与患者年龄较大,病理类型侵袭性等因素相关。DLBLC中淋巴细胞比例减少、淋巴细胞与单核细胞的比值(LMR)减低提示预后差[29-30]。Rambald等[30]认为,LMR≤2.6者4年总生存期73%,LMR减少与LDH升高、临床分期晚、IPI指数高、ECOG评分高等预后不良因素相关。本组病例2例死亡患者,淋巴细胞比例为14.9和26.1,淋巴细胞减少者为1例,2例患者LMR值分别为2.00及4.14。仍需更多的临床研究来明确LMR在淋巴瘤预后中的意义。
综上所述,PTL为罕见病,临床表现无特异性,极易被漏诊甚至误诊。我们通过对这13例患者的分析得出如下心得:PTL是原发于甲状腺的淋巴瘤,女性发病率高于男性,临床常常表现为颈部肿物。但临床表现和影像学表现不具有诊断特异性。病理为该病诊断的金标准。PTL的治疗方案的选择以病理分型和免疫组化、患者一般状态为指导。其中对于CD20+的患者,化疗联合利妥昔单抗是一线治疗。预后及治疗效果与病理组织类型和临床分期、治疗方案等密切相关。通过总结PTL病例资料,有望使患者获得早期诊断,并进一步改善该疾病的预后。
作者简介:王凌宇(1993-),女,吉林省吉林市人,住院医师,医学硕士,主要从事恶性血液系统疾病方面的研究。毕林涛,医学博士,主任医师,硕士研究生导师。
