皮肤源性前体细胞的分离及其向神经系统细胞的诱导分化研究
2022-02-28芦小刚鲍全伟
芦小刚,鲍全伟
脊髓损伤(spinal cord injury,SCI)后的功能恢复是医学的难点之一,目前临床尚无有效治疗手段,有报道[1]称采用鞘内注射甲泼尼龙方法治疗不全性SCI获得了一定疗效。干细胞移植被认为是修复SCI功能损伤最有前景的方法之一[2-5]。由于来源受限、组织相容性和伦理道德等方面的原因,胚胎干细胞和神经干细胞等在临床的应用前景受到一定的限制[3-5]。皮肤是机体最大的器官,位于体表,易于取材,目前已经证实可从人、猪、山羊、小鼠和大鼠等真皮组织中分离到一种神经嵴来源的前体细胞,即皮肤源性前体细胞(skin-derived precursors,SKPs),在适当的诱导条件下,向神经系统细胞有较高的分化率,显示其在脊髓损伤修复中良好的应用前景[4-7]。本研究拟观察可否从截瘫病人背部皮肤分离到SKPs,并能否被诱导为神经元和施万细胞等神经系细胞,以明确其在脊髓损伤病人的自体细胞移植中是否具有应用前景。
1 材料与方法
1.1 材料 胰酶、Neurobasal培养基、胎牛血清、培养瓶等细胞培养用品购自美国Hycolone公司,碱性细胞生长因子-2(fibroblast growth factor-2,FGF2)、表皮细胞生长因子(epidermal growth factor,EGF)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和神经营养素-3(Neurotrophin-3,NT-3)购自BD公司。维甲酸购自Sigma-Aldrich公司,heregulin β购自R&D Systems公司,一抗抗fibronectin、nestin、vimentin、cytokeratin、CNPase、GFAP、βIII-tubulin和PE或FITC结合的二抗均购自Santa-Cruz公司。Hoechst 33258购自碧云天公司。
1.2 SKPs的分离培养 6例胸椎骨折伴截瘫病人,其中男4例,女2例,年龄26~51岁;6例不伴截瘫病人,其中男5例,女1例,年龄32~49岁;在进行脊柱的手术时从切口边缘切取0.5 cm×4 cm的皮肤,该操作均未影响病人切口愈合。在进行此项实验前,均告知病人实验内容,并签署同意书。实验通过陆军军医大学第二附属医院临床伦理委员会的批准。
获得皮肤后,聚维酮碘消毒后磷酸缓冲液(phosphate-buffered saline,PBS)冲洗后组织剪将皮肤剪成1~2 mm3碎片,0.5%胰酶37 ℃消化4 h。然后去除表皮层,吹打后过滤离心收集细胞,加入含40 ng/mL FGF2和20 ng/mL EGF的Neurobasal培养基进行培养。大约14 d后,可有悬浮细胞球生长,进行常规的传代和扩增。
1.3 SKPs向神经系细胞的诱导分化 向神经元分化的诱导培养基为Neurobasal培养基+10%FBS+10 ng/mL BDNF+10 ng/mL NT-3+ 6 ng/mL维甲酸,向施万细胞分化的诱导培养基为Neurobasal培养基+10%FBS+10 ng/mL heregulin β。收集第三代的SKPs并制备成细胞悬液后以3×104/cm2的密度接种到培养板中,使用的培养基为Neurobasal培养基+10%FBS。24 h后细胞大部分呈贴壁生长,更换为诱导培养基,以后每3 d左右更换一次诱导培养基。诱导约2周后进行荧光免疫细胞化学检测。
1.4 细胞免疫荧光组织化学 使用细胞免疫荧光组织化学检测SKPs的细胞表型以及诱导后SKPs的分化情况。对于SKPs,将100 μL含SKPs的培养液转移到盖玻片上,自然晾干后95%乙醇固定进行组织化学检测;对于诱导后的SKPs,直接95%乙醇固定进行组织化学检测。固定后,PBS漂洗3次,然后加非特异性封闭血清封闭后加一抗,4 ℃孵育过夜。PBS漂洗3次后加入相对应的二抗,室温孵育1 h。如果进行双标,同样的方法进行第二种抗体的检测。激光共聚焦显微镜或普通荧光显微镜观察和摄像。为了计算每种抗原阳性细胞的比例,用Hoechst 33258复染细胞核,计算阳性细胞占所用Hoechst 33258阳性细胞的百分比。
1.5 统计学方法 采用t检验和χ2检验。
2 结果
2.1 SKPs的形态观察 从截瘫及非截瘫病人获得皮肤进行原代培养后的最初几天内,大多细胞贴壁生长,只有少量原代细胞悬浮;约7 d后,出现悬浮细胞组成的小球状细胞团块;12~14 d,悬浮的细胞球体积变大。此时,进行常规的传代和扩增,可见细胞球得以成功扩增。经过3次扩增后,从每个皮肤标本可以获得约3×105悬浮的细胞球,截瘫病人和非截瘫病人的SKPs形态大小差异无统计学意义(P>0.05)(见表1、图1)。

表1 SKPs悬浮细胞球直径大小比较
2.2 SKPs的细胞表型 通过细胞荧光组织化学检测,发现从截瘫和非截瘫病人皮肤分离所得的SKPs均为Nestin和Fibronectin阳性,Vimentin弱阳性,Cytokeratin阴性(见图2),以Nestin阳性的SKPs来计算SKPs总获得率,截瘫病人和非截瘫病人的SKPs总获得率差异无统计学意义(P>0.05)(见表2)。
表2 Nestin阳性细胞率情况[n;百分率(%)]
2.3 SKPs向神经系统细胞的定向分化 经过2周的诱导分化,可见从截瘫和非截瘫病人皮肤分离所得的SKPs均可被诱导为βⅢ-tubulin阳性细胞(潜在的神经元细胞,见图3)和CNPase与GFAP共阳性细胞(潜在的施万细胞,见图4)。进一步统计分析表明二者向神经元和施万细胞分化的比率差异无统计学意义(P>0.05)(见表3)。

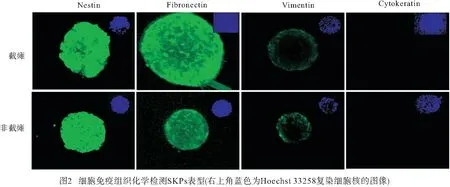


表3 SKPs向神经元细胞及施万细胞分化情况[n;百分率(%)]
3 讨论
由于具有取材方便、来源丰富、可进行自体移植等特点,皮肤来源的干细胞移植用于治疗SCI具有神经干细胞和胚胎干细胞等不具备的优势。目前,已有多种类型的干细胞从皮肤中分离,如SKPs[4-7]、真皮间充质多能干细胞[8]、表皮干细胞[9]、真皮纤维母细胞[10]等,它们均可在适当的条件在被诱导为神经元或胶质细胞,在脊髓损伤等神经损伤修复中有良好的应用前景。但从诱导为神经系统细胞的比率看,SKPs向神经元和施万细胞分化的概率明显高于其他几种类型的干细胞,这可能与其是神经嵴来源有关[6-7]。将SKPs直接移植或诱导为施万细胞后移植到挫伤脊髓处,结果发现移植后12周,移植的细胞存活,可减少脊髓损伤形成的空洞,再髓鞘化宿主的轴突,可吸引内源性的SC到损伤局部,并伴有良好的神经功能恢复[11]。因而,SKPs是自体细胞移植治疗SCI的较好选择。
在富含毛囊的面部和头部皮肤中,SKPs数量众多,分离较为容易。在背部皮肤中,神经嵴来源的细胞局限于含胶质细胞的神经末梢等部位,数量相对较少[12]。本文的结果显示,经过3次传代后,可获得约3×105悬浮的细胞球,略低于从人面部和头皮中获得SKPs悬浮球的数量[13]。但由于背部皮肤可以在手术时从切口边缘获得,不会对病人造成二次创伤,较从面部和头皮取材容易被病人接受。且截瘫病人与非截瘫病人背部皮肤均可获得SKPs,其获得率无明显差异,这也为截瘫病人自体干细胞移植提供了理论基础。

SHERMAN等[6]使用含5%FBS的基础培养基诱导SKPs,发现其向神经元分化的概率约为6%,向胶质细胞分化的概率约为10%(多为星形胶质细胞),而向施万细胞分化的能力极弱。而向诱导培养基中加入BDNF、NT3和维甲酸后,向神经元分化的概率可增加到9.4%左右[7]。heregulin β是神经嵴微环境的相关信号蛋白,将其加入诱导培养基后,可增加SKPs向施万细胞的分化概率[9]。使用类似的诱导条件,我们发现从截瘫病人背部皮肤中分离所得的SKPs向神经元分化的概率约为10.4%,向施万细胞分化的概率约为5.9%,同JOERY等[7,13]报道的分化概率接近,即截瘫病人自体的SKPs在适当条件诱导下仍然具有良好的分化潜能。
综上,本研究发现可从截瘫病人背部皮肤中分离得到SKPs,并可在适当的条件下被诱导为神经元和施万细胞,表明在SCI自体细胞移植中具有良好的应用前景。
